物化因素对燕麦球蛋白纳米纤维形成的影响
2011-11-02黄庆荣石彤非范晓丹杨日福丘泰球
刘 刚,黄庆荣,石彤非,范晓丹,杨日福,丘泰球,*
(1.华南理工大学轻工与食品学院,广东广州510640;2.美国罗特格斯大学,美国新泽西州08901; 3.中国科学院长春应用化学研究所高分子物理与化学国家重点实验室,吉林长春130022)
物化因素对燕麦球蛋白纳米纤维形成的影响
刘 刚1,黄庆荣2,石彤非3,范晓丹1,杨日福1,丘泰球1,*
(1.华南理工大学轻工与食品学院,广东广州510640;2.美国罗特格斯大学,美国新泽西州08901; 3.中国科学院长春应用化学研究所高分子物理与化学国家重点实验室,吉林长春130022)
以燕麦球蛋白为原料,采用透射电镜和原子力扫描电镜探讨了不同因素条件(重点研究了加热温度、pH、加热时间、加热时搅拌的速度)对燕麦球蛋白纳米纤维形成的影响,并对形成的纳米纤维进行了表征,研究结果表明:形成纳米纤维的最佳条件温度为85℃,pH为2.0,搅拌速度值为400rad/s;在最佳条件下加热2~24h过程中形成的燕麦球蛋白纳米纤维的半宽高分布范围在33.1~52.1nm,螺距大小大约分布在53.9~79.9nm,燕麦球蛋白纳米纤维的高度是10.2~13.1nm;纤维伸直长度0~9.0μm,溶液粘度显著增加。研究对改变蛋白质溶液的流变特性有较强的理论意义和现实价值;为食品蛋白质的开发和利用提供了新的思路,同时为功能食品的发展奠定了一定的基础。
燕麦球蛋白,纳米纤维,螺距,伸直长度
1 材料与方法
1.1 材料与仪器
燕麦 蛋白质15.2%,脂肪9.5%,碳水化合物60.2%,水分8.5%,灰分1.04%,市购;所用试剂 均为分析纯。
CR22G高速冷冻离心机 日本HITACHI Koli公司;S20 Seven Easy pH酸度计 法国METTLER TOLEDO公司;Rapid N cube杜马斯定氮仪 瑞士Bu chi公司;DELTA1-24/LSC冷冻干燥机 德国CHRIST公司;DF-1集热式磁力搅拌器 金坛市新一佳仪器厂;JEM-1011透射电镜 日本JEOL公司; SPI3800N原子力扫描电镜 日本 Seiko公司; FA1004型分析天平 上海精科仪器有限公司。
1.2 实验方法
1.2.1 燕麦球蛋白的制备 燕麦球蛋白的分离参考Osborne[20]的方法并做适当调整,分离蛋白提取采用Tang等[21]的方法,具体步骤如下:
燕麦球蛋白(OG)的制备:燕麦粉与去离子水以1∶15(w/v)的比例搅拌1h后,离心(8000×g,15min,20℃),将剩余的残渣用0.5mol/L NaCl溶液以1∶5 (w/v)比例混合均匀后在室温下搅拌1h,离心(8000 ×g,15min,20℃),上清液透析24h后再次以相同条件离心,弃去上清液,将沉淀加5倍质量的水后用1mol/L NaOH调节到pH 7.0,冻干即得OG样品。
1.2.2 燕麦球蛋白纳米纤维的制备 使用去离子水配制燕麦球蛋白溶液,蛋白浓度5mg/mL,磁力搅拌均匀后,用1mol/L的HCl调节pH至2。使用离心分离(18000×g,20min,20℃)去除溶液中的微量不溶物。在不同加热温度(55~95℃)、pH(1.0~9.0)、加热时间(2~24h)、和加热时搅拌的速度(0~400rad/s)等处理条件下加热制备纳米纤维。
1.2.3 原子力显微镜分析 原子力显微镜实验是在日本Seiko Instruments Inc.生产的扫描探针显微镜(scanning probe microscope,SPM)上进行的。该仪器由SPI3800N Probe Station和SPA-300HV Unit组成。滴加1~2滴稀释到0.1mg/mL的样品溶液到新鲜剥开的云母片表面,在常温下自然干燥。置于探针下方金属平台上,使用探针弹性常数为2N/m。
本工作中AFM的测量条件如下:采用敲击式(tapping mode)AFM(TM-AFM,即DFM)进行了测量,同时得到了所有样品表面的形貌图(topography image)和相位图(phase image)。
1.2.4 透射电镜 使用透射电镜来观察蛋白质淀粉样纤维的微观结构。将不同处理方式的样品稀释到蛋白浓度为0.1mg/mL。然后将样品滴加到专用铜网的碳膜上,15s后将铜网碳膜上的蛋白质样品用0.1%(w/w)磷钨酸进行负染色处理,每个样品用两个碳膜制备。将制备好的样品放入常温干燥箱中干燥,待干燥后进行透射电镜的观察,操作电压为80kV。
1.2.5 流体粘度的测定 将蛋白液在美国TA公司ARE-G2型流变仪上操作测定液体的粘度。转盘直径27.83cm,间距1mm。剪切速率0.1~100s-1,每个样品剪切程序设置为120s,每4s记录一个数据点,每个样品粘度重复测量三次。
2 结果与讨论
2.1 热处理温度对燕麦球蛋白纳米纤维的影响
原子力显微镜从纳米尺度提供了蛋白质纤维化聚集的结构变化信息,在本实验中用来表征不同处理方式而造成的蛋白微结构的变化,但是原子力扫描电镜的扫描效果容易被样品的形貌影响,特别在盐处理过程中,针尖易被污染,影响扫描效果;而透射电镜受样品的影响较小,并且相对于原子力扫描电镜更容易得到同一个样品中能典型代表样品信息的图片,即纤维的平均长度信息和聚集信息,但是难以表达蛋白微结构的变化,即高度信息和特征形貌,因此,采用结合透射电镜和原子力扫描电镜来分析不同因素对燕麦球蛋白纳米纤维的长度和微观结构的影响,来判断纳米纤维形成的最佳条件。
图1为燕麦球蛋白溶液分别在55、65、75、85、95℃温度条件下(搅拌速度400rad/s)热处理24h形成纳米纤维的透射电镜图,结果表明,在55~95℃之间均能形成纳米纤维,不同的是形成的纳米纤维的形貌不一样,包括长度、聚集程度、弯曲度等结构特征。在55℃条件下,形成的纳米纤维短而弯曲,为蛋白颗粒形成纳米纤维的最低温度,蛋白颗粒直接能从热处理中获得相互聚集的最低能量,最长纤维长度为0.3μm,平均纤维长度0.15μm;在65℃条件下,形成的纳米纤维较55℃条件下的纳米纤维更长,也较弯曲,纤维上分叉多,最长纤维长度为0.6μm,平均纤维长度0.3μm;当温度达到75℃,燕麦球蛋白颗粒形成特征明显的纤维,最长纤维长度达到6μm,平均纤维长度2μm,纤维分叉较少;温度达到85℃,燕麦球蛋白颗粒特征明显的纤维,纤维长度较75℃进一步增长,最长纤维长度达到 9μm,平均纤维长度5μm,纤维分叉较少;温度达到95℃,纤维长度增加不显著。
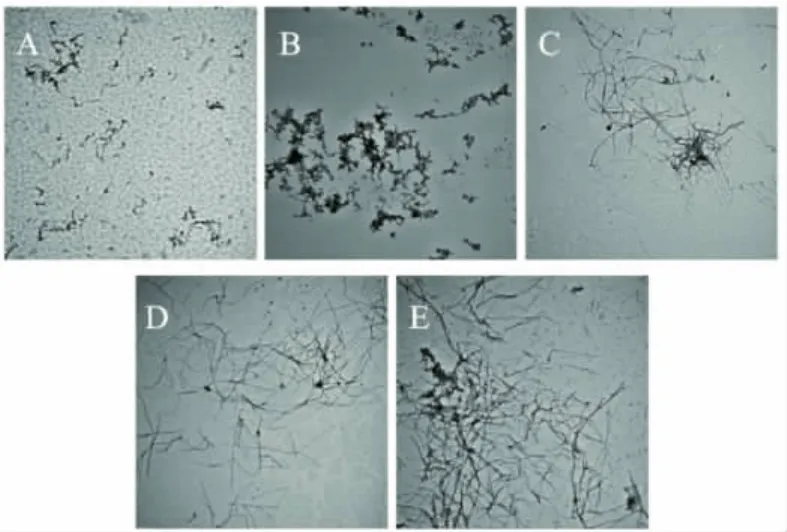
图1 5mg/mL燕麦球蛋白在pH 2.0条件下分别经过不同温度处理24h后得到的负染透射电镜图(50000×)
2.2 pH对燕麦球蛋白纳米纤维的影响
图2为燕麦球蛋白溶液在蛋白浓度为5mg/mL,温度85℃,搅拌速度400rad/s,pH分别在1.0、3.0、4.0、7.0、9.0条件下热处理24h形成纳米纤维的电镜图,结果表明,燕麦球蛋白在pH1.0~3.0之间能形成纳米纤维,pH超过3.0会形成球状聚集;在pH1.0条件下,形成的纳米纤维分叉较多,如树枝状,纤维的最长伸直长度为3μm,平均伸直长度为0.8μm左右;在pH3.0条件下,形成的纳米纤维与pH2.0条件下一样,分支较少,纤维结构清晰,纤维的最长伸直长度为4μm,平均伸直长度为1.5μm左右;在pH4.0条件下,不能形成纳米纤维,蛋白颗粒的聚集体较小,颗粒粒径在30nm左右;在pH7.0条件下,存在较大的聚集体,颗粒聚集平均粒径在80nm左右;在pH9.0条件下,蛋白溶液形成浑浊凝聚,在透射电镜图上观察到很大的聚集体,聚集体平均粒径在300nm左右。
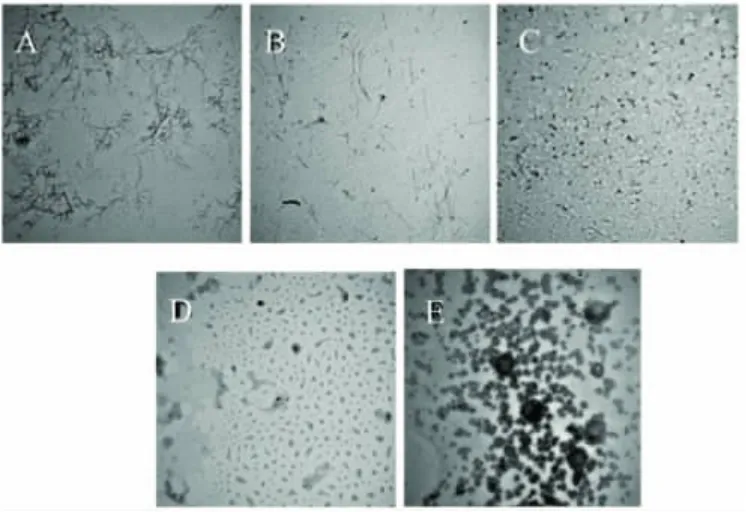
图2 5mg/mL燕麦球蛋白在85℃条件下分别在不同pH条件下处理24h后得到的负染透射电镜图(50000×)
2.3 搅拌速度对燕麦球蛋白纳米纤维的影响
图3(A)为燕麦球蛋白溶液在蛋白浓度为5mg/mL,温度85℃,pH2.0,搅拌速度0rad/s条件下热处理24h形成纳米纤维的透射电镜图,由图3(A)可知:燕麦球蛋白不搅拌也能在热处理条件下形成纳米纤维,24h后,纤维最长伸直长度超过5μm。
图3(B)为燕麦球蛋白溶液在蛋白浓度为5mg/mL,温度85℃,pH2.0,搅拌速度200rad/s条件下热处理24h形成纳米纤维的透射电镜图,结果表明,燕麦球蛋白在低速搅拌作用下能形成结构有序的纳米纤维,24h后,纤维最长伸直长度超过7μm,相比于0rad/s,搅拌速度200rad/s条件下在相同时间下形成的纤维长度更长。
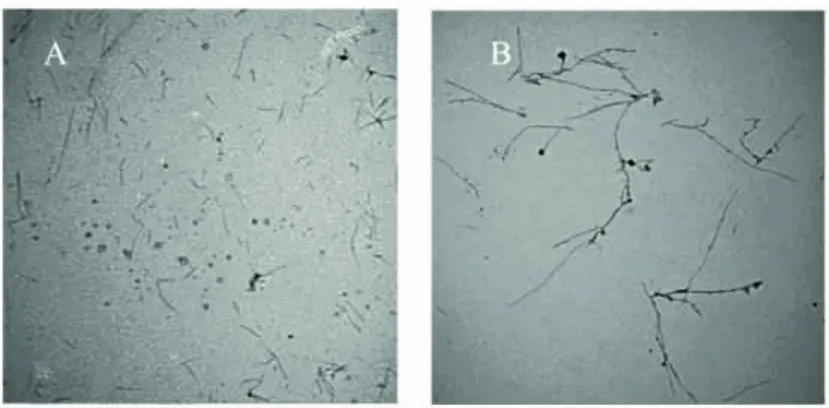
图3 5mg/mL燕麦球蛋白在pH2.0,85℃,搅拌速度分别在0、200rad/s条件下处理24h后得到的负染透射电镜图(50000×)
不同搅拌速率条件下燕麦球蛋白纳米纤维最长伸直长度随加热时间延长的变化关系如图4所示,由图4可知,在相同的加热时间处理条件下,搅拌速度为200rad/s时的纤维最长伸直长度大于0rad/s条件下纤维长度,由此可得,搅拌速度显著影响着纳米纤维的伸直长度;两个不同搅拌速度条件下的纳米纤维伸直长度随时间的变化趋势相同,都是0~5h内长度增加较快,5h后增加速度变缓。

图4 不同搅拌速率条件下燕麦球蛋白纤维最长伸直纤维长度随加热时间延长的变化图
2.4 形成燕麦球蛋白纳米纤维特性的表征
原子力图展示了燕麦分离蛋白纤维化聚集的细节形貌,反映了纤维聚集的高度、长度等形貌信息。通过原子力显微镜高度图可以看出所有的纳米纤维都呈螺旋上升的结构,为了更清楚的揭示其结构,采用AFM截面图分析方法进一步分析其内部颗粒之间的结构特征,燕麦球蛋白纤维内部结构图分别如图5所示,燕麦球蛋白的半宽高分布范围在33.1~52.1nm,螺距大小大约分布在53.9~79.9nm,燕麦球蛋白纳米纤维的高度是10.2~13.1nm。

图5 5mg/mL燕麦球蛋白在pH2.0,85℃条件下分别热处理24h得到的原子力扫描显微镜图的截面分析注:左图为原子力显微镜高度图,右图为选中区域的截面分析。
燕麦球蛋白的纤维双螺旋结构与 β-乳球蛋白[13],大豆11S球蛋白、大豆7S球蛋白相似[22],β-乳球蛋白的螺距为30~40nm,纤维高度为2~3nm,大豆11S球蛋白、大豆7S球蛋白的半宽高分别为20.5nm和25.8nm,大豆11S球蛋白和7S球蛋白1∶1混合物的纳米纤维的螺距为33.0nm显著大于7S球蛋白纳米纤维的螺距22.5nm,和大豆11S球蛋白纳米纤维螺距26.3nm较为接近。
原子力显微镜研究燕麦球蛋白纤维聚集的宽度结果比透射电镜所得的宽度要宽一些,主要是原子力显微镜针尖与样品之间产生静电斥力而产生的假象,属于仪器误差问题,Arnaudov L.N等使用原子力显微镜研究β-乳球蛋白的纳米纤维形成时,也发现了同样的现象[23]。
2.5 形成纤维特性的粘度的变化
图6为燕麦球蛋白的未加热的原溶液和加热24h处理后形成纳米纤维粘度变化曲线,研究结果表明,随着剪切速度从0.01~100.0s-1的增加,蛋白溶液粘度降低,这是溶液的剪切变稀现象,与未加热的蛋白质原液相比,加热后的样品粘度提高很多,由2.4的结果可知,随着加热时间的延长,球蛋白纳米纤维的长度逐渐增加,说明溶液中加热促使蛋白质结构展开和纳米纤维化聚集对其粘度有增强作用。Akkermans C等在研究中也证实了增加溶液中大豆蛋白纤维化聚集将会使溶液的粘度增大[8]。
蛋白纳米纤维具有独特的增稠性,可以应用到食品产品,如饮料和火腿食品等高糖分和高脂肪的产品中取代多糖类成分和脂肪成分起到增稠作用的同时,降低热量[10-13]。因此,对蛋白质纳米纤维方面的研究对人类健康和发展具有重大的意义。
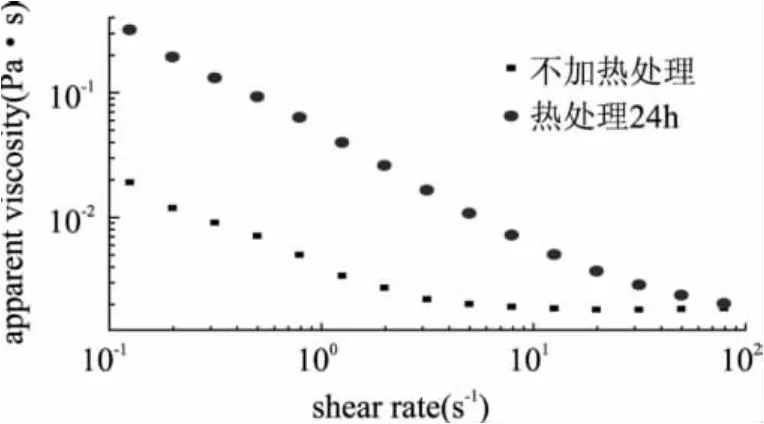
图6 5mg/mL球蛋白溶液加热24h纤维粘度变化图
3 结论
3.1 燕麦球蛋白能在一定的热处理条件下生成纳米纤维,原子力显微镜和透射电镜观察到燕麦球蛋白纳米纤维的长度分布呈多分散性,其平均长度随加热时间延长而变长,表明了燕麦球蛋白纳米纤维聚集在诱导条件下具有生长性。
3.2 温度对燕麦球蛋白在低pH条件下形成纳米纤维结构有较大的影响。在55℃条件下,形成的纳米纤维短而弯曲,为蛋白颗粒形成纳米纤维的最低温度,最长纤维长度为0.3μm,平均纤维长度0.15μm;随着温度从55℃升高到85℃,纤维最长伸直长度和平均长度越来越大,温度从85℃升高到95℃时,纤维长度增加不显著,但是纤维的形貌发生显著变化,组成纤维的颗粒会发生形变,纤维直径变宽,纤维与纤维之间发生交联聚集的程度增加。
3.3 pH对燕麦球蛋白形成纳米纤维结构有显著的影响。pH在1.0~3.0之间条件下,燕麦球蛋白热处理后能形成一定长度的、线性的纤维聚集,当pH超过4.0时形成球状聚集,颗粒粒径在30nm左右;随着pH增加,球状纤维的粒径增加,当在pH达到9.0条件时,蛋白溶液形成凝聚状,聚集体平均粒径在300nm左右。
3.4 搅拌速度对燕麦球蛋白形成纳米纤维结构也有一定的影响,在搅拌速度在0~200rad/s之间时,纤维最长伸直长度和平均伸直长度在任意相同时间段都随搅拌速度的增加而增加。
3.5 燕麦球蛋白的半宽高分布范围在33.1~52.1nm,螺距大小大约分布在53.9~79.9nm,燕麦球蛋白纳米纤维的高度是10.2~13.1nm;
3.6 燕麦球蛋白溶液在不同加热时间的处理下,加热溶液的粘度显著增加。
[1]Gosal W S,ClarkA H,Ross-Murphy S B.Fibrillar βlactoglobulingels:Part 1.Fibril formation and structure[J]. Biomacromolecules,2004(5):2408-2419.
[2]Akkermans C,Venema P,van der Goot A J,et al.Peptides are building blocks of heat-induced fibrillar protein aggregates of βlactoglobulin formed at pH 2[J].Biomacromolecules,2008(9): 1474-1479.
[3]Veerman C,de Schiffart G,Sagis L,et al.Irreversible selfassembly of ovalbumin into fibrils and the resulting network rheology[J].International Journal of Biological Macromolecules,2003,33:121-127.
[4]PearceF G,Mackintosh S H,Gerrard J A.Formation of amyloid -like fibrils by ovalbumin and related proteins under conditions relevant to food processing[J].Journal of Agricultural and Food Chemistry,2007,55:318-322.
[5]Azakami H,Mukai A,Kato A.Role of amyloid type cross β-structure in the formation of soluble aggregate andgel in heatinduced ovalbumin[J].JournalofAgriculturaland Food Chemistry,2005,53:1254-1257.
[6]Veerman C,Sagis L,Heck J,et al.Mesostructure of fibrillar bovine serum albumingels[J].International Journal of Biological Macromolecules,2003,31:139-146.
[7]Vernaglia B A,Huang J,Clark E D.Guanidine hydrochloride can induce amyloid fibril formation from hen egg-white lysozyme[J].Biomacromolecules,2004(5):1362-1370.
[8]Akkermans C,Van Der Goot A,Venema P,et al.Micrometersized fibrillar protein aggregates from soyglycinin and soy protein isolate[J].Journal of Agricultural and Food Chemistry,2007,55: 9877-9882.
[9]Zhang Y H,Tang C H,Wen Q B,et al.Thermal aggregation andgelation of kidney bean(Phaseolus vulgaris L.)protein isolate at pH 2.0:Influence of ionic strength[J].Food Hydrocolloids,2010,24:266-274.
[10]Mounsey J S,O'Kennedy BT,Fenelon MA,et al.The effect of heating on[beta]-lactoglobulin-chitosan mixtures as influenced by pH and ionic strength[J].Food Hydrocolloids,2008,22: 65-73.
[11]Weiss J,Takhistov P,McClements DJ.Functional materials in food nanotechnology[J].Journal of food science,2006,71:R107 -R116.
[12]Oboroceanu D,Wang L,Brodkorb A,et al.Characterization of β-lactoglobulin fibrillar assembly using atomic force microscopy,polyacrylamidegel electrophoresis,and in situ fourier transform infrared spectroscopy[J].Journal of Agricultural and Food Chemistry,2010,58:3667-3673.
[13]Hischke H H,Jr,Potter GC,et al.Nutritive value of oat proteins I Varietal differences as measured by amino acid analysis and ratgrowth responses[J].Cereal Chem,1968,45:374-378.
[14]Millerd A.Biochemistry of legume seed proteins[J].Annu Rev Plant Physiol,1975,26:53-72.
[15]Derbyshire E,Wright D J,Boulter D,et al.Storage proteins of legume seeds[J].Phytochemistry,1976,15:3-24.
[16]Neilsen,N C.Thestructureand complexityof 11S polypeptides in soybeans[J].Am Oil Chem Soc,1985,62:680 -1686.
[17]Brinegar A C,Peterson D M.Separation and characterization of oatglobulin polypeptides[J].Arch Biochem Biophys,1982,219: 71-79.
[18]Matlashewski G J,Adeli K,Altosaar I,et al.In vitro synthesis of oatglobulin[J].FEBS Lett,1982,145:208-212.
[19]German B,Damodaran S,Kinsella JE.Thermal dissociation and association behaviour of soy proteins[J].J Agric Food Chem,1982,30:807-812.
[20]Osborne TB.The vegetable proteins[M].Green:New York.In Monographs in Biochemistry,1924.
[21]Tang CH.Functional properties and in vitro digestibility of buckwheat protein products:Influence of processing[J].Journal of Food Engineering,2007,82:568-576.
[22]Tang C H,Wang C S.Formation and Characterization of Amyloid-like Fibrils from Soy β-Conglycinin and Glycinin[J]. Journal of Agricultural and Food Chemistry,2010:158-165.
[23]Alvar GJ,Malika R,Marianela CM,et al.Effect of dynamic high pressure on whey protein aggregation:A comparison with the effect of continuous short-time thermal treatments[J].Food Hydrocolloids,2008,22:1014-1032.
Study on the factors effect of the formation of nanofibrils from oat globulin
LIU Gang1,HUANG Qing-rong2,SHI Tong-fei3,FAN Xiao-dan1,YANG Ri-fu1,QIU Tai-qiu1,*
(1.College of Light Indrustry and Food Science,South China University of Technology,Guangzhou 510640,China; 2.Department of Food Science,Rutgers University,New Jersey 08901,USA;3.State Key Laboratory of Polymer Physics and Chemistry,Changchun Institute of Applied Chemistry,Chinese Academy of Sciences,Changchun 130022,China)
The effecting factors on the formation of the oat globulin nanofibrils were investigated by transmission electron microscopy(TEM),atomic force microscopy(AFM),including temperature,pH,heating time and shear rates,using oat globulin as materials.The characteristics of the nanofibrils were further studied.The result showed that the optimum conditions was temperature 85℃,pH 2.0,stirring speed 400rad/s,after heating 2~24h under the conditions,the oat globulin particles could form into nanofibrils with half-width height 33.1~52.1nm,screwpitch about 53.9~79.9nm,height of nanofibrils 10.2~13.1nm and stretched length 0~9.0μm,the apparent viscosity of the solution increased remarkable.The investigation of nanofibrils formation not only gave a light to the exploitation and utilization of the food protein,but also had laid the foundation for development of the functional food.
oat globulin;nanofibrils;screwpitch;stretched length
TS201.2
A
1002-0306(2011)09-0160-05
多种蛋白质能在温和的变性条件下形成纳米纤维,例如:β-乳球蛋白[1-2]、卵清蛋白[3-5]、牛血清蛋白[6]、溶解酵素[7]、大豆蛋白[8]、芸豆蛋白[9]等。由于蛋白纳米纤维具有独特的乳化特性、凝胶特性、增稠性、起泡性和持水性,其可以作为功能成分应用到食品产品中,如饮料和火腿食品等高糖分和高脂肪的产品中取代多糖类成分和脂肪成分起到增稠作用的同时,降低热量[10-12]。其中,影响蛋白质纤维聚集形成的因素包括:加热温度、pH、加热时间、蛋白质的浓度和加热时搅拌的速度、离子强度等[1-9]。目前国内外对各个因素对蛋白纳米纤维的影响还没有较系统的研究,特别是在国内,未见食品蛋白纳米纤维方面的报道。燕麦蛋白具有良好的营养特性[13]和功能特性[14],是一种很有潜力的食品成分。燕麦球蛋白是燕麦蛋白的主要成分,它是一种寡聚蛋白,由六个亚基通过非共价键连接组成[15-17],每个亚基由分子量分别在22000~24000和32000~37000之间的酸性和碱性多肽通过二硫键相连组成[18-19];本文以燕麦球蛋白为原料,采用透射电镜和原子力扫描电镜探讨了不同因素条件(重点研究了加热温度、pH、加热时间、加热时搅拌的速度)对燕麦球蛋白纳米纤维的影响,并对纳米纤维的微结构进行了研究。
2011-04-11 *通讯联系人
刘刚(1982-),男,在读博士生,研究方向:蛋白功能特性及自组装。
“十一五”国家科技支撑计划(2006BAD27B03)。
