多壁碳纳米管修饰电极测定烟酰胺
2011-10-28许雷标
徐 慧,许雷标
(鲁东大学化学与材料科学学院,山东 烟台 264025)
多壁碳纳米管修饰电极测定烟酰胺
徐 慧,许雷标
(鲁东大学化学与材料科学学院,山东 烟台 264025)
研究多壁碳纳米管修饰电极的制备及其对烟酰胺的电催化检测。考察支持电解质种类、酸度和扫速等因素对烟酰胺响应的影响。在优化实验条件下,采用示差脉冲伏安法测定烟酰胺,其浓度在5.0×10-5~1.0×10-3mol/L范围内与其还原峰电流呈良好的线性关系,检出限为2.49×10-5mol/L。共存的多种离子、蔗糖、乙醇等不干扰测定。
多壁碳纳米管修饰电极;烟酰胺;电化学
烟酰胺(nicotinamide,NA),学名为吡啶-3-甲酰胺,又称尼克酰胺,维生素PP等,是白色结晶粉末,无臭或接近无臭,有苦味[1-2],广泛地应用于医药业、食品业、饲料业、农业和工业方面,与人类的健康直接相关。NA是B族维生素成员之一,它在人体内以NA腺嘌呤二核苷酸(NAD)和其磷酸盐(NADP)活性物质的形式存在,具有促进细胞新陈代谢机能及扩张血管的作用。其制剂广泛用于防治癞皮病和类似的维生素缺乏症以及末梢血管痉挛、动脉硬化等症状。目前对于NA的检测方法有色谱法[3-5]、荧光法[6]、分光光度法[7]、电化学法[8-9]、及微生物法[10]等方法。
碳钠米管(carbon nanotube,CNT),又名巴基管(buckytubes),是1991年由日本科学家饭岛[11]用高分辨透射电镜(high resolution transmission electron microscopy,HRTEM)发现的一种管状碳单质,分为单壁碳管(single-walled carbon nanotubes,SWNT)和多壁碳管(multi-walled carbon nanotubes,MWNT)两类。它因特有的力学、电学和化学性质,独有的准一维管状分子结构在未来高科技领域存在潜在的应用价值,迅速成为化学、物理学及材料科学等领域的研究热点。Davis[12]、Barisci[13]等研究表明碳纳米管用作电极材料可以加速物质的电子交换,其在电催化和电分析化学上具有广阔的应用前景。
本实验采用多壁碳纳米管修饰电极对NA的电催化检测。经过MWNT修饰的活化后的玻碳电极对NA的响应好,且具有较好的回收率和选择性。该方法简便、快速、灵敏,测量精确度和准确度也能满足实际需要。
1 材料与方法
1.1 材料、试剂与仪器
多壁碳纳米管(按文献[14]方法提纯) 深圳纳米技术进出口有限公司。其他所用试剂均为分析纯,水为三次蒸馏水。
CHI 660C电化学工作站 上海辰华仪器公司。三电极系统:玻碳电极(GC)或多壁碳纳米管修饰玻碳电极为工作电极,Ag-AgCl为参比电极,铂丝为对电极。
1.2 方法
1.2.1 玻碳电极活化
将玻碳电极通过0.3、0.05μm Al2O3粉末物理打磨抛光,并依次用乙醇、三次蒸馏水超声清洗,然后用水冲洗干净。将玻碳电极放入0.5mol/L H2SO4溶液中,于-1.0~2.0V(vs. Ag/AgCl)范围进行循环伏安扫描至循环伏安图稳定为止(40圈),以增加电极表面点的浓度。
1.2.2 多壁碳纳米管修饰玻碳电极的制备
称取提纯的MWNT(经羧基功能化)2mg,加入2mL N,N-二甲基甲酰胺(DMF),经超声波振荡后(超声波功率100W),多壁碳纳米管分散于DMF中,形成1mg/mL黑色混合液。将6μL多壁碳纳米管混合液分别滴加到活化和不活化的玻碳电极表面,在红外箱中烘干,即可得到多壁碳纳米管修饰玻碳电极。
1.2.3 NA的测定
在10mL小烧杯中加入5mL 0.1mol/L磷酸盐(Na2HPO4-NaH2PO4)缓冲液(pH6.80),50μL 0.1mol/L NA溶液,通15min的氮气,除去溶液中的氧气。将三电极插入其中,在-1.7~-0.8V电位之间,以0.1V/s扫速进行示差脉冲伏安法(DPV)扫描,并记录DPV扫描曲线。除非特别说明,所有电化学实验均在0.10mol/L、pH 6.80的磷酸盐缓冲液、电位范围-1.7~-0.8V、扫速0.1V/s、溶液通氮气15min和室温条件下进行。
2 结果与分析
2.1 修饰电极的选择
到目前为止,NA的电化学行为已有报道。Marin Galvin等[8]用直流极谱法和循环伏安法研究NA在强酸介质中和缓冲溶液中(2<pH<12)[9]的电化学行为,邹洪等[15]用单扫描极谱法对烟酰胺进行研究,讨论烟酰胺的电极反应机理。但这些方法存在灵敏度不够、汞对人体的毒性等问题,因此实验选择的电化学反应介质为0.1mol/L的Na2HPO4-NaH2PO4缓冲溶液(pH6.80),电化学方法为示差脉冲伏安法。
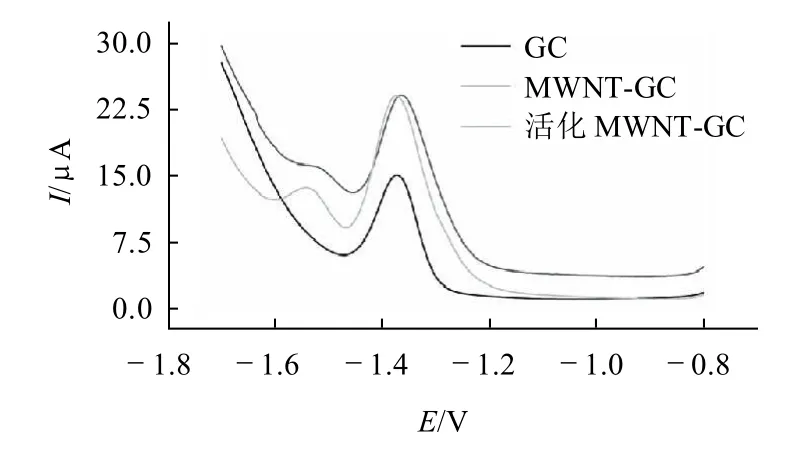
图1 NA (1.0×10-3mol/L) 在不同电极上的DPV图Fig.1 DPV voltammogram of NA (1.0×10-3 mol/L) on different electrodes
图1为在pH6.80的磷酸盐缓冲液中,当扫描速率为0.1V/s时,烟酰胺在GC电极、MWNT-GC电极和活化后MWNT-GC电极上的DPV扫描图。从图1可看出,这3种不同的工作电极在磷酸盐缓冲液中都有响应,在约-1.37V左右都有一还原峰,但在同一浓度中响应的程度各有不同。通过比较可以发现,经过MCNT修饰的玻碳电极明显比裸玻碳电极的峰电流高,这是因为修饰了多壁碳纳米管后增大了电极的表面积,加快了电子传递速率[12-13]。但其背景电流也增大。玻碳电极在0.5mol/L的H2SO4溶液中活化后再经MWNT修饰的电极比未经过活化的MWNT修饰的玻碳电极的背景电流低。综合比较后,发现活化后并经MWNT修饰的玻碳电极对烟酰胺的响应最好,所以实验采用这种修饰电极作为工作电极。
2.2 扫描速率的影响
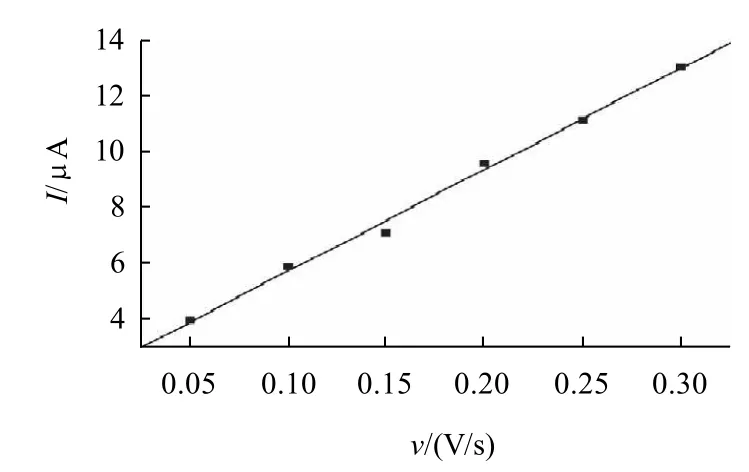
图2 扫描速率和峰电流的线性关系(CNA=1.0×10-3mol/L)Fig.2 Linear relationship between peak current and scanning rate(CAN =1.0×10-3 mol/L)
用循环伏安法以不同的扫描速率扫描1.0×10-3mol/L烟酰胺溶液,在经活化后的MWNT修饰玻碳电极上,随着扫描速率的增大,峰电流逐渐增大。从图2可以看出,还原峰电流与扫描速率在0.05~0.30V/s之间呈良好线性关系,这表明电极过程主要受吸附控制。
2.3 底液的选择
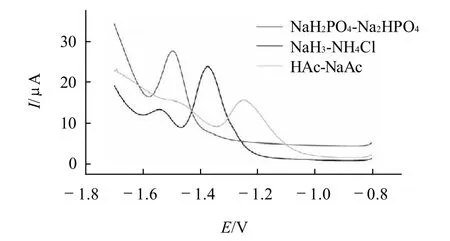
图3 烟酰胺在不同底液中的DPV扫描图(CNA=1.0×10-3 mol/L)Fig.3 DPV voltammogram of NA in different buffer solution(CNA=1.0×10-3 mol/L)
利用示差脉冲伏安法(DPV)考察烟酰胺在不同底液(pH4.0 0.1mol/L HAc-NaAc、pH6.8 0.1mol/L NaH2PO4-Na2HPO4、pH9.2 0.1mol/L NH3-NH4Cl缓冲溶液)中的电化学行为。底液pH值对还原峰电流的影响见图3。实验结果表明,烟酰胺的还原峰电位随着溶液pH值的增大逐渐正移,说明有质子参与烟酰胺在电极上的还原反应。从图3可以看出,在pH6.8的磷酸盐缓冲液中,烟酰胺的还原峰电位为-1.388V,且峰电流最高。因此选择0.1mol/L pH6.8的磷酸盐缓冲液作为底液。
2.4 线性范围和检出限
在优化的实验条件下,记录NA溶液的DPV曲线。结果表明:NA的还原峰电流Ip与NA浓度在5.0×10-5~1.0×10-3mol/L范围内呈良好的线性关系,其线性方程为:Ip/(10-6A)=1.845+0.1141c/(10-5mol/L);相关系数为0.997;检出限为2.49×10-5mol/L。
2.5 干扰实验
考察常见物质对NA测定的影响。结果表明:对于1.0×10-3mol/L NA溶液,500倍的K+、Cl-、NH4+、SO42-、Mg2+;100倍的蔗糖,乙醇;53.8倍的L-色氨酸均不干扰测定,说明MWNT修饰电极测定NA有很好的选择性。
2.6 回收率实验
在一定浓度的烟酰胺溶液中,依次加入4.0μL 0.1mol/L NA标准溶液,测定结果如表1所示。回收率在96.52%~110.00%之间。
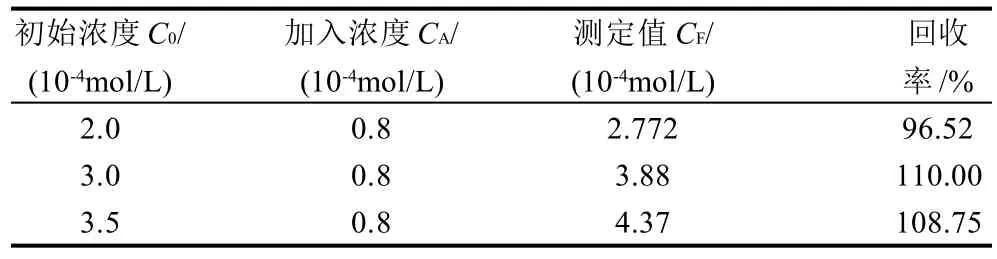
表1 回收率测定结果Table 1 Recovery of spiked samples
3 结 论
3.1 玻碳电极在0.5mol/L H2SO4溶液中活化并用MWNT修饰后对NA的电化学还原反应有明显的催化作用,其还原过程是受吸附过程控制。
3.2 NA的还原峰电流Ip与烟酰胺浓度在5.0×10-5~1.0×10-3mol/L范围内呈良好线性关系,检出限为2.49×10-5mol/L。一些常见的物质对测定无干扰。该方法具有较好的回收率和选择性。该方法简便、快速、灵敏,测量精确度和准确度也能满足需要。
[1] 凌关庭, 王亦芸, 唐述潮. 食品添加剂手册[M]. 北京: 化学工业出版社, 1989.
[2] 谭佩幸, 陶宗晋, 祁国荣, 等. 现代化学试剂手册: 第三分册[M]. 北京: 化学工业出版社, 1991: 51-52.
[3] STEIN J, HAHN A, REHNER G. High-performance liquid chromatographic determination of bathmochrome absorption shifts[J]. Journal of Chromatography B: Biomedical Sciences and Applications, 1995, 665(1): 71-78.
[4] 扬金宝, 鄂来明. 反相高效液相色谱法测定奶粉中烟酸和烟酰胺的研究[J]. 营养学报, 1996, 18(1): 114-119.
[5] KHAN A R, KHAN K M, PERVEEN S, et al. Determination of nicotinamide and 4-aminobenzoic acid in pharmaceutical preparation by LC[J]. Journal of Pharmaceutical and Biomedical analysis, 2002, 29(4):723-727.
[6] 唐学燕, 陶冠军, 秦昉. 二阶导数-同步荧光法同时测定微量维生素B1、B2和烟酰胺[J]. 分析试验室, 2009, 28(10): 92-94.
[7] 上官小东, 王党社. 高铁盐配位-分光光度法测定烟酰胺的含量[J].纺织高校基础科学学报, 2004, 17(4): 356-358.
[8] MARIN GLAVIN R, RODRIGUEZ MELLADO J M. On the electrochemical reduction of nicotinamide in an acid medium[J]. Journal of Electroanalytical Chemistry, 1989, 260(1): 101-111.
[9] MARIN GLAVIN R, RODRIGUEZ MELLADO J M. Study of the electrochemical behavior of nicotinamide in buffered solutions[J]. Journal of Electroanalytical Chemistry, 1990, 283(1/2): 337-348.
[10] 聂洪勇, 黄伟坤. 维生素及其分析方法[M]. 上海: 上海科学技术出版社, 1987: 210-240.
[11] IIJIMA S. Helical microtubules of graphitic carbon[J]. Nature, 1991,354: 56-58.
[12] DAVIS J J, COLES R J, ALLEN H, et al. Protein electrochemistry at carbon nanotube electrodes[J]. Journal of Electroanalytical Chemistry,1997, 440(1/2): 279-282.
[13] BARISCI J N, WALLACE G G, BAUGHMAN R H. Electrochemical studies of single-wall carbon nanotubes in aqueous solutions[J]. Journal of Electroanalytical Chemistry, 2000, 488(2): 92-98.
[14] TSANG S C, CHENhen Y K, HARRIS P J F, et al. A simple chemical method of opening and fillin carbon nanotubes[J]. Nature, 1994, 6502:159-162.
[15] 邹洪, 袁倬斌. 烟酰胺极谱行为的研究[J]. 分析试验室, 1997, 16(1):10-13.
Determination of Nicotinamide on Glassy Carbon Electrode Modified with Multiwall Carbon Nanotubes
XU Hui,XU Lei-biao
(School of Chemistry and Materials Science, Ludong University, Yantai 264025, China)
A multi-walled carbon nanotubes modified electrode was fabricated and its electro-catalytic activity for nicotinamide was investigated. The effects of electrolyte type and acidity, scanning rate on the voltammetric behavior of nicotinamide were studied to acquire optimal conditions for detecting nicotinamide. In 0.1 mol/L phosphate buffer (pH 6.8), the differential pulse voltammetric determination displayed excellent linearity between reduction current and nicotinamide concentration in the range of 5.0×10-5to 1.1×10-3mol/L with a detection limit of 2.49×10-5mol/L. Several ions, sugar and ethanol did not interfere with the determination.
glassy carbon electrode modified with multiwall carbon nanotube;nicotinamide;electrochemical
Q563.9
A
1002-6630(2011)10-0160-03
2010-08-26
山东省中青年科学家科研奖励基金项目(BS2009SW040);鲁东大学创新团队建设项目(08-CXB001)
徐慧(1976—),女,副教授,博士,研究方向为食品和生物分析。E-mail:xuhui@ldu.edu.cn
