荞麦过敏原特异性抗体酶联免疫吸附法检测试剂制备
2011-10-27崔晓东王转花
张 昕,崔晓东,王转花
(1.山西大学环境科学与工程研究中心,山西 太原 030006;2.山西大学生物技术研究所,山西 太原 030006)
荞麦过敏原特异性抗体酶联免疫吸附法检测试剂制备
张 昕1,崔晓东2,王转花2
(1.山西大学环境科学与工程研究中心,山西 太原 030006;2.山西大学生物技术研究所,山西 太原 030006)
以天然苦荞过敏蛋白包被聚苯乙烯微孔板,以鼠抗人IgE抗体标记辣根过氧化物酶,以间接酶联免疫吸附法(indirect enzyme-linked immunosorbent assay,IELISA)检测病人血清中的特异性抗体,分析并建立关键操作步骤及反应条件。结果表明:ELISA反应的最适工作条件为包被的抗原质量浓度100μg/mL、阳性血清稀释度1:50、酶标二抗稀释度1:1000,37℃时封闭的最佳时间为40min,包被抗原与阳性血清中抗体的最佳作用时间为40min,阳性血清与酶标二抗的最佳作用时间为40min。本方法具有良好的特异性、重复性和精密度。
苦荞;过敏蛋白;试剂盒;间接酶联免疫吸附法
食物过敏同保健食品和食品安全等,已成为食品卫生研究中的重要问题。全球范围内,大约有4%~6%的儿童和2%的成年人有食物过敏症[1]。患者一旦发生食物过敏,症状通常十分严重。目前,我国对于食品过敏研究还没有引起足够的重视,与国外发达国家相比有较大的差距,这对于我国全民的身体健康构成了很大的威胁。过敏原无处不在,因此患者清楚自己对何种食品过敏,及早避开这些过敏原就显得至关重要。
近年来,富含生物类黄酮及多种生物活性成分的荞麦、燕麦等产品不断问世,而食用这些食品引起的不同程度过敏症也成为了生物学和医药学领域普遍关注的热点问题。荞麦由于其独特的营养以及药用价值,在世界各地已经成为一种普遍栽培的作物[2]。近年来关于荞麦过敏的报道日益增多,许多人在食用或接触荞麦后会产生休克、哮喘和皮疹等过敏症状[3-7]。目前,有关荞麦过敏的诊断在国外已有临床检测的产品,但它的检测范围较窄,对于一些荞麦过敏的病例易造成漏检。间接性ELISA(indirect enzyme linked immunosorbent assay,IELISA)诊断技术具有特异、敏感、快速、经济、可自动化等特点,是过敏症早期快速诊断和免疫抗体监测的有效实用技术[8-10]。
对荞麦食品过敏的患者首先应进行过敏原检测,只有明确过敏原后,才能进行下一步针对性的预防和治疗。本实验从前期得到的苦荞种子中,分离纯化得到一种分子质量为24kD的蛋白质,同时采用基因克隆、定点突变及免疫学等技术确认其为苦荞麦食品中的主要过敏原[11-12]。在此基础上,本研究将通过分离、纯化获得苦荞过敏蛋白纯品,并对ELISA反应体系进行优化,制备一种成本低、特异性高的荞麦过敏蛋白ELISA抗体检测试剂,为食物过敏症患者过敏原的检测、确诊提供方法和试剂。
1 材料与方法
1.1 材料、试剂与仪器
血清来自于荞麦过敏患者(临床表现为哮喘、变异性鼻炎、皮疹等症状),特异性IgE浓度均大于0.35IU/mL;辣根过氧化物酶鼠抗人IgE 美国Southernbiotech公司。
抗原包被液(5 0mmol/L碳酸盐缓冲液、2.93 g NaHCO3、1.59g Na2CO3、1L ddH2O,pH9.6),抗体稀释液(8g NaCl、2.9g Na2HPO4·12H2O、0.2g KH2PO4、0.5mL 吐温-20、0.01mmol/L PBST、1L ddH2O,pH7.4),底物-邻苯二胺溶液(SIGMA FASTTM OPD Tablet Set,Sigma)临用前配制:0.1mol/L柠檬酸、0.2mol/L Na2HPO4·12H2O、12.5mL蒸馏水,10mg邻苯二胺,临用前加质量分数30%的H2O2溶液。
酶标测定仪 美国Bio-RAD公司;CAP系统 瑞典Pharmacia公司。
1.2 方法
1.2.1 抗原样品的制备
按照已报道的苦荞过敏蛋白的制备方法[13],将脱脂荞麦粉经缓冲液抽提、盐析、透析、离子交换和凝胶过滤层析,得到电泳纯的24kD抗原,将抗原真空冻干,备用。
1.2.2 ELISA最佳反应条件选择
1.2.2.1 阳性血清最佳稀释度与抗原包被浓度的确定
采用方阵滴定法,用包被缓冲液将制备的抗原分别按5、10、20、30、40、50、100、200μg/mL 稀释后包被ELISA板,抗原在使用前加入吐温-20,使其终体积分数达到1%。4℃过夜包被,倒尽液体,用洗涤液(PBST)洗3次。用质量分数1%的明胶于37℃水浴封闭1h。用洗涤液洗3次,每排1~8孔分别加入按照1:20、1:40、…、1:2560倍稀释的阳性血清,再加入酶标二抗(辣根过氧化物酶标记的鼠抗人IgE),洗3次,最后加入邻苯二胺显色底物,37℃温育15min,加入1mol/L H2SO4溶液终止反应,在酶标仪上测定OD490处的光密度。
1.2.2.2 酶标二抗最佳工作浓度的确定
用1.2.2.1节确定的最佳抗原包被浓度包被酶标板,阳性血清也使用1.2.2.1节确定的最佳稀释度。酶标二抗稀释度分别为1:100、1:200、1:400、1:800、1:1600、1:3200、1:6400和1:12800,具体操作同1.2.2.1节。
1.2.2.3 封闭液最佳作用时间的确定
使用1.2.2.1节确定的抗原包被浓度和阳性血清稀释度,使用1.2.2.2节确定的酶标二抗稀释浓度。用质量分数1%的明胶封闭酶标板,分别封闭20、30、40、50、60、70、80、90min,具体操作同1.2.2.1节。
1.2.2.4 抗原抗体最佳作用时间的确定
使用1.2.2.1节确定的抗原包被浓度和阳性血清稀释度,分别作用 20、30、40、50、60、70、80、90min,使用1.2.2.3节确定的封闭液最佳作用时间,将酶标二抗按步骤1.2.2.2节选择的浓度稀释后加入酶标板。具体操作同1.2.2.1节。
1.2.2.5 阳性血清与酶标二抗最佳作用时间的确定
阳性血清与酶标二抗分别作用20、30、40、50、60、70、80、90min,其余步骤使用以上确定的条件进行,具体操作同1.2.2.1节。
1.2.3 ELISA阴、阳性血清标准临界值的确定
取一定数量的阴性血清样本,使用已建立的ELISA方法,并参考市售其他食品过敏原检测试剂盒使用说明,确定标准临界值。大约95%的阴性血清OD值与平均值0.05相近,以阴性参考血清的2倍作为阳性判定值。确定P/N<2.1为阴性、P/N≥2.1为阳性(P为阳性OD值、N为阴性OD值)。依照上述步骤确定的条件,本实验取阴性血清和阳性血清8份进行ELISA鉴定,测量OD490值,以绝对值法判定结果。
1.2.4 ELISA质量鉴定
将阳性对照血清按照1:50、1:100、…、1:6400倍稀释,选用质量浓度为100μg/mL的苦荞蛋白进行吸收,然后进行ELISA特异性检测。同时测定选用质量浓度为100μg/mL的BSA溶液吸收阻断的阳性对照血清的OD490值与未加抗原的阳性对照血清的OD490值。
另外取2例阴性血清(N1、N2)和3例阳性血清(P1、P2、P3)在同一条件和时间下进行ELISA重复性实验。实验共重复测定8次,取8次测定值,计算其平均值、变异系数以及相关统计学指标。
2 结果与分析
2.1 苦荞过敏蛋白的纯度分析
将苦荞蛋白的粗提物先后通Sephadex G-100和DEAE-Sepharose CL 6B柱层析分离,十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresi,SDS-PAGE)检测其纯度。图1显示,纯化的24kD目的蛋白(上样量为5μg)为单一条带,纯度达到9 5%以上,可满足后续研究。

图1 目的蛋白的SDS-PAGE 分析Fig.1 SDS-PAGE analysis of purified protein from tartary buckwheat
2.2 ELISA最佳反应条件的确定
2.2.1 阳性血清最佳稀释度与最佳抗原包被浓度的确定
采用方阵滴定测定了阳性血清最佳稀释度和最佳抗原包被浓度,结果显示当抗血清的稀释浓度为1:40和1:80时,各稀释度的抗原OD值均较高(表1)。为了取样方便,选定1:50作为最佳的稀释度。当包被抗原质量浓度为100μg/mL时,各稀释度的抗体即阳性血清的OD值最大,而当包被质量浓度为200μg/mL的时候,OD值较小,原因可能是,质量浓度太高时,空间因素影响了抗原抗体的结合。最后确定100μg/mL、1:50为抗原包被与抗血清稀释的工作浓度。
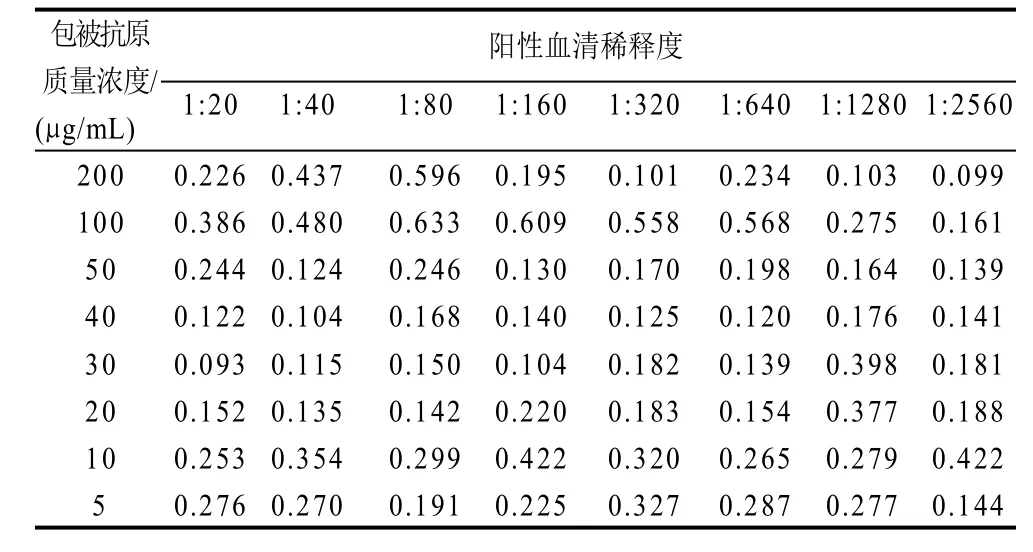
表 1 包被抗原和抗血清浓度的方阵滴定Table 1 Titration matrix of coating antigen and positive antiserum dilution
2.2.2 酶标二抗最佳稀释度的确定
在确定最佳血清稀释度和最佳包被条件的情况下,进一步确定酶标二抗的稀释度。从图2可以看出,当稀释倍数处于1:100~1:400之间时,因为酶标二抗过量,容易造成非特异性吸附,因此OD值较高;当倍数大于1:1600时,由于抗体量不足,造成光密度值较小。因此比较适宜的稀释倍数为1:400~1:1600,本研究选定1:1000为最佳稀释度。2.2.3 封闭液最佳作用时间的确定

图2 酶标二抗最适浓度的确定Fig.2 Determination of optimal working concentration of HRP-labeled mouse anti-human IgE
在ELISA反应中,封闭液的封闭效果和均一性对于实验的结果至关重要。因此本研究选用纯度较好的明胶作为封闭液,以减少实验的误差。在封闭液确定的条件下对封闭的时间进行研究。发现在40~60min之间时,OD值比较稳定(图3),最终确定40min为最佳封闭时间。
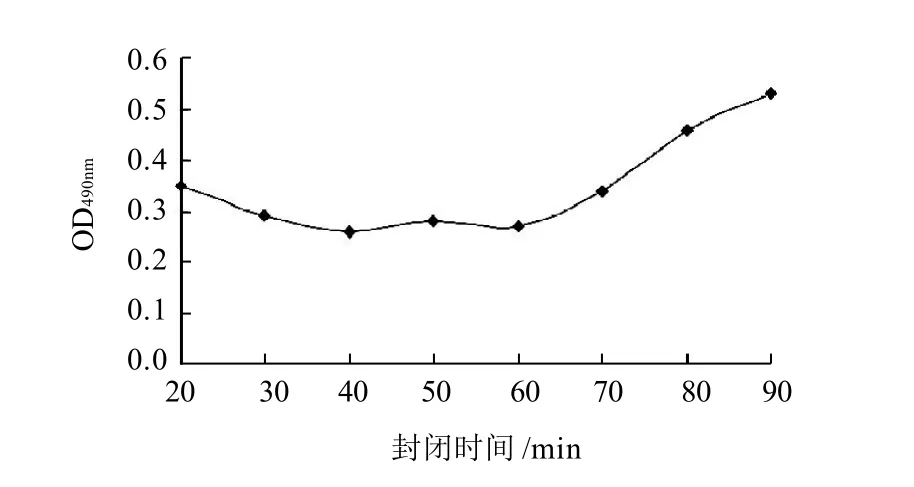
图3 封闭液最佳作用时间的确定Fig.3 Determination of optimal blocking time
2.2.4 抗原抗体最佳作用时间的确定
包被抗原和血清中抗体的结合强度和特异性程度是ELISA实验结果是否稳定的因素之一。通过对抗原抗体的最佳作用时间进行探讨,发现在30~60min范围内,OD值处于一个相对稳定的水平(图4),而作用时间大于60min后,OD值明显偏大,最终选定最佳作用时间为40min。

图4 抗原抗体最佳作用时间的确定Fig.4 Determination of optimal incubation time of antigen and antibody for conjugation
2.2.5 阳性血清与酶标二抗最佳作用时间的确定
阳性血清与酶标二抗的作用时间研究结果如图5显示,在两者作用40~60min之间,OD值比较稳定,因此选定40min为最佳作用时间。

图5 酶标二抗与阳性血清最佳工作时间的确定Fig.5 Determination of optimal working time of HRP-labeled mouse anti-human IgE and patients’positive sera
2.3 阳性血清标准临界值的确定
因为每次实验条件(包括试剂配制)会存在差异,一般采用标本(P)与阴性对照(N)比值(P/N)的方法确定实验结果属于阳性还是阴性。在得出标本和阴性对照的OD值后,计算P/N值。P/N<2.1为阴性、P/N≥2.1为阳性,因此,标准临界值=2.1×阴性对照OD值。本实验将缓冲液作为阴性对照。为避免假阳性的出现,对N值作一些特殊规定,即如果实验中N值小于0.05,则按0.05计算。经测量后,8份阳性血清OD值均大于0.15,P/N≥2.1,符合测定需要。
2.4 ELISA质量判定
2.4.1 ELISA特异性实验
阻断实验显示用苦荞抗原吸收不同稀释度的阳性对照血清后,阳性血清的OD490值明显降低。而用BSA吸收阻断的阳性对照血清后所测的OD490值,与未加抗原的阳性对照血清的OD490值没有差异。说明本方法具有良好的特异性。
2.4.2 ELISA重复性实验
选取2例阴性血清和3例阳性血清在同一时间(t1)和条件下重复测定8次,结果显示其OD490值变化不显著,阳性样本P1、P2、P3变异系数均小于5%,说明本方案的精密度比较高。又在不同时间(t2)重复测定8次,所测定的8次变异系数不超过10%。
3 结 论
本实验从苦荞种子中分离纯化得到一种苦荞麦过敏蛋白,纯度达到95%以上,采用间接酶联免疫吸附法初步建立了此过敏原的特异性抗体检测方法,确定用ELISA检测抗血清时的最适工作条件为包被的抗原质量浓度100μg/mL、阳性血清稀释度1:50、酶标二抗稀释度1:1000,37℃时封闭的最佳时间为40min,包被抗原与阳性血清中抗体的最佳作用时间为40min,阳性血清与酶标二抗的最佳作用时间为40min。ELISA进行的8次重复实验结果显示变异系数较低,证实本方法具有良好的重复性,并且精密度也较好。
制备一个稳定且成熟的特异性过敏原检测试剂需要通过大量的重复实验和临床检测,血清的样本数、抗原的纯度、包被浓度、反应时间及温度等都会对结果造成影响。本研究根据间接ELISA方法初步研制的检测手段具有一定的特异性和稳定性,而对于荞麦食品过敏原检测试剂的商品化开发还需要进一步研究。
[1] LARS K P.In vivoandin vitrotechniques to determine the biological activity of food allergens[J]. Journal of Chromatography B, 2001, 756(1/2): 41-55.
[2] FABJAN N, RODE J, KOSIR I J, et al. Tartary buckwheat (Fagopyrum tataricumGaertn.) as a source of dietary rutin and quercitrin[J]. J Agric Food Chem, 2003, 51(22): 6452-6455.
[3] WIESLANDER G. Review on buckwheat allergy[J]. Allergy, 1996, 51(10): 661-665.
[4] URISU A, KONDO Y, MORITA Y, et al. Identification of a major allergen of buckwheat seeds by immunoblotting methods[J]. Allergy Clin Immunol News, 1994, 6(5): 151-155.
[5] PARK J W, KANG D B, KIM C W, et al. Identification and characterization of the major allergens of buckwheat[J]. Allergy, 2000, 55(11):1035-1041.
[6] MATSUMOTO R, FUJINO K, NAGATA Y, et al. Molecular characterization of a 10-kDa buckwheat molecule reactive to allergic patients’IgE[J]. Allergy, 2004, 59(5): 533-538.
[7] CHOI S Y, SOHN J H, LEE Y W, et al. Characterization of buckwheat 19-kD allergen and its application for diagnosing clinical reactivity[J].Int Arch Allergy Immunol, 2007, 144(4): 267-274.
[8] 陈雪岚, 金晶, 杨晓慧. 恩诺沙星快速酶联免疫吸附法检测试剂盒的研制[J]. 食品科学, 2010, 31(8): 16-19.
[9] 党华, 黄志坚, 邱于斌, 等. 变应原特异性IgE抗体检测试剂盒的研制[J]. 临床检验杂志, 2010, 28(4): 269-270.
[10] 张瑜, 徐国景, 唐利军, 等. 用间接酶免疫吸附试验检测犬狂犬病毒IgG试剂盒及制备方法: 中国, CN1547027A[P]. 2004-11-17.
[11] ZHANG Xin, YUAN Jingming, CUI Xiaodong, et al. Molecular cloning,recombinant expression, and immunological characterization of a novel allergen from tartary buckwheat[J]. J Agric Food Chem, 2008, 56(22):10947-10953.
[12] 任晓霞, 张昕, 崔晓东, 等. 过敏原TBa的表位突变及免疫活性鉴定[J]. 食品科学, 2010, 31(13): 169-173.
[13] WANG Zhuanhua, ZHANG Zheng, ZHAO Zhuohui, et al. Purification and characterization of a 24 kDa protein from tartary buckwheat seeds[J].Biosci Biotech Biochemic, 2004, 68(7): 1409-1413.
Preparation of an ELISA Method for Determining Buckwheat Allergen
ZHANG Xin1,CUI Xiao-dong2,WANG Zhuan-hua2
(1. Research Center for Environmental Science and Engineering, Shanxi University, Taiyuan 030006, China;2. Institute of Biotechnology, Shanxi University, Taiyuan 030006, China)
An indirect enzyme-linked immunosorbent assay (IELISA) was proposed to detect specific antibodies in tartary buckwheat allergenic patients,sera using polystyrene micro-well plate coated with natural tartary buckwheat allergenic proteins and horseradish peroxidase (HRP)-labeled mouse anti-human IgE. Key operations and reaction conditions were optimized. The results showed that the optimal coating antigen concentration, positive serum dilution, HRP-labeled mouse anti-human IgE concentration, blocking time at 37 ℃, reaction time between coating antigen and antibodies in positive sera, and reaction time between positive sera and HRP-labeled mouse anti-human IgE were 100 μg/mL, 1:50, 1:1000, 40 min, 40 min and 40 min,respectively. This method proved highly specific, repeatable and sensitive.
tartary buckwheat;allergen;kit;indirect enzyme-linked immunosorbent assay (IELISA)
R392.11
B
1002-6630(2011)20-0327-04
2010-12-27
山西省科技攻关项目(20100321101);太原市技术创新计划项目(2010-09)
张昕(1981—),女,副教授,博士,主要从事环境科学与免疫学研究。E-mail:xinzhang0051@sxu.edu.cn
