不同地域蜂胶的挥发性成分分析
2011-10-27张红城
延 莎,张红城,董 捷*
(中国农业科学院蜜蜂研究所,农业部国家蜂产品加工专业分中心,北京 100093)
不同地域蜂胶的挥发性成分分析
延 莎,张红城,董 捷*
(中国农业科学院蜜蜂研究所,农业部国家蜂产品加工专业分中心,北京 100093)
采用顶空固相微萃取-气质联用技术分析5个省(安徽、吉林、河北、河南、甘肃)37个蜂胶样品的挥发性成分。结果共测出49种化合物,包括醇、酯、醛以及萜烯类化合物;对37个蜂胶样品的挥发性组分的相对含量进行主成分分析,结果通过这种方法能够对不同地域的蜂胶进行一定的区分,其中甘肃省的蜂胶样品与其他4省的差别最大,而河南、河北和安徽3省的蜂胶样品未能区分开。
不同地域;蜂胶;挥发性成分;主成分分析
蜂胶是蜜蜂采集杨树等植物的新生枝芽和愈伤组织的分泌物,并混入蜂蜡等其自身分泌物中所形成的一种黏性物质[1]。人类使用蜂胶的历史很长[2],可以追溯到公元前300年。据报道,蜂胶具有多种生物活性,即抗癌、抗氧化、抗炎、抑菌、抗真菌和抗肝炎病毒等[3-4],作为一种天然的保健品,蜂胶在市场上很受欢迎。
蜂胶的化学成分取决于蜜蜂采集树脂的地区和植物,不同地区的蜂胶化学成分存在着很大的差别[5-6]。因此,来源不同的蜂胶在化学组成上可能完全不同,这就为蜂胶的标准化带来了困难[7]。作为一种动、植物双源性物质,已有的研究主要是根据蜂胶的活性成分进行区分和鉴定。但是,把单独某种或几种成分的含量作为蜂胶质量的指标是不科学的,因为蜂胶的生物活性并不是某种组分单独作用的结果[5]。若是将结构相同或是类似的化合物归为一类定量分析,对质量进行控制,则可能会导致制假贩假者人为添加一些廉价的类似物,以次充好。气味是蜂胶的一种本质属性,能够反映其内在的特性,而且气味特性是很难人为模拟出来的。本实验从蜂胶的挥发性成分入手,结合主成分分析法对不同来源的蜂胶进行分析。初步的研究表明,利用这种方法能够对不同来源的蜂胶进行一定的区分,为进一步对不同来源蜂胶的质量控制提供理论依据和研究思路。
1 材料与方法
1.1 材料与试剂
毛胶样品(表1),由各样品产地的蜂业推广站提供。
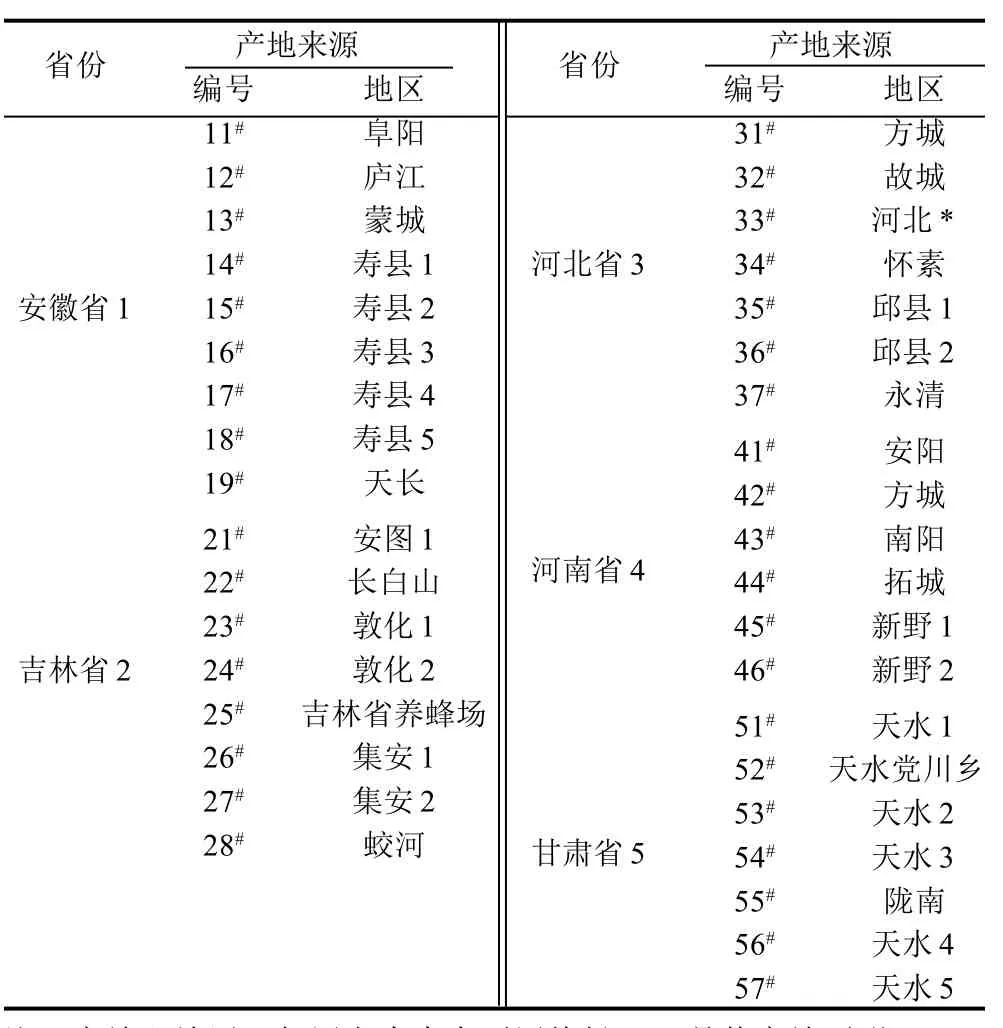
表1 蜂胶样品来源及编号Table1 Numbers and sources of propoli samples
1.2 仪器与设备
PL303电子天平 瑞士Mettler Toledo公司;7890A GC/5975C MS气相色谱-质谱联用仪 美国Agilent公司;中草药粉碎机 天津市泰斯特仪器有限公司;手动固相微萃取(solid phase micro-extraction,SPME)装置、2cm-50/30μm、DVB/Carboxen/PDMS萃取纤维 美国Supelco公司;FDB02DD型加热器 英国Techne公司。
1.3 方法
1.3.1 蜂胶原料前处理
毛胶剔除杂质后放入冷冻柜冷冻4h以上,取出后迅速放入中草药粉碎机粉碎,过20目筛,备用。
1.3.2 蜂胶挥发性成分的提取
对萃取时间、萃取温度和萃取头选择的固相微萃取条件进行优化。萃取时间设定15、30、45、60、75min五个梯度,萃取温度设定25、40、55、70、85、100℃六个梯度,试用4种萃取头,分别为75μm CAR/PDMS、65μm PDMS/DVB、100μm PDMS、50/30μm DVB/CAR/PDMS。最后,优选的萃取条件为使用50/30μm DVB/CAR/PDMS萃取纤维55℃萃取45min。
准确称取0.5g蜂胶样品,置于15mL顶空瓶中,55℃平衡15min,然后将装有萃取头的手动进样器插入顶空瓶中(萃取头使用前根据说明书进行老化),55℃顶空吸附45min,260℃解吸5min。
1.3.3 仪器操作条件
色谱条件:HP-5MS毛细管色谱柱(30m×250μm,0.25μm);初始温度40℃,保持3min,5℃/min升温到200℃,保持1min,再以12℃/min升至260℃,保持1min。进样口温度260℃;载气He,流速1.0mL/min;5:1分流进样。
质谱条件:电离方式EI;电子能量70eV;离子源温度230℃;接口温度280℃;扫描质量范围45~550u。各组分经过NIST标准谱库检索和Wiley谱库相匹配。
1.3.4 数据处理
利用Alpha MOS公司的电子鼻自带数据处理软件(V 12.3),以在不同保留时间流出的化合物作为不同指标,对5个省份的37个样品所得到的各组分的相对含量(根据面积归一法)数据进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 顶空固相微萃取-气质联用检测
通过顶空固相微萃取-气质联用(head space-solid phase micro-extraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)分析安徽、吉林、河北、河南和甘肃5个省的37个蜂胶样品,共检测出49种化合物,包括醇、酯、醛以及萜烯类化合物,表2是根据面积归一法所列出的各化合物的相对含量。其中,苯甲醛、苯甲醇、苯乙醇、乙酸苄酯、乙酸苯乙酯、γ-桉叶醇、β-桉叶醇和α-桉叶醇在5省的蜂胶样品中含量都较高。苯甲醇、苯乙醇及乙酸苯乙酯等具有防腐性作用的物质含量较高,表明蜂胶的挥发性成分对蜂胶的抗菌消炎等生理功效有重要的关系[8]。甘肃省的蜂胶样品较其他4省的差异较大,甘肃省的蜂胶样品桉叶油醇的含量较高,4-萜品醇也只是在甘肃省的蜂胶中发现,萘和香兰素未在甘肃蜂胶样品中发现。
从表2可以看出,不同的蜂胶样品挥发性成分差别较大,并不能简单地根据化合物的种类和数值从地域上进行区分,而且由于所测得的化合物种类较多,很难从中去除冗余信息,挑选出有用的信息,达到使样品之间的区别或是联系明显化的目的。
2.2 主成分分析
用PCA[9-11]方法处理HS-SPME-GC-MS所得到的数据,将各化合物的相对含量导入到Alpha MOS公司的电子鼻自带数据处理软件中,得图1。由图1可知,基于主成分分析结果,第1主成分的方差贡献率为47.331%,第2主成分的方差贡献率为23.52%,第3主成分的方差贡献率为12.237%,前3个主成分的方差累积贡献率达到83.088%(>80%),几乎反映了全部信息。3个主成分所构成的散点图显示了各样品之间的相似程度。图1显示甘肃省的蜂胶样品与其他4省的样品差异较大,其
次是吉林省的蜂胶样品,而安徽、河南和河北3个省的蜂胶样品聚在一起,并未区分开。

表2 37种蜂胶样品的挥发性成分组成及其相对含量Table 2 Identified volatile components and relative contents in 37 propolis samples %

续表2 %

图1 37个蜂胶样品的主成分分析散点图Fig.1 Three-dimensional PCA scatter plot for 37 propolis samples
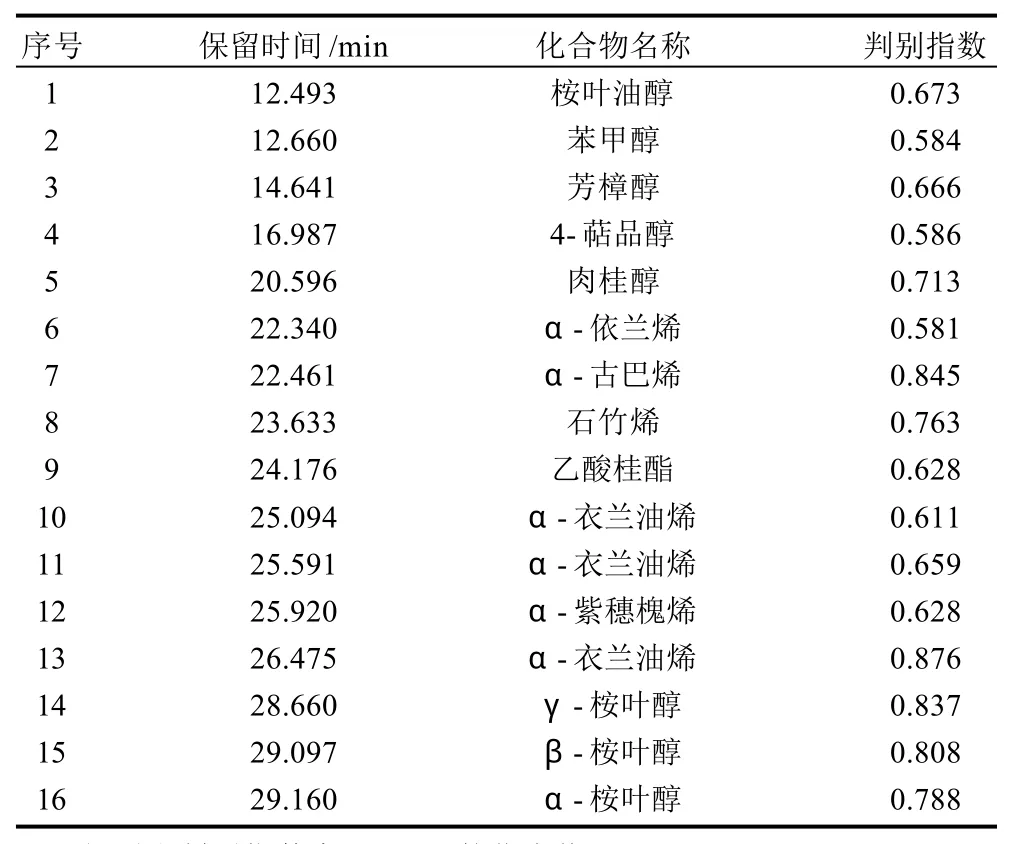
表3 各化合物判别能力列表Table 3 Discriminating capacity of partial identified compounds
表3所列数据是在主成分分析中,软件所得出的各挥发性成分对区分蜂胶样品的判别指数(判别指数最大值为1),其中指数值越大,表明对样品的区分能力越强。在49种挥发性成分中仅列出了区分能力较强的16种。这16种化合物在区分5省的蜂胶样品时,贡献是较大的,尤其是肉桂醇(0.71 3)、α-古巴烯(0.845)、石竹烯(0.763)、α-衣兰油烯(0.876)、γ-桉叶醇(0.837)、β-桉叶醇(0.808)和α-桉叶醇(0.788)。这些挥发性组分在实验的蜂胶样品中,相对含量差异较大,可能是区分不同来源蜂胶的代表性组分,进而可对蜂胶的质量控制提供一定依据。研究表明,蜂胶的挥发性成分与地域来源具有关联性,从而可以推测根据蜂胶的挥发性成分的构成可以判定其来源甚至品质。
3 讨 论
本研究用HS-SPME-GC-MS分析了安徽、吉林、河南、河北和甘肃5个省份的37个蜂胶样品,共检测出49种挥发性成分,包括醇、酯、醛以及萜烯类化合物,其中苯甲醛、苯乙醇、苯甲醇、乙酸苄酯、乙酸苯乙酯、γ-桉叶醇、β-桉叶醇和α-桉叶醇在5个省的蜂胶样品中含量都较高。用主成分分析法对各蜂胶样品的各组分相对含量数据进行处理,结果表明甘肃省的蜂胶与其他4省的蜂胶样品差异较大,其次是吉林,安徽、河南和河北3个中部省份的蜂胶样品并未很好地区分,表明仅根据地域区分蜂胶是不够的,还需要了解胶源植物的信息,从而更有利于对不同来源蜂胶的质量进行控制。
任何物质的气味都是受成百上千的不同的不均一的化合物影响而形成的,包括醇类、醛类、酯类、酮类、吡嗪、酸类和萜烯类等。每种化合物对整体的香气都有一个不同的贡献。每种气味物质会挥发到接近鼻子并与嗅觉器官上皮细胞上合适的传感器相作用,但并不是所有的挥发性成分都具有气味活性[12]。本研究采用的HS-SPME-GC-MS技术,检测得到的挥发性成分,并不是都具有气味活性。例如,烷烃类化合物的阈值一般都比较高,所以这类化合物对产品的风味贡献不大[13]。进一步的研究可以采用气相色谱-气味测定技术[14](GC-olfactometry,GC-O),从而明确蜂胶的主要气味活性成分,从气味活性成分入手,能更真实地反映蜂胶的气味本质特征。
安徽、河北和河南的蜂胶样品区分不好,可能由于它们的地理位置接近,胶源植物相似。要了解蜂胶化学成分差异的原因,必须从蜂胶的植物起源入手[15]。对蜂胶的研究,仅从地域上区分是不科学的,如果有条件应该详细了解胶源植物,将地域与胶源植物结合起来,充足的来源信息可以帮助更好地揭示蜂胶的本质特征。
本实验使用了37个蜂胶样品,其中有一些是来自同一个地区的不同蜂场,由于地理位置较为接近,胶源植物可能较为相似,差异体现并不明显。进一步的试验,取样应尽可能的广泛,较为全面地了解蜂胶挥发性成分的信息。
[1] 南垚, 周立东. 蜂胶、杨树叶及杨树芽中水杨苷和芦丁含量比较[J].世界科学技术: 中医药现代化, 2008, 10(6): 59-61.
[2] BURDOCK G A. Review of the biological properties and toxicity of bee propolis (propolis)[J]. Food and Chemical Toxicology, 1998, 36(4):347-363.
[3] MELLIOU E, STRATIS E, CHINOU I. Volatile constituents of propolis from various regions of Greece-Antimicrobial activity[J]. Food Chemistry, 2007, 103(2): 375-380.
[4] AHN M, KUMAZAWA S, USUI Y, et al. Antioxidant activity and constituents of propolis collected in various areas of China[J]. Food Chemistry, 2007, 101(4): 1383-1392.
[5] 胡福良, 朱威, 李雅晶, 等. 蜂胶化学成分标准化探讨[J]. 中国蜂业,2006, 57(3): 35-36.
[6] BANKOVA V S, de CASTRO S L, MARCUCCI M C. Propolis: recent advances in chemistry and plant origin[J]. Apidologie, 2000, 31(1): 3-15.
[7] BANKOVA V. Chemical diversity of propolis and the problem of standardization[J]. Jounal of Ethnopharmacology, 2005, 100(1/2): 114-117.
[8] 徐响, 董捷, 李洁. 固相微萃取与GC-MS法分析蜂胶中挥发性成分[J]. 食品工业科技, 2008, 29(5): 57-60.
[9] YANG Chao, LUO Liping, ZHANG Haijing, et al. Common aromaactive components of propolis from 23 regions of China[J]. Journal of the Science of Food and Agriculture, 2010, 90(7): 1268-1282.
[10] 许禄, 邵学广. 化学计量学方法[M]. 2版. 北京: 科学出版社, 2004:130.
[11] 唐启义. DPS数据处理系统[M]. 2版. 北京: 科学出版社, 2010: 761-771.
[12] ACENA L, VERA L, GUASCH J, et al. Comparative study of two extraction techniques to obtain representative aroma extracts for being analysed by gas chromatography-olfactometry: application to roasted pistachio aroma[J]. Journal of Chromatography A, 2010, 1217(49): 7781-7798.
[13] 张松山, 孙宝忠, 李海鹏. 四种发酵牛肉中共有香味物质的研究[C]//第七届中国肉类科技大会暨中国奶业高峰论坛. 南京: 中国畜产品加工研究会, 2009: 239-245.
[14] 夏玲君, 宋焕禄. 香味检测技术: GC-O的应用[J]. 食品与发酵工业,2006, 32(1): 83-87.
[15] BANKOVA V. Recent trends and important developments in propolis research[J]. eCAM, 2005, 2(1): 29-32.
Analysis of Volatile Components of Propolis from Different Geographical Origins
YAN Sha,ZHANG Hong-cheng,DONG Jie*
(National Research Center of Bee Product Processing, Ministry of Agriculture, Institute of Apicultural Research,Chinese Academy of Agricultural Sciences, Beijing 100093, China)
The volatile components of 37 propoli samples from five provinces (Anhui, Jilin, Hebei, Henan and Gansu) in China were analyzed by headspace solid phase micro-extraction combined with gas chromatography-mass spectrometry (HS-SPMEGC-MS). A total of 49 compounds were identified including alcohols, esters, aldehydes and terpenoids. The relative contents of the components were analyzed by principal component analysis (PCA). The results showed that propoli samples from different regions could be discriminated by this method. Gansu samples exhibited the largest difference from samples from other four provinces. However, samples from Hebei, Henan and Anhui could not be discriminated.
different regions;propolis;volatiles;principal component analysis
TS207.3
A
1002-6630(2011)20-0191-06
2011-06-30
国家农业(蜂)产业技术体系项目(CARS-45-KXJ18)
延莎(1986—),女,硕士研究生,主要从事功能食品与生物活性成分研究。E-mail:yansha052@126.com
*通信作者:董捷(1966—),女,研究员,硕士,主要从事功能食品与生物活性成分研究。E-mail:jiedon@126.com
