非标记液质联用法测定市售鸡肉和猪肉的蛋白组
2011-10-27周晓宏孙明谦孙宝国廖永红
曹 进,周晓宏,苗 兰,孙明谦,孙宝国,廖永红,*
(1.中国食品药品检定研究院食品化妆品检验检测中心,北京 100050;2.中国中医科学院西苑医院实验研究中心,北京 100091;3.北京理工大学生命学院,北京 100081;4.北京工商大学食品学院,北京 100048)
非标记液质联用法测定市售鸡肉和猪肉的蛋白组
曹 进1,2,周晓宏3,苗 兰2,孙明谦2,孙宝国4,廖永红4,*
(1.中国食品药品检定研究院食品化妆品检验检测中心,北京 100050;2.中国中医科学院西苑医院实验研究中心,北京 100091;3.北京理工大学生命学院,北京 100081;4.北京工商大学食品学院,北京 100048)
采用非标记液质联用法对市售鸡肉和猪肉样品进行蛋白组测定,比较两种肉在新鲜和熬煮后的小肽种类、量的相对变化。结果显示新鲜鸡肉的蛋白主要是大于100kD的蛋白,pI值范围为6~11;而鸡肉汤中蛋白主要是10~150kD,pI值范围为4~9;新鲜猪肉的蛋白主要是大于100kD的蛋白,pI值范围为6~11,与鸡肉相似;而猪肉汤中蛋白主要是10~100kD,pI值范围为3~9。显示了不同肉材质在相似加工中,其蛋白组的变化会有所不同,根据这些不同,提示由蛋白组测试提取出的指标可为肉质量的评价提供新的评价方式。
液相色谱-质谱联用;蛋白组;食品
在日常生活中,人们对食品的选择通常是通过对食品的物质组成、风味、色泽以及外表等基本品质而进行取舍的,食品的这些品质是食品中各种主要和次要组分之间复杂的相互作用的结果[1-2]。食品一般由水、脂肪、蛋白质、糖、维生素等物质组成,在成品食物中,往往还存在较多的辅料和添加剂等,其中蛋白质是作为食品中主要的营养元素,对食品的品质具有重要的影响作用,例如肉类产品质量构成及多汁的特征[3]基本取决于肌肉蛋白质,包括肌动蛋白、肌球蛋白、肌动球蛋白和一些水溶性的肉类蛋白质,另外肉类食品中还包含一些血液中的蛋白,如血红蛋白、白蛋白等,同时也存在许多酶蛋白,这实际上直接决定了肉本身的新鲜程度[3]。由于人体所需的必需氨基酸在体内不能产生,只有通过对蛋白质的摄取来补充,高质量的蛋白质直接决定了有机体对必需氨基酸的摄取数量,而必需氨基酸的水平直接影响了蛋白如何被利用[4]。通常,食物中的蛋白质质量由其氨基酸组成、来源、抗营养因子、处理过程以及贮存条件等的影响,另外,外在影响蛋白质量的因素还有非蛋白饮食的摄取、总能量摄入和细菌或者毒素的污染等[5]。蛋白经过消化后,消解为氨基酸和小肽(通常3~10个残基),通过肠道吸收进入血液,未吸收的蛋白和其他消解产物则经过粪便排出,吸收但没有被代谢的小肽和氨基酸则通过尿液排出体外[1]。另外有些饮食中的蛋白质经过肠道微生物菌群降解而没有功能性作用,这常见于反刍类动物[2]。
由于肉类食材中的蛋白质组成对肉质食品的风味、口味和色泽等都有一定的影响,因此对肉类食材中蛋白组进行鉴定研究,对其中主要蛋白质和小肽进行探索,将为肉类食品品质评价提供一个新的视角[6]。Carbonaro[7]对蛋白组学研究在食品质量评价中的现存和潜在的应用进行了综述,分别就蛋白组学在肉类、谷物以及食品技术中的应用进行了介绍,并对蛋白组方法用于食品过敏、功能食品及生物等效性方面的研究进行了总结和展望;Remignon等[8]认为由于肌肉主要是由水分和蛋白质组成的,因此蛋白组分析将为确定肉品的质量提供结构和功能方面的信息,同时,由于蛋白组分析在肉类,特别是家禽类食材中应用尚属初步,因此蛋白组方法将为解决肉品质评价问题提供一条新的途径。
本实验利用液质联用的蛋白组分析手段,对从市场上购买的鸡肉和猪肉在加工前后的样品进行测定,在对市售鸡肉和猪肉的蛋白组进行鉴定的同时,主要针对小于3000D的小肽进行比较分析,希望从中发现与肉类风味相关的小肽,为用于今后肉品的风味评价提供检测技术方法和潜在指标来源。
1 材料与方法
1.1 材料与试剂
鸡肉和猪肉均购自超市,其中鸡肉为普通家鸡(Gallus gallus)的胸脯肉,猪肉为普通杜洛克猪(Sus domesticus)的后臀尖。
三羟甲基氨基甲烷(Tris) 美国Amresco公司;TCEP、胰蛋白酶(Trypsin) 美国Thermo公司;碘代乙酰胺(IAA) 美国Sigma公司;乙腈(色谱纯) 美国Fisher公司;丙酮(色谱纯)、甲酸(分析纯) 美国J. T. Braker公司;BCA试剂盒 百泰克公司;实验用水为市售纯净水。
1.2 仪器与设备
6340 Ion Trap(ChiESI源)、1200 nanoLC、chemstaion色谱工作站、Chip 300A、C18(75μm×15cm)柱(蛋白分析用) 美国安捷伦公司。
1.3 方法
1.3.1 肉材质来源及处理
对鸡肉和猪肉分别进行处理,去除表面脂肪和其他杂质,肌肉用清水冲洗后,剪碎待用;上述碎肉,一部分进行匀浆化,匀浆基液为Tris缓冲液,匀浆离心过滤取上清液待用,作为熬煮前样品;另取一部分肉,按1:3(V/V)加水熬制肉汤,煮沸后慢火1.5~3h,滤取上清液待用,作为熬煮后样品。
1.3.2 蛋白样品制备
取1mL上述滤液,4℃放置30min后,离心(3000r/min、15min),取上清液转移至Ep管,离心(7500r/min、30min),取上清液,可马上提取或者放入-80℃低温保存,可保存2周。应用双辛丁酸法(bicinchoninic acid protein assay,BCA)测定蛋白质量浓度,操作参考文献[9]。
取50μL上述清液与等体积50mmol/L Tris缓冲液混合,涡旋1min,加入3倍体积-20℃冷丙酮,涡旋1min,4℃沉淀过夜,4℃、8000r/min离心15min,取沉淀,使丙酮挥发完全,-8 0℃保存。
1.3.3 蛋白质酶解
将肉的匀浆上清液和熬制肉汤上清液置于pH8.5的50mmol/L Tris缓冲液中混悬,质量浓度约1~3mg/mL;活化胰酶后,以蛋白含量与酶液比例为20:1加入酶液,37℃水浴6h,每1h涡旋1次,此为第1次消解;加入1mmol/L TCEP,37℃水浴30min,放冷至室温;进行烷基化,3μL IAA溶液对应10μg蛋白,37℃水浴20min(避光);第2次消解,以蛋白含量与酶液比例为30:1加入酶液,37℃水浴过夜;终止反应,每50μL溶液加入2μL甲酸;4℃、12000r/min离心15min,取上清液分析。
1.3.4 质谱及色谱条件
质谱条件:扫描模式Ultra Scan;离子源ESIChip;正电;毛细管电压-1900V;干燥气 300℃;流量3.0L/min;透镜电压30V;毛细管出口100V;离子稳定参数80.0;离子累积 300000;最大采集时间200ms;二级碎裂l.0V;质量范围m/z300~2000。
色谱条件:Chip:40nL富集容量;进样量:0.2 μL;泵1(纳升泵)流动相:A相为97%水-3%乙腈溶液-0.1%甲酸,B相为90%乙腈-10%水-0.1%甲酸;流速:0.3μL/min;线性梯度洗脱时间程序如下:起始B 3%,0~70min线性上升到45%,70~85min线性上升到90%,85~95.01min线性上升到100%,保持15min,110~115min下降至3%,持续10min;运行时间:125min;泵2(毛细泵)流动相:A相为0.1%甲酸溶液,B相为90%乙腈-10%水-0.1%甲酸;流速:3μL/min;线性梯度洗脱时间程序如下:起始B 0%持续4min;4~5min线性上升到80%,持续5min,10.01~85min维持80%,流速为0μL/min,85.01~95min线性上升到100%,流速恢复至3μL/min,第96分钟降至0%;运行时间:125min。
1.4 数据收集与数据处理
1.4.1 MS/MS数据搜索
MS/MS数据分析应用美国安捷伦Spectrum Mill软件,通过搜索参数和验证参数严格的设置,得到准确性高的搜索结果。参数设置:数据库:Swissprot;消解酶:胰酶;固定修饰:Carbamidomethylation(C);母离子:+/-2.5D;子离子:+/-0.7;多肽过滤参数大于6,峰响应得分大于60%;蛋白过滤参数大于1 1。
1.4.2 数据处理
应用Chemstaion色谱工作站中的DataAnalysis软件进行图谱分析;利用Spectrum Mill软件进行蛋白搜索。
2 结果与分析
2.1 市售鸡肉和猪肉中的总蛋白量
样品经1.3.1节方法处理后,获得上清液和肉汤的上清液,通过BCA法进行蛋白总量的测定,见表1。经过测定,新鲜鸡肉中的蛋白量平均为22.3%,鸡肉汤中的蛋白量占原蛋白量平均为3.5%左右;而新鲜猪肉中的蛋白量平均为22.5%,猪肉汤中的蛋白量占原蛋白量平均为2.5%左右,可以看到经过熬煮,蛋白质由于变性而有所损失,其中可能由于鸡肉与猪肉的肌浆和肌纤维不同,所含的蛋白组成不一样,鸡肉的蛋白损失量比猪肉小,大约存在2倍差异。

表1 鸡肉与猪肉样品中蛋白量(以质量分数计)Table 1 Protein contents of fresh chicken, chicken soap, fresh pork and pork soap
2.2 鸡肉中蛋白组的表达
经测定,在新鲜鸡肉样品中可以找到272个蛋白,其中肌肉纤维及结构相关的蛋白占总量的87%,主要有肌球蛋白、肌动蛋白、肌联蛋白、原肌球蛋白及肌钙蛋白等,而肌浆中蛋白则占8%左右,其主要蛋白包括磷酸甘油醛脱氢酶、肌酸激酶、磷酸化酶、醛缩酶及烯醇酶等酶类蛋白。在熬煮后的鸡汤样品中,可以发现175个蛋白,主要的蛋白与新鲜样品中存在的有很大的不同,肌凝蛋白和肌动蛋白存在较少,主要是肌联蛋白、组蛋白以及胶原蛋白等。
2.3 猪肉中蛋白组的表达
在新鲜猪肉样品中可以找到327个蛋白,其中蛋白组基本轮廓与鸡肉相似,与肌肉纤维和结构有关的蛋白占91%,种类与鸡肉类似,仅所占比例不同;在熬煮的猪肉汤样品中,可以发现193个蛋白,同样与新鲜样品的蛋白组存在较大不同,肌球蛋白、胶原蛋白以及前体蛋白占其中主要的比例,而其他肌肉中的蛋白如肌动蛋白、肌钙蛋白等则较新鲜样品损失很多。
2.4 鸡肉在熬煮前后小肽的变化
由于小肽是肉类物质消化后主要被吸收的部位,同时,肉的质量及其风味也与小肽物质有着较大的联系,因此实验主要抽取了酶解样品中小于3000D的小肽做熬煮前后的比较,参见表2,其中熬煮前是指新鲜肉样品,熬煮后是肉汤样品,参见1.3.1节。
2.5 猪肉在熬煮前后小肽的变化
实验比较猪肉中蛋白产生小肽在熬煮前后的变化,参见表3,其中熬煮前是指新鲜肉样品,熬煮后是肉汤样品,参见1.3.1节。
2.6 实验条件优化
实验过程采用的是数据依赖性非标记液相色谱质谱联用的方法[10]。方法利用离子阱质谱快速扫描的功能,对同一时间洗脱出来的物质,前5个获得最大响应的一级质谱离子,按顺序进行2级质谱碎裂,从而获取其序列信息。色谱分离、质谱参数经过优化,结果参见实验部分,需要指出的是,由于本实验中应用的芯片,其富集体积为40nL,容量较小,在进样量为0.2μL的情况下,富集柱处于过饱和状态,如直接进行洗脱,则很可能由于流路中残存的有机相及样品中所含亲水性大分子杂质的影响,而不保留,因此本实验对一维富集的方式进行了优化,在上样后,利用纯水相冲洗,使得样品中所含的肽富集在柱上,同时所含的水溶性杂质则被冲洗入废液中,这种冲洗方式富集了待分析物质,增加了其分析容量。
2.7 鸡肉材质蛋白组中蛋白分布及比较
实验测定了鸡肉材质中的蛋白组,如2.2节所述,主要是来自肌肉纤维和结构相关的蛋白,其蛋白组分布参见图1,可以看到,材质中肌球蛋白和肌动蛋白占总蛋白的70%左右,同时测定结果也表明,在熬煮后的蛋白样品中,该两种蛋白的量较少,另外,总蛋白在
新鲜和熬煮后样品中存在90%左右的损失,这说明在实际肉汤中所含的蛋白营养主要来源于其他纤维蛋白或者蛋白的降解产物。通过对蛋白的分子质量范围及等电点分布比较,可以看到,新鲜鸡肉的蛋白主要是大于100kD的蛋白,pI范围为6~11;而肉汤中蛋白主要是10~150kD,pI范围为4~9,这些说明了蛋白类营养物质在加工前后,存在的变化,小蛋白及肽成为鸡肉汤的主要营养成分。

表2 鸡肉熬煮前后蛋白酶解产生小肽的变化Table 2 Variations of small peptide compositions in chicken before and after cooking

表3 猪肉熬煮前后蛋白酶解产生小肽的变化Table 3 Variations of small peptide compositions in pork before and after cooking
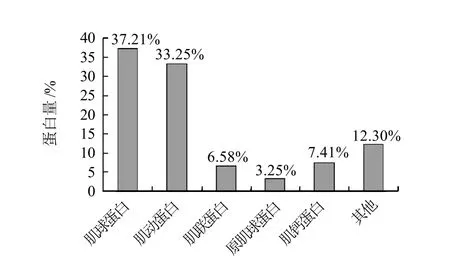
图1 鸡肉中的蛋白分布Fig.1 Protein compositions and their contents in chicken
2.8 猪肉材质蛋白组中蛋白分布及比较

图2 猪肉中的蛋白分布Fig.2 Protein compositions and their contents in pork
实验同样测定了猪肉材质中的蛋白组,同样,其主要来源是来自肌肉纤维和结构相关的蛋白,其蛋白组分布参见图2,可以看到,材质中肌球蛋白和肌动蛋白也占总蛋白的70%左右,同时测定结果也表明,在熬煮后的蛋白样品中,该两种蛋白的量较少,另外,总蛋白在新鲜肉和熬煮后肉汤样品中存在80%左右的损失,这说明在实际肉汤中所含的蛋白营养主要来源于小的蛋白或者蛋白的降解产物。通过对蛋白的分子质量范围及等电点分布比较,可以看到,新鲜猪肉的蛋白主要是大于100kD的蛋白,pI范围为6~11,与鸡肉相似;而肉汤中蛋白主要是10~100kD,pI范围为3~9,这些说明了蛋白类营养物质在加工前后,存在的变化,小蛋白及肽成为猪肉汤的主要营养成分,另外与鸡肉相比,猪肉中来自纤维蛋白的组分,在加工后损失更多,其组成中酸性氨基酸的比例也较鸡肉为多。2.9 小肽的析出和营养的关系
以上结果显示,小于3000D的小肽,猪肉要少于鸡肉,这从侧面说明了猪肉的蛋白组成结构与鸡肉存在不同,猪肉经过熬煮,较多产生分子质量大于3000D的肽,占总肽的70%,而鸡肉则存在较多小于3000D的肽,占总肽的75%,这可能与猪肉中存在较多纤维蛋白有关;肉质食品的肽主要有两个来源,一个是本身存在的,一个是蛋白降解产生的,这些也是营养摄取的主要资源[11],在加工过程可以看到,经过一段时间的熬煮,鸡肉和猪肉都存在一个香味和口感的最佳区域,与肽的析出存在平行关系,但不呈线性,简单试验表明,煮沸后小火熬煮1.5~2.5h,是鸡肉的香味口感最佳区域,而猪肉则为2~3h,小肽的析出量在鸡肉中2h存在最大值,猪肉为2.5h,之后均保持一定的水平,但是熬煮过程,随着香味的走失,肽量也会发生变化,其分子质量范围也向小分子方向迁移,具体到肽的析出与营养的关系,还尚需研究,但是可以看到熬煮有利于肽的析出,从而有利于营养的摄入。由于蛋白是生理活动的载体和产物,它从侧面反映了生理活动的机理,同时作为营养源的主要部分,直接与营养的摄入有着密切的联系,利用蛋白组产生的指标,来定性说明肉质产品的质量和品质状况,另外还可以利用蛋白组在加工前后的相对变化来间接或者直接的评价风味口感的变化。这些都将是未来组学应用到食品科学的重要研究内容。
同时,肉类食品的风味与肉的处理和加工,以及添加剂的加入有很大的关系[12],但是作为肉质风味的基础还是主要来自肉类本身,很多风味研究着眼于其散发的气味,即肉中的挥发性成分,其中有机酸、甾体、碱性物质都分别针对的是酸、腥、涩等不同口感和气味[13-14]。有研究人员[15]还利用蛋白组鉴定蛋白,采用其中M型磷酸等作为猪肉含水量的评价指标。本研究中发现,蛋白组在肉质加工前后存在一定的变化,不同来源的肉其蛋白组的变化也不相同,同时,小肽的析出也根据肉质的不同会有所差异,且加工的时间及条件参数会影响析出的量和风味水平,预示了上文提到的小分子风味物质可能与小肽存在一定的相关性,需要进一步研究和确定。
3 结 论
利用蛋白组评价肉质食材在加工前后的变化,是食品科学研究领域一个较新的研究方向,在评价方式和评价指标方面还没有一套完整的研究思路和体系供食品质量、风味等方面应用,基于蛋白质在生理过程、营养中的重要作用和特点,利用蛋白组对食材进行鉴定分析,提取其中指标用于食材评价,将为食品科学研究带来新的途径。
[1] FENNEMA O R. 食品化学[M]. 3 版. 王璋, 许时婴, 汤坚, 等, 译. 北京: 中国轻工业出版社, 2003: 1-10.
[2] NEWTON D E. Food chemistry[M]. New york: Facts on File Inc.,2007: 1-10; 267-346.
[3] TAYLOR A J, LINFORTH R S T. Food flavour technology[M]. 2nd Edition. Oxford, UK: Wiley-Blackwell, 2010: 51-88; 90-116.
[4] TARTE R. Ingredients in meat products[M]. Wisconsin, US: Springer,2009: 145-150.
[5] DEMAN J M. Principles of food chemistry[M]. 3rd Edition. Maryland,USA: An Aspen Publication, 1999: 111-152.
[6] GAO-SOKA D, KOVA S, JOSI D. Application of proteomics in food technology and food biotechnology: process development, quality control and product safety[J]. Food Technol Biotechnol, 2010, 48(3): 284-295.
[7] CARBONARO M. Proteomics: present and future in food quality evaluation[J]. Trends in Food Science and Technology, 2004, 15(3/4):209-216.
[8] REMIGNON H, MOLETTE C, BABILE R, et al. Current advances in proteomic analysis and its use for the resolution of poultry meat quality problems[J]. Pigs and Poultry, 2006, 62(1): 123-130.
[9] CAO J, GONZALEZ-COVARRUBIAS V, STRAUBINGER R M, et al. A rapid, reproducible, on-the-fly orthogonal array optimization method for targeted protein quantification by LC/MS and its application for accurate and sensitive quantification of carbonyl reductases in human liver[J]. Anal Chem, 2010, 82(7): 2680-2689.
[10] 厉欣, 徐松云, 张宇, 等. 基于保留时间和质荷比匹配的液相色谱-质谱联用技术用于非标记肽段的差异分析[J]. 分析化学, 2008, 36(7): 867-873.
[11] LEO M, NOLLET L. Handbook of muscle foods analysis[M]. London,UK: CRC Press, 2009: 57-71.
[12] LEO M, NOLLET L. Handbook of meat, poultry and seafood quality[M]. London, UK: Blackwell Publishing, 2007: 111-126.
[13] 林宇山, 岑泳延. 对猪肉风味的探讨[J]. 食品工业科技, 2007, 27(9):194-197.
[14] DEIBLER K D. Handbook of flavor characterization[M]. New York,USA: Marcel Dekker, 2004.
[15] DICK F M, van de WIEL, WEI Lizhang. Identification of pork quality parameters by proteomics[J]. Meat Science, 2007, 77(1): 46-54.
Proteome Profiling of Chicken and Pork from Market by Label-free Liquid Chromatography-Mass Spectrometry
CAO Jin1,2,ZHOU Xiao-Hong3,MIAO Lan2,SUN Ming-Qian2,SUN Bao-Guo4,LIAO Yong-Hong4,*
(1. Center of Food and Cosmetics Analysis, National Institute of Food and Drug Control, Beijing 100050, China;2. Research Center, Xiyuan Hospital, China Academy of Chinese Medical Sciences, Beijing 100091, China;
3. School of Life Science, Beijing Institute of Technology, Beijing 100081, China;
4. School of Food, Beijing Technology and Business University, Beijing 100048, China)
Label-free liquid chromatography-mass spectrometry was employed for proteome profiling of commercial chicken and pork in present study. In addition, the differences in the variety and amounts of small peptides between fresh and cooked samples of both meat species were compared. The results showed that fresh chicken mainly contained > 100 kD proteins with a pI ranging from 6 to 11. Most proteins in chicken soap ranged between 10 kD and 150 kD and revealed a pI of 4-9. Fresh pork also mainly contained 100 kD proteins with an pI ranging from 6 to 11. Most proteins in pork soap were 10-100 kD and had a pI of 3-9. Hence, similarly processed samples of different meat species differed in the proteome, suggesting indexes obtained in proteome profiling can provide a new strategy for meat quality evaluation.
liquid chromatography-mass spectrometry (LC-MS);proteomics;food
TS201.4
A
1002-6630(2011)20-0130-06
2010-12-27
“十二五”国家科技支撑计划项目(2011BAD23B01;2011BAC11B06)
曹进(1970—),男,副研究员,博士,研究方向为药物分析。E-mail:cao1208@gmail.com
*通信作者:廖永红(1965—),女,教授,硕士,研究方向为生物工程。E-mail:liaoyh@th.btbu.edu.cn
