抑制肿瘤血管新生的复合肽VBP3局部刺激与全身过敏性实验*
2011-10-24康艳丽向军俭王盼盼吕卫东
康艳丽, 王 宏, 向军俭, 王盼盼, 吕卫东, 邓 宁
(暨南大学抗体工程研究中心, 广东 广州 510632)
抑制肿瘤血管新生的复合肽VBP3局部刺激与全身过敏性实验*
康艳丽, 王 宏, 向军俭, 王盼盼, 吕卫东, 邓 宁△
(暨南大学抗体工程研究中心, 广东 广州 510632)
目的评价抑制肿瘤血管新生的复合肽VBP3的安全性。方法同体左右侧自身对比法对3 只家兔进行皮下注射的局部刺激实验。28 只豚鼠随机分为4组:无菌生理盐水(PS)阴性对照组6只,牛血清白蛋白(BSA)阳性对照组6只,复合肽VBP3 低剂量组6只,复合肽VBP3高剂量组6只,进行全身过敏实验;剩余4只豚鼠,牛血清白蛋白阳性对照组和复合肽VBP3 高剂量组各2只,不经致敏直接心脏激发。结果抑制肿瘤血管新生的复合肽VBP3 对家兔皮下注射的局部刺激反应轻微;豚鼠实验仅复合肽VBP3高剂量组1只豚鼠出现弱阳性过敏反应,且很快缓解,其余豚鼠未见过敏症状。结论抑制肿瘤血管新生的复合肽VBP3在本实验条件下安全。
血管内皮细胞生长因子; 成纤维细胞生长因子 2; 复合肽疫苗VBP3
肿瘤生长与其血管新生有非常密切的关系,是肿瘤增生、扩散和微转移灶发展的重要条件之一, 内皮细胞生长因子(vascular endothelial growth factor,VEGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是促进肿瘤血管生长作用最强的2种关键因子,是诱导血管生成的主要调节因素,并且二者在血管新生中具有协同作用[1-5],是肿瘤治疗的重要靶分子,在肿瘤的生物治疗中起了举足轻重的地位。本室的抗肿瘤复合肽基因工程疫苗以细菌硫氧还原蛋白为载体蛋白,计算机模拟得到一系列VEGF和bFGF 相关表位连接到载体蛋白的C端构成的融合蛋白。bFGF和VEGF优势抗原表位组成的复合肽疫苗内共同激发抗bFGF抗体和抗VEGF抗体,2种抗体协同作用,共同阻断其信号通路,以达到阻断肿瘤生长的作用。
疫苗是一种特殊的生物制品,有效性和安全性是构成其使用价值的两个方面,缺一不可[6]。各国都把预防用生物制品临床前安全性评价纳入法规管理的范畴。疫苗的临床前安全性研究是指为评价疫苗安全性,在实验室条件下进行的各种临床前动物安全性评价[7]。临床前动物安全性评价的主要目的系通过相关动物来考察疫苗的安全性,包括对免疫器官和其它毒性靶器官的影响、毒性的可逆性,以及与临床相关的参数,预测其在大规模人群中使用时可能出现的不良反应,降低临床试验受试者和临床使用者承担的风险,并为临床试验方案的制订提供依据。临床前动物安全性评价的主要内容包括:长期毒性实验、急性毒性实验、局部刺激实验、过敏实验和生殖毒性实验,而针对不同疫苗又要具体问题具体分析。本研究是在前期已完成了VBP3复合肽有效性实验的基础上,验证了疫苗具有免疫原性,可在体内引起抗原抗体反应,可以中和VEGF和bFGF的促血管生成作用,并且可以显著抑制肿瘤的生长,拟通过观察局部刺激反应及动物过敏实验来评价复合肽VBP3的安全性。
材 料 和 方 法
1材料
1.1动物 新西兰兔3只,重2.0-2.5 kg;豚鼠,雄性白色,体重250-400 g,28只。实验动物均购自南方医科大学实验动物中心。
1.2药物与试剂 基因工程复合肽VBP3,本室自行发酵表达;牛血清白蛋白(bovine serum albumin,BSA),Sigma;0.9%生理盐水由暨南大学华侨附属医院提供。
1.3仪器 Eppendoff 冷冻离心机;轮转式组织切片机,Letia RM 2245;生物组织自动包埋机,Taiva TB-718E型;恒温摊片烤片机,Taiva TK-218EⅡ型,购自Pari Boy;Olympus显微镜为日本奥林巴斯公司产品。
2方法
2.1家兔局部肌肉刺激实验[8]
① 给药剂量及方法 实验前24 h,用剪毛剪剔除3只新西兰兔两肋侧兔毛,去毛范围左右各3 cm×3 cm。采用同体左右侧对比法,皮下单次注射,注射部位为两肋侧脱毛区皮下。左侧注射采用生理盐水溶解的复合肽VBP3 ,剂量为1 g/L ;右侧注射同体积生理盐水。
② 动物观察 在给药后72 h 对动物和注射部位进行肉眼观察(观测指标见表1),观察结束后,由耳缘静脉注入空气处死,分离出皮肤及皮下组织,进行肉眼观察。并留取标本,制作石蜡切片。光学显微镜下观察有无出血、水肿、坏死、炎症细胞浸润等病理改变。
2.2豚鼠全身过敏实验
① 动物分组 阴性对照组:给予0.2 mL 无菌生理盐水致敏。阳性对照组:给予5 mg/0.2 mL 牛血清白蛋白致敏。低剂量组:给予0.5 mg/0.2 mL VBP3(无菌生理盐水溶解)致敏。高剂量组:给予1 mg/0.2 mL VBP3(无菌生理盐水溶解)致敏。
② 给药方式 隔天皮下注射给予设定的致敏剂量,连续5次,末次致敏注射后10日,经心脏直接注射致敏剂量的2 倍量药液进行激发。剩余4只豚鼠,牛血清白蛋白阳性对照组和复合肽VBP3 高剂量组各2 只,不经过致敏直接心脏激发。
③ 动物观察 致敏期间,每天观察每只动物的症状;心脏注射后,按以下症状评分详细观察每只动物的反应、症状的出现及消失时间:0:正常;1:不安宁;2:立毛;3:发抖;4:搔鼻;5:喷嚏;6:咳嗽;7:呼吸急促;8:排尿;9:排粪;10:流泪;11:呼吸困难;12:罗音;13:紫癜;14:步态不稳;15:跳跃;16:喘息;17:痉挛;18:横转;19:潮式呼吸;20:死亡。并按下列标准评价其致敏性:过敏反应阴性(-):无过敏症状;过敏反应弱阳性(+):出现1-4 症状;应阳性(++):出现1-10 症状;过敏反应强阳性(+++):出现1-19 症状;过敏反应极强阳性(++++):豚鼠死亡。在第1次、最后1次致敏和激发当天测定每组每只豚鼠的体重。
④ 肺组织病理切片检查 豚鼠股动脉放血处死。取肺下叶浸泡于10% 甲醛中,2 d 后取出肺组织,石蜡包埋,切5 μm 厚度片,HE染色,显微镜高倍镜下观察肺组织是否有发生病变或炎症细胞浸润。
3统计学处理
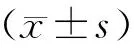
结 果
1注射部位刺激实验结果
1.1肉眼观察结果 家兔单次注射复合肽VBP3后,观察72 h,3只家兔均活动正常,处死家兔后,取出给药部位皮肤及皮下组织,3 例肉眼观察,皮肤部位均无明显充血、出血、红肿、硬结等反应,有一例皮下组织可见0.2 cm 的局部充血,见图1。按表1[10],反应级数为1级。

表1 皮下注射局部刺激性实验肉眼观察指标
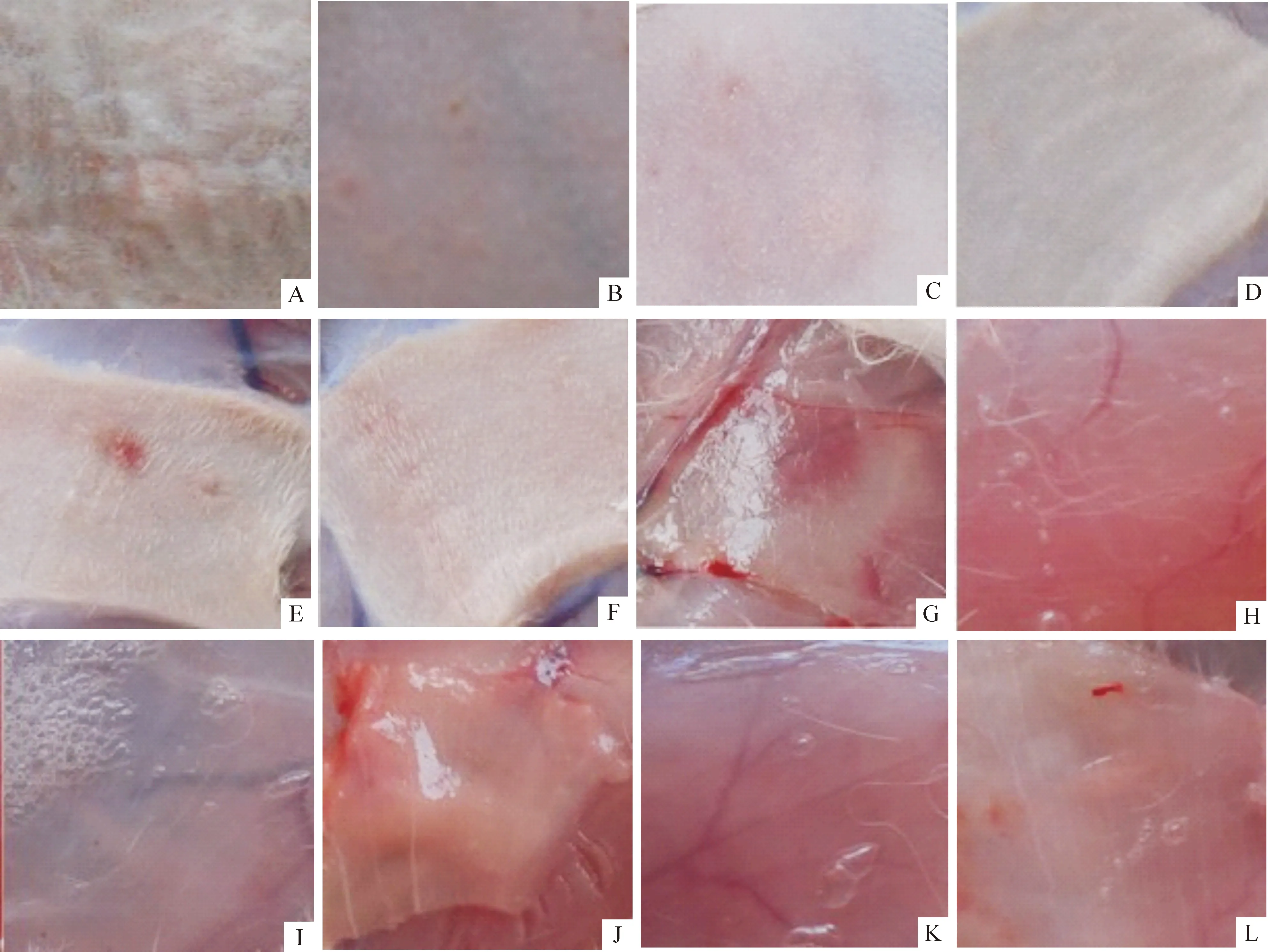
Figure 1. Macroscopic observation index of the local muscular stimulation.A,B,C,G,H,I:VBP3 injection;D,E,F,J,K,L:normal saline injection.
图1皮下注射局部刺激性实验肉眼观察指标
1.2病理切片检查结果 注射部位皮肤及皮下组织病理切片检查结果:注射生理盐水组,肌细胞正常,无变性坏死,无炎症细胞浸润;注射复合肽VBP3 组,可见散在少量肌细胞变性,肌束间可见微量炎症细胞浸润,以单核细胞为主,见图2。
2豚鼠全身过敏实验结果
2.1致敏期间豚鼠日常活动的变化 各组相比较:活跃程度、进食量、排泄物形状、分泌物、外观未见明显差别。饲养过程中,在第1次、最后1次致敏和激发当天测定每组每只豚鼠的体重。对各组数据进行统计分析,各组间体重无显著差异(P>0.05),见图3。
2.2全身过敏情况 各组均于末次致敏后10 d 1次激发,过敏反应症状观察结果见表2。生理盐水阴性对照组:激发后无反应,连续观察3 h,未见过敏反应症状,全身过敏评估反应阴性。注射牛血清白蛋白阳性对照组:激发后均在30 min 内陆续出现竖毛、呼吸急促、排尿、牌匾、步态不稳、跳跃、痉挛等症状,有2例分别于第14 min , 17 min 内出现潮式呼吸,横转、随即死亡。余均于激发后2-3 h内缓解至恢复。全身过敏反应评估为强阳性。低剂量组:连续观察3 h,均未见过敏反应。全身过敏反应评估阴性。高剂量组:仅有1例于激发后18 min 出现立毛,全身过敏反应弱阳性,余豚鼠均无明显全身过敏反应症状。不经过致敏直接心脏激发的牛血清白蛋白阳性对照组和高剂量组:激发后无反应,连续观察3 h,未见过敏反应症状,全身过敏评估反应阴性。
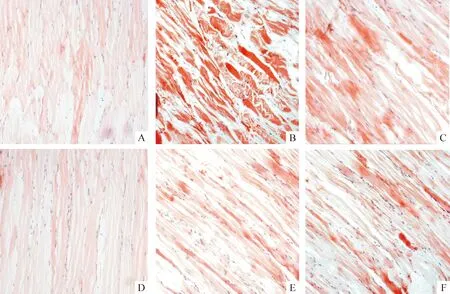
Figure 2. Micropathology of the rabbits local muscle after injection(HE staining).A,B,C:VBP3 injection(×100);D,E,F:normal saline injection(×100).
图2家兔注射局部肌肉病理切片图

图3不同时期豚鼠体重折线图

表2 豚鼠激发后过敏反应症状评分
BSA:bovine serum albumin;NS:normal saline.
2.3病理切片检测结果 牛血清白蛋白阳性对照组豚鼠经牛血清白蛋白5 次致敏后,与其它组比较,支气管周围有少量的嗜酸性粒细胞和中性粒细胞浸润,淋巴细胞和巨噬细胞也有增加;高剂量组发生立毛的豚鼠,肺部有病灶区,诊断为慢性支气管炎;其它剂量组炎症细胞较少,见图3。

Figure 4. Micropathology of the lungs of guinea pigs after being activated(HE staining).A:positive control of BSA (×200); B: BSA without the sensitization(×200); C:negative control(×100); D: high dose vaccine without the sensitization (×100); E: high-dose vaccine (×100); F: low-dose vaccine (×100).
图4豚鼠肺部组织病理切片图
讨 论
VBP3 复合肽是将bFGF 和VEGF 的多个抗原表位通过柔性Linker 串联,在原核表达系统中表达获得。通过小鼠黑色素瘤移植瘤模型表明,该复合肽能抑制肿瘤生长及肿瘤血管新生[11]。然而,在用于人体之前,还有许多亟需解决的问题。其中,肽疫苗接种的安全性是必须首先考虑的一个方面。
刺激性是指非口服药物制剂给药后对给药部位产生的可逆性炎症改变,若给药部位产生了不可逆性的组织损伤则称为腐蚀性。刺激性实验是考察动物的血管、肌肉、皮肤、黏膜等部位接触受试物后是否引起红肿、充血、渗出、变性或坏死等局部反应。本实验选取与人类皮肤接近的新西兰兔作为实验对象,采取与临床一致的皮下注射方式免疫新西兰兔,注射部位无红肿、糜烂、溃疡等不良反应。切取局部组织后观察,反应级数为1,结果为局部刺激轻微,病理切片检查未见皮下组织有明显坏死及结构破坏,只有极少量单核细胞浸润,说明复合肽VBP3 局部皮下注射并未对实验对象造成不可逆性的组织损伤,可用于皮下注射。
疫苗的免疫毒性是临床前研究关注的重点,由于疫苗在临床上很可能引起超敏反应,因此应在临床前完成常规豚鼠主动过敏试验。主动过敏实验通常是采用诱导-激发的方法。本试验诱导阶段采用皮下注射的方法,使外来抗原进入机体后引起T 细胞发生致敏,而激发阶段是致敏淋巴细胞再次接触相同抗原后的效应阶段。过敏反应与剂量是没有关系的,但是FDA要求设置多剂量组来完成试验。在本实验中,参考小鼠免疫剂量100 μg,设置复合肽0.5 mg、1 mg 两个致敏剂量组,分5 次给药,均高于常规给药剂量,符合实验要求。生理盐水对照组无过敏反应,而己知具有强致敏性的牛血清白蛋白诱发了极强阳性过敏反应,而用强致敏性的牛血清白蛋白激发未经过致敏的豚鼠,豚鼠并未发生变态反应,表明成功建立了豚鼠过敏模型。实验期间,动物的体重均有所增加,统计表明各组之间的体重变化无显著差异。VBP3 低剂量组及高剂量组,大部分均无过敏反应,个别因个体差异可出现弱阳性过敏反应症状,但短时间内即可自行缓解,说明VBP3几乎无致敏性。VBP3 以2倍剂量直接激发未经过致敏的豚鼠均未出现不良或过敏症状,说明未经过致敏的豚鼠一次可以承受远高于临床剂量的VBP3 ,故认为,一次高剂量吸收并不影响豚鼠的健康,VBP3 致敏的危险性小。
虽然科学的临床前安全性评价能够为疫苗的临床实验和使用提供大量的信息,但由于动物的感染和免疫应答过程不可能与人体完全相同,因此动物实验在反映临床安全性时必然存在局限性。但从药物评价的角度出发,临床前安全性评价中动物出现的任何毒性反应在临床实验中都必须得到充分的重视。
[1] Tsunenari I, Yamate J, Sharma KD, et al. Expressions of vascular endothelial growth factor and basic fibroblast growth factor in tumors induced by two different cloned cell lines established from transplantable rat malignant fibrous histiocytoma[J]. J Vet Med Sci,2000,62(7):699-705.
[2] Bian XW, Du LL, Shi JQ, et al. Correlation of bFGF, FGFR-1 and VEGF expression with vascularity and malignancy of human astrocytomas[J]. Anal Quant Cytol Histol,2000,22(3):267-274.
[3] Danielsen T, Rofstad EK. The constitutive level of vascular endothelial growth factor (VEGF) is more important than hypoxia-induced VEGF up-regulation in the angiogenesis of human melanoma xenografts[J]. Br J Cancer,2000,82(9):1528-1534.
[4 ] Li D,Wang H,Xiang JJ, et al.Monoclonal antibodies targeting basic fibroblast growth factor inhibit the growth of B16 melanomainvivoandinvitro[J]. Oncol Rep,2010,24(2), 457-463.
[5] Lamszus K, Lengler U, Schmidt NO, et al. Vascular endothelial growth factor, hepatocyte growth factor/scatter factor,basic fibroblast growth factor,and placenta growth factor in human meningiomas and their relation to angiogenesis and malignancy[J]. Neurosurgery,2000,46(4):938-947.
[6] Håkansson L, Dalgleish A,Kallen KJ, et al. Vaccines: A rapidly evolving technology- Are the hurdles being addressed?[J]. Eur J Cancer Suppl,2007,5(9):29-32.
[7] 预防用生物制品临床前安全性评价技术审评一般原则.2005年12月,指导原则编号:[S]GPT2-1.
[8] 化学药物刺激性.过敏性和溶血性研究技术指导原则.2005年3月,指导原则编号:[H]GPT4-l.
[9] 朱剑萍,姚红伊,谢诒诚,等.艾蒿花粉诱导豚鼠过敏反应[J].中国病理生理杂志,2009,25(1):7-12.
[10]中药、天然药物刺激性和溶血性研究的技术指导原则.2005年3月,指导原则编号:[Z]GPT4-1.
[11]王 宏,朱中松,杨 琴,等. bFGF与VEGF抗原表位筛选及复合肽的表达鉴定[J].免疫学杂志,2010,26(8):688-693.
SecurityassessmentofcomplexpeptidevaccineVBP3foranti-tumorangiogenesisanalysisoflocalirritationandsystemicanaphylaxis
KANG Yan-li, WANG Hong, XIANG Jun-jian, WANG Pan-pan, LÜ Wei-dong, DENG Ning
(AntibodyEngineeringCenter,JinanUniversity,Guangzhou510632,China.E-mail:tdengn@jnu.edu.cn)
AIM: To evaluate the security of an anti-tumor angiogenesis complex peptide vaccine VBP3.METHODSThree rabbits were tested for local irritation by local subcutaneous injection of the vaccine with a self comparison method on the left/right sides of the same body. The test of systemic anaphylaxis was performed in 28 guinea pigs, in which the animals were divided into 4 groups: normal saline (NS) group, bovine serum albumin (BSA) group, low-dose vaccine group and high-dose vaccine group. The other 4 guinea pigs, 2
BSA and 2 received vaccine at a high dose, were activated directly without sensitization.RESULTSNo irritable and allergic reaction was observed in the test of all rabbits with local subcutaneous injection and most of the guinea pigs with systemic anaphylactic test. Only one guinea pig with slightly allergic response was found and spontaneously recovered soon.CONCLUSIONThe complex peptide vaccine VBP3 for anti-tumor angiogenesis is safe under the experimental conditions.
Vascular endothelial growth factors; Fibroblast growth factor 2; Complex peptide vaccine VBP3
R363
A
10.3969/j.issn.1000-4718.2011.01.022
1000-4718(2011)01-0113-06
2010-08-04
2010-11-22
广州市科技攻关资助项目(No.2006Z2-E4051);广东省生物工程药物重点实验开发基金资助项目(No.51206001)
△通讯作者 Tel:020-85227003; E-mail: tdengn@jnu.edu.cn
