异氟醚和七氟醚对新生大鼠皮质凋亡以及JNK和p38表达的不同影响*
2011-10-24李玉娟柳垂亮陈伟强曾敏婷
李玉娟, 柳垂亮, 张 静, 陈伟强, 曾敏婷
(1中山大学附属孙逸仙纪念医院麻醉科, 2广东省中医院麻醉科, 广东 广州 510120)
异氟醚和七氟醚对新生大鼠皮质凋亡以及JNK和p38表达的不同影响*
李玉娟1△, 柳垂亮2, 张 静1, 陈伟强1, 曾敏婷1
(1中山大学附属孙逸仙纪念医院麻醉科,2广东省中医院麻醉科, 广东 广州 510120)
目的研究同等剂量的异氟醚和七氟醚对新生大鼠皮质神经元凋亡的影响以及对JNK和p38蛋白表达的不同影响。方法55只出生后7 d(P7)的新生大鼠(共5窝,每窝取11只),随机均分为异氟醚组(Ⅰ组)、七氟醚组(S组)和对照组(C组),各组分别吸入1.1%异氟醚、1.8%七氟醚和空气4 h。在麻醉结束后2 h每窝每组各取1只幼鼠灌注取脑,免疫组织化学法检测皮质压部后区caspase-3表达(n=5);另外,每窝C组在麻醉处理0 h,Ⅰ组和S组分别在麻醉2 h、4 h取新鲜脑皮质,Western blotting检测磷酸化SAPK/JNK、磷酸化p38,以及SAPK/JNK、p38表达的变化(n=5)。结果Ⅰ组和S组caspase-3表达分别较对照组增加441%(P<0.01)和151%(P<0.01),Ⅰ组比S组增加115%(P<0.05);Ⅰ组磷酸化SAPK/JNK表达在麻醉2 h和4 h较对照组分别增加219%(P<0.05)和181%(P<0.05),S组在2 h和4 h均与对照组无显著差异;Ⅰ组磷酸化p38表达在麻醉2 h和4 h较对照组分别增加38.9%(P<0.05)和36.9%(P<0.05),S组在2 h和4 h较对照组分别增加32.6%(P<0.05)和128.0%(P<0.01)。结论0.5最低肺泡有效浓度(MAC)异氟醚比七氟醚诱导更多新生大鼠大脑皮质神经元凋亡,异氟醚诱导凋亡可能与激活SAPK/JNK磷酸化有关,而七氟醚诱导凋亡可能与激活p38磷酸化有关。
异氟醚; 七氟醚; 脑; 有丝分裂素激活蛋白激酶类
异氟醚和七氟醚均属于吸入麻醉药,常用于临床手术麻醉。它们对心肌缺血再灌注损伤具有保护作用[1],但近年来国内外有多篇文章报道异氟醚能诱导突触发育高峰期的动物脑神经元凋亡增加,以及成年期认知功能改变[2-7],引起对麻醉药物神经毒性作用的关注。我们前期体外实验研究发现七氟醚比异氟醚对神经元的毒性更小[8],因此假设七氟醚对新生幼鼠的神经毒性也比异氟醚低。
丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)信号通路在细胞生长分化以及细胞凋亡的调节中起着重要作用,MAPKs主要包括EKR1/2(extracellular signal-regulated kinase,)、SAPK/JNK(stress-activated protein kinases/c-Jun NH2-terminal kinases)和p38 MAPK 3个主要的亚家族。正常情况下,ERK、JNK和p38可促分化,而在应激状态下,ERK起抗凋亡作用,JNK和p38则起促凋亡作用。缺血、缺氧、炎症反应等各种刺激均可引起MAPKs的磷酸化状态改变。许多研究证实JNK和p38通路激活在脑、心脏等的缺血再灌注的病理损伤起着重要作用[9,10]。
异氟醚和七氟醚如果对新生大鼠神经毒性存在差异,这种差异是否与JNK和p38的通路的不同激活有关?本研究拟采用给新生大鼠吸入1.1%异氟醚或1.8%七氟醚[相当于0.5最低肺泡有效浓度(minimum alveolar concentration,MAC)]4 h的实验模型,通过对鼠脑皮质凋亡和磷酸化SAPK/JNK、p38蛋白表达变化的检测来研究异氟醚和七氟醚对P7新生大鼠脑发育影响的差异,并初步探讨其机制。
材 料 和 方 法
1材料
1.1仪器与试剂 Detax麻醉气体检测仪(欧米达公司),Olympus IX70 倒置显微镜 (奥林巴斯公司),血糖仪(拜尔公司),i-STAT血气分析仪(雅培有限公司);异氟醚(雅培有限公司),七氟醚(百特医疗用品有限公司)。兔抗大鼠磷酸化SAPK/JNK多克隆抗体、兔抗大鼠SAPK/JNK多克隆抗体(Cell Signaling);小鼠抗大鼠磷酸化p38单克隆抗体、小鼠抗大鼠磷酸化p38单克隆抗体、β-actin单克隆抗体(碧云天生物技术公司)。羊抗兔Ⅱ抗、羊抗小鼠Ⅱ抗(武汉博士德公司)。
1.2动物及分组 55只出生后7 d(P7)的新生大鼠(总共5窝,每窝取11只,由广东省动物中心提供),随机分为异氟醚组(Ⅰ组)、七氟醚组(S组)和对照组(C组)。在麻醉4 h时每窝每组各取1只幼鼠经心脏穿刺抽血,检测血糖和血气(n=5)。麻醉结束后2 h每窝每组各取1只进心脏灌注,取脑组织制作石蜡切片,免疫组织化学法检测皮质caspase-3表达(n=5);另外,每窝C组在麻醉0 h、Ⅰ组和S组分别在麻醉2 h和4 h取新鲜脑皮质,Western blotting检测磷酸化SAPK/JNK和磷酸化p38,以及SAPK/JNK和p38表达的变化(n=5)。
2方法
2.1麻醉处理 将新生大鼠放置于密闭麻醉箱中,该麻醉箱放置于预设温度为35 ℃的水浴箱中。麻醉箱与麻醉机相连,Ⅰ组使用1.1%异氟醚处理4 h,S组使用1.8%七氟醚处理4 h,麻醉气体通过麻醉机的挥发罐由压缩空气输送通过该麻醉箱。幼鼠呼气末麻醉气体的浓度、氧气和二氧化碳浓度由连接于麻醉箱的麻醉气体监测仪监测。C组暴露于空气中4 h。
2.2生理指标监测 在麻醉过程中每隔30 min监测幼鼠肤色,记录呼吸频率,在麻醉4 h时每窝每组各取1只幼鼠经左心室心脏穿刺抽血行血气分析和血糖检测(n=5)。
2.3组织准备 每窝C组在麻醉处理0 h、Ⅰ组和S组分别在麻醉2 h和4 h取1只幼鼠,断头取脑,冰上分离脑皮质,液氮速冻后转移至-80 ℃保存,组织用来做Western blotting分析。在麻醉结束后2 h每窝每组各取1只幼鼠,经心脏灌注4%多聚甲醛固定液15 min后取脑。脑组织在同样的灌注液中4 ℃后固定48 h后梯度脱水,石蜡包埋,经冠状平面切取5 μm连续石蜡切片,参照幼鼠脑解剖图谱,每只幼鼠选择3个相同的海马平面的切片进行免疫组化染色。
2.4免疫组化法检测细胞凋亡 组织切片通过梯度乙醇脱蜡、水化、抗原修复,3% H2O2室温孵育5 min以去除内源性过氧化物酶活性。10%正常羊血清封闭液室温封闭1 h,1∶100 caspase-3抗体4 ℃孵育过夜,羊抗兔Ⅱ抗(1∶200,武汉博士德公司)室温孵育1 h,DAB显色,苏木素反染。使用IP lab 7.0和 Olympus IX70 倒置显微镜获得大脑皮质压部后区(retrosplonial cortex,RS)200倍图像,2个人分别计数caspase-3阳性细胞数,并计算单位面积的阳性细胞数的均值。
2.5Western blotting法检测MAPK通路 新鲜冰冻的脑皮质匀浆后提取蛋白,根据其蛋白浓度(BAC法测定),各样本等量蛋白10%SDS-DEPG电泳,转膜,1∶500兔抗大鼠磷酸化SAPK/JNK多克隆抗体,1∶500兔抗大鼠磷酸化p38单克隆抗体,1∶1 000兔抗大鼠SAPK/JNK多克隆抗体以及1∶1 000兔抗大鼠p38多克隆抗体4 ℃孵育过夜,1∶1 000Ⅱ抗室温孵育2 h,使用ECL(Amersham公司)进行胶片显影。
3统计学处理
结 果
1生理指标检测
Ⅰ组和S组幼鼠在麻醉处理过程中呼吸均匀,肤色红润,脉搏血氧饱和度(SPO2)均>95%,无1例出现呼吸抑制。各组pH值均在正常范围无显著差异(C组:7.39±0.55;Ⅰ组:7.37±0.89;S组:7.38±0.78)。各组均无低血糖发生,C组为(4.56±0.53) mmol/L,Ⅰ组为(8.08±0.76) mmol/L,S组为(5.46±0.33) mmol/L。3组间血糖差异显著(P<0.01)。Ⅰ组比C组和S组血糖明显增加(均P<0.01),S组与C组血糖差异无显著。
2大脑皮质caspase-3表达的变化
免疫组化染色显示3组大脑皮质压部后区caspase-3阳性表达有明显差异,见图1A。C组RS区单位面积的caspase-3阳性染色细胞数为(5.92±1.05)个/mm2,Ⅰ组为(32.02 ±6.74)个/mm2和S组为(14.89±2.28)个/mm2。Ⅰ组和S组caspase-3表达分别较C组增加441%(P<0.01)和151%(P<0.01),Ⅰ组比S组增加115%(P<0.05),见图1B。

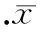
图1新生鼠脑皮质压部后区caspase-3表达的免疫组化结果
3磷酸化SAPK/JNK表达的变化
Ⅰ组磷酸化SAPK/JNK在麻醉2 h和4 h分别较对照组增加了219%(P<0.05)和181%(P<0.05),S组磷酸化SAPK/JNK在麻醉2 h和4 h与对照组无显著差异,而且Ⅰ组4 h比S组4 h增加了41.5%(P<0.05),见图2。提示SAPK/JNK通路在异氟醚麻醉的早期就已经激活,而七氟醚可能没有激活该通路。
4磷酸化p38表达的变化
Ⅰ组磷酸化p38表达在麻醉2 h和4 h较对照组增加38.9%(P<0.05)和36.9%(P<0.05),S组在2 h和4 h较对照组增加32.6%(P<0.05)和128.0%(P<0.01),S组4 h较2 h增加72.3%(P<0.05),S组4 h较Ⅰ组4 h增加66.8%(P<0.05),见图3。提示异氟醚轻度激活p38通路,而七氟醚在麻醉2 h轻度激活p38通路,4 h能显著激活该通路。
讨 论
在各种诱导的神经退行性改变的模型中,神经细胞凋亡被认为是细胞损伤的潜在机制。目前已有多篇研究报道吸入麻醉药异氟醚可以引起脑突触发育高峰期的动物神经元凋亡[2-7]。Jevtovic等[2]报道0.75%异氟醚6 h可诱导P7新生大鼠脑区出现神经元凋亡,与咪唑安定和氧化亚氮联合使用凋亡程度更大,并且会导致成年期学习记忆功能减退。单独使用异氟醚麻醉P7新生鼠0.75%4 h、1.50%2 h和2.00%1 h,均可诱导鼠脑出现广泛凋亡[5],而异氟醚不会增加新生鼠神经元凋亡的最高浓度为0.55%[6]。有关豚鼠的研究也发现0.55%异氟醚麻醉4 h就诱导caspase-3增加3至6倍[7]。作为目前临床广泛使用的吸入麻醉药七氟醚是否也具有同样的神经毒性,与MAPK通路中的蛋白改变是否有关系是本研究关注的重点。
我们前期研究使用PC12细胞和原代培养的皮质神经元模型已经证明异氟醚比七氟醚的毒性更大,诱导更多的caspase-3和caspase-9表达[8],因此本研究拟在整体动物实验中进一步证实同等剂量的七氟醚比异氟醚诱导更小程度的细胞凋亡。本研究的实验模型是选用1.1%异氟醚或1.8%七氟醚麻醉P7新生大鼠4 h。脑突触发育的高峰期在啮齿类为出生后2周[11],人类为妊娠晚期至出生后3岁。本研究选择P7的新生大鼠作为研究对象,脑发育阶段相当于人类成熟的新生儿期。根据Orliaguet等[12]的研究,P9新生大鼠的MAC浓度异氟醚为2.34%,七氟醚为3.74%。本研究选用P7新生大鼠与P9新生大鼠年龄接近,因此推断本研究中1.1%异氟醚和1.8%七氟醚的麻醉深度相当于0.5MAC。而Liang等[13]认为0.75%的异氟醚和1.1%的七氟醚相当于0.5MAC,主要是他们使用的动物为小鼠,参考文献及标准不一致所致。在预试验中我们使用1.5%异氟醚麻醉新生大鼠1 h,新生鼠出现明显的呼吸抑制,而1.1%异氟醚和1.8%七氟醚麻醉新生幼鼠4 h,新生鼠没有出现呼吸抑制,血气检测在正常范围内,各组均无低血糖发生,而且异氟醚组的血糖高于其它2组。因此,本研究使用该麻醉剂量作为研究,排除了呼吸抑制、低血糖等生理性干扰对细胞凋亡和蛋白表达结果的影响。
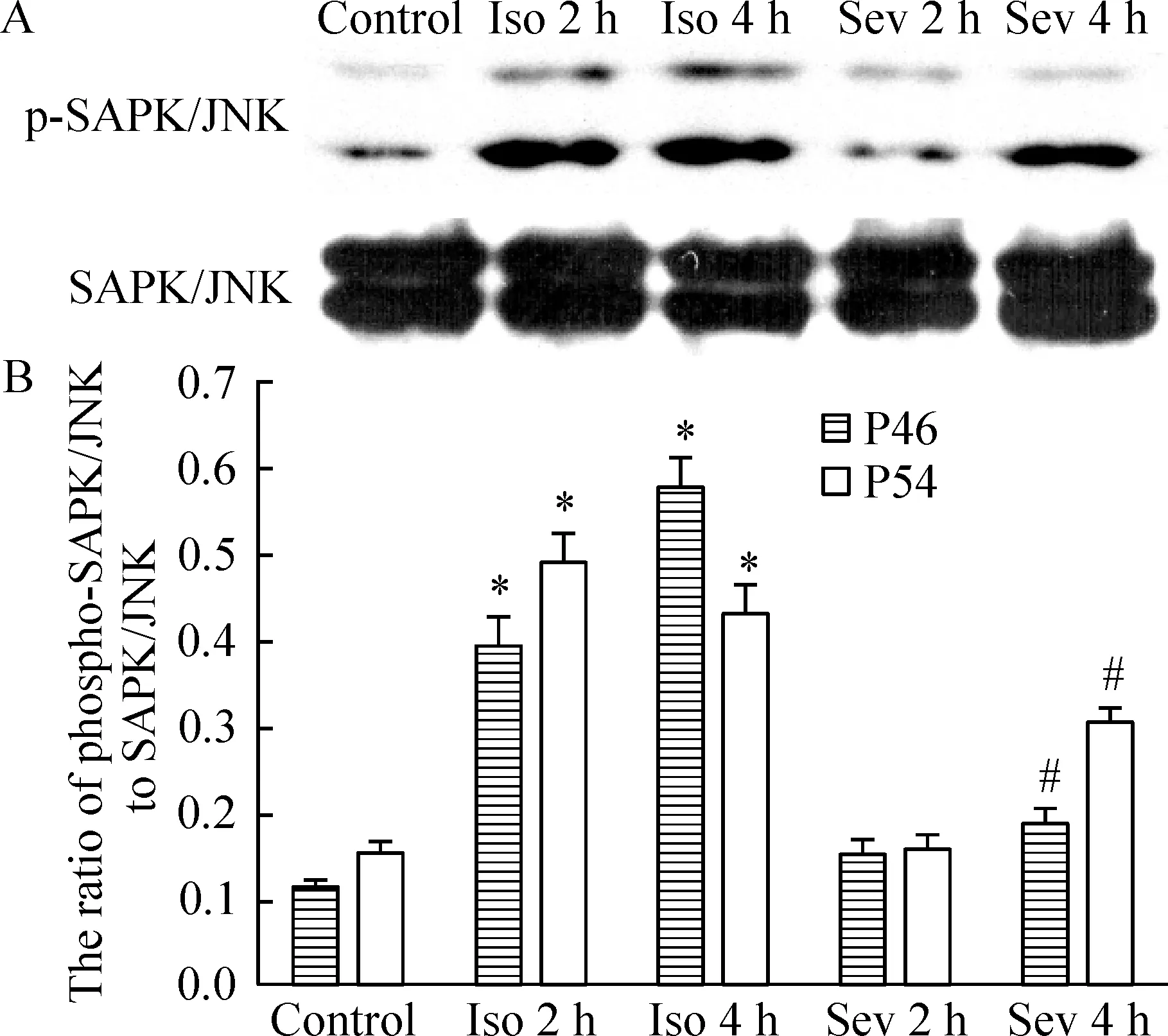

图2Westernblotting检测0.5MAC异氟醚和七氟醚麻醉新生大鼠2h和4h磷酸化SAPK/JNK的变化

图3Westernblotting分析0.5MAC异氟醚和七氟醚麻醉新生大鼠2h和4h磷酸化p38的变化
本研究的结果发现0.5 MAC七氟醚诱导新生鼠脑皮质RS区caspase-3的表达明显少于异氟醚组,七氟醚组比对照组增加1.5倍,而异氟醚组比对照组增加4.4倍。这与最近Liang等[13]研究的结果一致,他们使用1.1%七氟醚和0.75%异氟醚麻醉P7新生小鼠6 h,也发现七氟醚诱导海马神经元凋亡的程度比异氟醚要小,但是2种药物都不会影响大鼠青少年期的空间学习能力。本研究检测到的单位面积细胞凋亡数目比他们报道的少,这主要是由于检测的脑区不同所致,Li等[14]研究的为海马CA1区神经细胞,而本研究选择的是皮质RS区神经元。我们前期研究也发现单位面积海马神经元的凋亡数目比皮质RS区要多近10倍。但两项研究结果中异氟醚和七氟醚对神经元凋亡影响的趋势是一致的。Zhang等[15]研究发现1.7%七氟醚麻醉2 h可诱导P5-P7的C57BL/6小鼠脑皮质神经元caspase-3表达增加4倍,大于本研究中七氟醚增加的幅度,主要与检测的时点选择不同有关。他们选择麻醉后12 h,此时为caspase-3阳性表达高峰期。而Bercker等[16]使用3-5%七氟醚麻醉P6 d的Wister新生大鼠6 h,caspase-3表达与对照组无明显差异,可能是他们选择24 h后检测已经难以检测到caspase-3阳性的细胞。
异氟醚和七氟醚诱导神经元凋亡的机制目前研究尚未完全明确。有研究证实异氟醚与咪唑安定和氧化亚氮联合使用通过激活BDNF神经元凋亡通路[4]而激活内源性线粒体通路,4 h后也激活外源性通路诱导凋亡[3]。我们前期细胞研究发现异氟醚能通过激活内质网IP3受体比七氟醚诱导更高的细胞浆钙离子浓度[17],而且异氟醚显著降低Bcl-2/Bax比值[8]。而这两种吸入麻醉药诱导发育期神经细胞凋亡与MAPKs信号通路的关系尚未见报道。本研究在整体动物实验中发现异氟醚在麻醉早期就显著增加磷酸化SAPK/JNK表达2倍多,并持续至麻醉4 h,而对磷酸化p38也有激活,但增加幅度不大,提示异氟醚诱导神经元凋亡可能激活SAPK/JNK和p38这两条通路有关,但激活SAPK/JNK更明显。而七氟醚对磷酸化SAPK/JNK影响不大,而在麻醉4 h显著增加磷酸化p38表达超过1倍,提示七氟醚诱导神经元凋亡可能与激活p38通路有关。由于诱导凋亡的信号通路有许多,是否这两条通路激活肯定参与了异氟醚和七氟醚诱导的神经元凋亡,尚不能完全定论。如果确实相关,异氟醚对神经毒性的诱导过程SAPK/JNK和p38哪一条通路的激活更重要,下游的哪些信号蛋白被激活,这些都需要进一步实验证明。
总之,本研究通过给P7新生大鼠吸入同等剂量(0.5MAC)的异氟醚和七氟醚4 h,发现异氟醚比七氟醚均可以增加脑皮质神经元凋亡,而异氟醚增加神经元凋亡的程度比七氟醚更显著。异氟醚诱导凋亡可能主要与激活SAPK/JNK磷酸化有关,而七氟醚诱导凋亡可能与激活p38磷酸化有关。
本研究也存在一定的局限性,没有同时使用SAPK/JNK和p38的拮抗剂来进一步证实异氟醚和七氟醚诱导的神经元凋亡与这两条通路的激活相关性,没有研究caspase-3激活与这两条通路的因果关系,缺乏行为学实验的结果来评价这两种药物的长期影响,在后续的研究中将继续完善。总之,本研究结果证明0.5 MAC异氟醚比七氟醚诱导P7新生大鼠更严重的神经元凋亡,可能与它们不同地激活SAPK/JNK和p38磷酸化有关。研究提示七氟醚的神经毒性作用小于异氟醚,在婴幼儿和小儿手术中使用可能更加安全。
[1] 李 恒, 杨承祥, 孙 凯,等. 挥发性麻醉药对大鼠离体心脏缺血再灌注损伤的影响[J].中国病理生理杂志, 2007,23(10):1891-1895.
[2] Jevtovic-Todorovic V, Hartman RE, Izumi Y, et al. Early exposure to common anesthetic agents causes widespread neurodegeneration in the developing rat brain and persistent learning deficits[J]. J Neurosci, 2003, 23(3):876-882.
[3] Yon JH, Daniel-Johnson J, Carter LB, et al. Anesthesia induces neuronal cell death in the developing rat brain via the intrinsic and extrinsic apoptotic pathways[J]. Neuroscience, 2005, 135(3):815-827.
[4] Lu LX, Yon JH, Carter LB, et al. General anesthesia activates BDNF-dependent neuroapoptosis in the developing rat brain[J]. Apoptosis, 2006, 11(9):1603-1615.
[5] Johnson SA, Young C, Olney JW. Isoflurane-induced neuroapoptosis in the developing brain of nonhypoglycemic mice[J]. J Nuerosurg Anesthesiol, 2008, 20(1):21-28.
[6] Zou X, Sadovova N, Patterson TA, et al. The effects of L-carnitine on the combination of inhalation anesthetic-induced developmental neuronal apoptosis in the rat frontal cortex[J]. Neuroscience, 2008, 151(4):1053-1065.
[7] Rizzi S, Carter LB, Ori C, et al. Clinical anesthesia causes permanent damage to the fetal guinea pig brain[J]. Brain Pathol, 2008, 18(2):198-210.
[8] Wei H, Kang B, Wei W, et al.Isoflurane and sevoflurane affect cell survival and Bcl-2/Bax ratio differently[J]. Brain Res, 2005, 1037(1-2):139-147.
[9] Liu AL, Wang XW, Liu AH, et al. JNK and p38 were involved in hypoxia and reoxygenation-induced apoptosis of cultured rat cerebellar granule neurons[J].Exp Toxicol Pathol, 2009,61(2):137-143.
[10]张秀娥,成 蓓,彭 雯,等.p38MAPK信号通路在钙调磷酸酶促心肌细胞凋亡中的作用[J].中国病理生理杂志,2008,24(2):266-269.
[11]Dobbing J, Sands J. Comparative aspects of the brain growth spurt[J]. Early Hum Dev, 1979, 3(1):79-83.
[12]Orliaguet G, Vivien B, Langeron O,et al. Minimum alveolar concentration of volatile anesthetics in rats during postnatal maturation[J]. Anesthesiology, 2001, 95(3):734-739.
[13]Liang G, Ward C, Peng J, et al. Isoflurane causes greater neurodegeneration than an equivalent exposure of sevoflurane in the developing brain of neonatal mice[J].Anesthesiology, 2010, 112(6):1325-1334.
[14]Li Y, Liang G,Wang S, et al. Effects of fetal exposure to isoflurane on postnatal learning and memory in rats[J]. Neuropharmocology, 2007,53(8): 942-950.
[15]Zhang X, Xue Z, Sun A. Subclinical concentration of sevoflurane potentiates neuronal apoptosis in the developing C57BL/6 mouse brain[J].Neurosci Lett, 2008, 447(2-3):109-114.
[16]Bercker S, Bert B, Bittigau P, et al. Neurodegeneration in newborn rats following propofol and sevoflurane anesthesia[J]. Neurotox Res, 2009, 16(2):140-147.
[17]Liang G, Wang Q, Li Y, et al. A presenilin-1 mutation renders neurons vulnerable to isoflurane toxicity[J]. Anesth Analg, 2008, 106(2):492-500.
EffectsofisofluraneandsevofluraneonapoptosisofcorticalneuroninneonatalratsandtheroleofMAPKspathway
LI Yu-juan1, LIU Chui-liang2, ZHANG Jing1, CHEN Wei-qiang1, ZENG Min-ting1
(1DepartmentofAnesthesiology,TheSunYat-senHospitalofSunYat-senUniversity,2DepartmentofAnesthesiology,TCMHospitalofGuangdongProvince,Guangzhou510120,China.E-mail:yujuan_04@yahoo.com.cn)
AIM: To investigate the effects of isoflurane and sevoflurane at the same dose on apoptosis of cortical neuron in neonatal rats and the role of mitogen-activated protein kinases (MAPKs) pathway.METHODSEleven neonatal rats were selected at postnatal day 7 from 1 litter (altogether 5 litters) and assigned randomly into control group (C group), isoflurane group (Ⅰ group) and sevoflurane group (S group). The rats in Ⅰ group, S group or C group were exposed to 1.1% isoflurane, 1.8% sevoflurane[ (equivalent to 0.5 minimum alveolar concentration(MAC)] and room air for 4 h, respectively. The brain of neonatal rats were perfused and embedded by paraffin. Caspase-3 positive expression in the retrosplenial cortex (RS) of the brain was observed by immunohistochemical staining. Meanwhile, the fresh cortex was separated at 0 h in C group and at 2 h and 4 h in Ⅰ group and S group. The levels of phospho-SAPK/JNK and SAPK/JNK, phospho-p38 and p38 in fresh cortex were detected by Western blotting.RESULTSCaspase-3 positive cells in the the cortex were increased by 441% in Ⅰ group (P<0.01) and 151% in S group (P<0.01) as compared to C group, and increased by 115% in Ⅰ group (P<0.05) as compared to S group. The protein levels of phospho-SAPK/JNK in the cortex were increased by 219% at 2 h (P<0.05) and 181% at 4 h (P<0.05) in Ⅰ group, while no significant difference between S group and C group was observed. The phospho-p38 protein in the cortex was increased by 38.9% at 2 h (P<0.05) and 36.9% at 4 h (P<0.05) in Ⅰ group, and increased by 32.6% (P<0.05) at 2 h and 128.0% at 4 h (P<0.01) in S group as compared to C group.CONCLUSIONIsoflurane induces more apoptotic neurons in the cortex of the brain in neonatal rats at postnatal day 7 than sevoflurane. Isoflurane induces apoptosis mainly by activating SAPK/JNK phosphorylation, while sevoflurane induces aopotosis by activating p38 phosphorylation.
Isoflurane; Sevoflurane; Brain; Mitogen-activated protein kinases
R729
A
10.3969/j.issn.1000-4718.2011.01.014
1000-4718(2011)01-0072-05
2010-08-02
2010-10-16
国家自然科学基金资助项目(No. 30700787);广东省自然科学基金资助项目(No.8151040701000062)
△通讯作者 Tel:020-81332060; E-mail: yujuan_04 @yahoo.com.cn
