异氟醚抑制Notch-1通路诱导小鼠神经干细胞凋亡
2015-03-07侯冷晨林福清傅舒昆冯娅刘特
侯冷晨 林福清 傅舒昆 冯娅 刘特,3
(1.同济大学附属第十人民医院麻醉科,上海 200072;
2.上海交通大学医学院附属第一人民医院神经内科,上海 200080;
3.上海中医药大学上海市中医老年医学研究所,上海 200031)
·
异氟醚抑制Notch-1通路诱导小鼠神经干细胞凋亡
侯冷晨1林福清1傅舒昆1冯娅2刘特1,3
(1.同济大学附属第十人民医院麻醉科,上海200072;
2.上海交通大学医学院附属第一人民医院神经内科,上海200080;
3.上海中医药大学上海市中医老年医学研究所,上海200031)
摘要目的:探讨异氟醚对小鼠神经干细胞的影响及其可能的机制。方法: 分离小鼠神经干细胞并培养,分为对照组、磷酸盐缓冲液(PBS)组和异氟醚组。对照组无任何干预,异氟醚组给予异氟醚,PBS组给予等量的PBS,培养24 h。采用CCK-8法检测细胞增殖率;实时定量-聚合酶链反应法检测凋亡相关基因的mRNA水平;蛋白质印迹法检测凋亡相关蛋白的表达;Annexin V-FITC/PI法检测细胞凋亡。结果:与对照组和PBS组比较,异氟醚组细胞增殖率明显降低,同时Notch-1、CBF-1、Hes-1基因的mRNA及相应蛋白表达水平也显著下降。异氟醚组细胞凋亡数目与对照组、PBS组比较,差异有统计学意义。结论:异氟醚能够诱导小鼠神经干细胞的凋亡,此作用与Notch-1信号通路的抑制密切相关。
关键词异氟醚;神经干细胞;Notch-1通路;细胞凋亡
基本项目:国家自然科学基金资助项目(编号:81202811);中国博士后科研基金资助项目(编号:2014M550250)
神经干细胞(neural stem cells,NSCs)最初是在1992年从人室管膜下层细胞中分离出来并被人们所认识的[1]。NSCs不仅可以用来研究神经系统发育的分子机制,也可作为一种替代手段治疗神经变性性疾病、缺血再灌注损伤等[2]。然而,脑NSCs移植中常出现麻醉药诱导的NSCs损伤。组织培养研究[3]也证实,长期吸入麻醉药物会诱导细胞凋亡。因此,研究麻醉药物对NSCs的影响具有重要的临床意义。
研究[4]发现,在啮齿类动物和非人类的灵长类动物中,延长全身麻醉药暴露能够诱导广泛的神经元凋亡,导致时程记忆及学习能力下降。异氟醚因具有诱导麻醉迅速及麻醉苏醒快的特点,被广泛应用于临床手术中[5]。然而,有研究[6]发现,异氟醚能够影响人类NSCs分化及神经形成;此外,异氟醚能够诱导幼鼠神经变性[7]。Notch-1信号通路与细胞增殖密切相关,且能通过与转录调节因子相互作用显著影响细胞的最终结局[8-9]。本研究探讨了异氟醚对小鼠NSCs的影响以及该作用与Notch-1信号通路的关系。
1资料与方法
1.1材料小鼠NSCs(中国科学院干细胞库),异氟醚、胎牛血清、NSCs培养基、胰酶、Annexin V-FITC/PI试剂盒、CCK-8试剂盒、实时定量-聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测试剂盒、蛋白质印迹(Western blotting)检测试剂盒、Trizol、氯仿、异丙醇、75%乙醇购自上海瑞鹿生物科技有限公司,抗Notch-1抗体、抗Hes-1抗体、抗CBF-1抗体购自美国Santa Cruz Technology公司。
1.2方法
1.2.1小鼠NSCs的分离与培养将怀孕小鼠通过颈椎脱臼处死后,无菌条件下取出脑组织并置于75%乙醇中浸泡2 min。显微镜下分离脑膜,用磷酸盐缓冲液(phosphate-buffered saline,PBS)洗3次后剪碎,加入0.05%胰酶并消化15 min,用吸管反复吹打为单细胞悬液,然后加入2倍体积的DMEM/F12培养基(含10%胎牛血清)终止消化,用200目不锈钢筛网过滤,收集的滤液以1000 r/min离心5 min,弃上清。以含N2(终质量浓度为10 ng/mL)、碱性成纤维因子(终质量浓度为20 ng/mL)的DMEM/F12重悬细胞,接种于培养瓶,置于37 ℃、体积分数为5% CO2的培养箱中培养。
1.2.2CCK-8法检测细胞增殖率将NSCs接种于96孔板,按照异氟醚组、PBS组和对照组分组培养。对照组不给予任何干预,异氟醚组和PBS组分别给予异氟醚(0、0.125、0.25、0.5 mmol/L)和等体积的PBS处理24 h。每孔加入10 μL CCK-8试剂,在细胞培养箱中继续孵育1 h。然后用酶标仪检测细胞在450 nm波长处的吸光度。吸光度值越大表明细胞的增殖能力越强。
1.2.3Annexin V-FITC/PI法检测细胞凋亡将NSCs接种于24孔板,按照异氟醚组、PBS组和对照组分组培养。对照组不给予任何干预,异氟醚组和PBS组分别给予异氟醚(0.25 mmol/L)和等体积的PBS处理24 h。吸除细胞培养基,每孔加入195 μL Annexin V-FITC结合液,再加入5 μL Annexin V-FITC,轻轻混匀,室温避光孵育10 min;弃培养基,每孔加入190 μL Annexin V-FITC结合液,再加入10 μL碘化丙啶(propidium iodide,PI)染色液,轻轻混匀,冰浴避光孵育1 min;随即在荧光显微镜下观察,Annexin V-FITC染色为绿色荧光,PI染色为红色。
1.2.4qRT-PCR法检测凋亡相关基因的mRNA水平将NSCs接种于6孔板,按照异氟醚组、PBS组和对照组分组培养。对照组不给予任何干预,异氟醚组和PBS组分别给予异氟醚(0.25 mmol/L)和等体积的PBS处理24 h。收集细胞于1.5 mL离心管中,用Trizol抽提细胞RNA,然后按照反转录试剂盒说明书逆转录合成cDNA。按照qRT-PCR试剂盒说明书进行PCR。采用ΔΔCt法计算目的基因的表达,其中ΔCt=目的基因Ct-18s rRNACt,ΔΔCt=实验组ΔCt-对照组ΔCt。
1.2.5Western blotting法检测凋亡相关蛋白的表达将NSCs接种于6 cm培养皿,按照异氟醚组、PBS组和对照组分组培养。对照组不给予任何干预,异氟醚组和PBS组分别给予异氟醚(0.25 mmol/L)或等体积的PBS处理24 h。收集细胞于1.5 mL离心管中。每管加入Western及IP细胞裂解液200 μL,冰浴裂解10 min。采用BCA法检测蛋白浓度,并调整至一致。然后进行十二烷基硫酸钠-聚丙烯酰胺凝胶(10%浓度)电泳,转移至聚偏氟乙烯膜上,室温封闭1 h,加入抗Notch-1抗体、抗CBF-1抗体、抗Hes-1抗体,浓度均为1∶1000,置于4 ℃冰箱过夜;第2天用0.05% TBST洗膜3次,每次5 min;加入相应的二抗(浓度为1∶1000),37 ℃孵育45 min;0.05% TBST洗膜3次,每次5 min;加入ECL发光试剂,X线片曝光,显影、定影,观察结果。
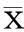
2结果
2.1CCK-8法检测细胞增殖率与对照组及PBS组比较,异氟醚组异氟醚浓度在0.25、0.50 mmol/L时细胞增殖率明显降低(P<0.05)。见图1。
2.2Annexin V-FITC/PI法检测细胞凋亡情况荧光显微镜下可见,异氟醚组细胞体积变小,与周围细胞脱离;异氟醚组FITC阳性(绿色,表示细胞凋亡)细胞数较PBS组及对照组明显增多(P<0.05),PI阳性(红色,表示细胞坏死)细胞数与PBS组及对照组差异无统计学意义。见图2。
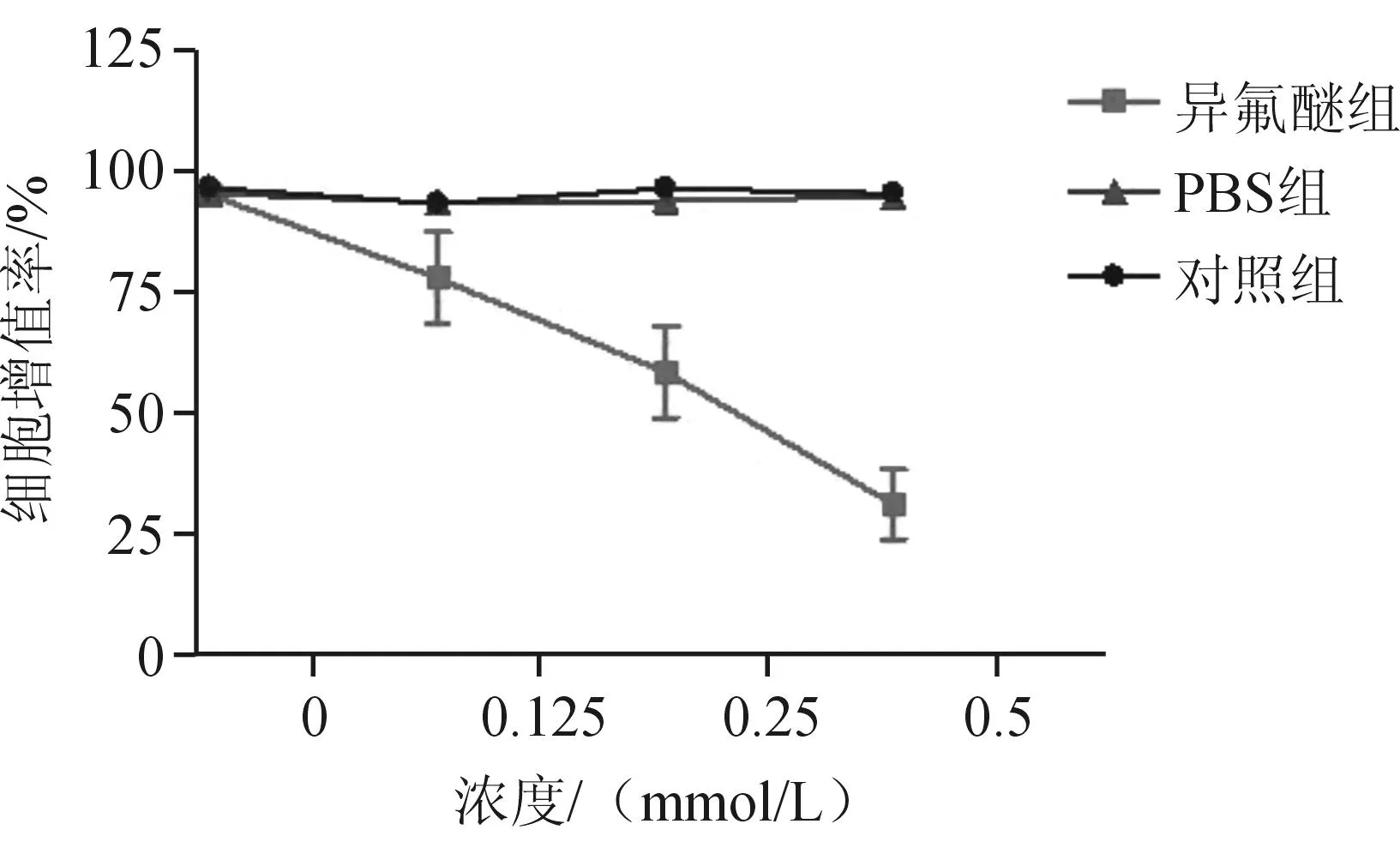
图1 不同浓度异氟醚对NSCs增殖的影响
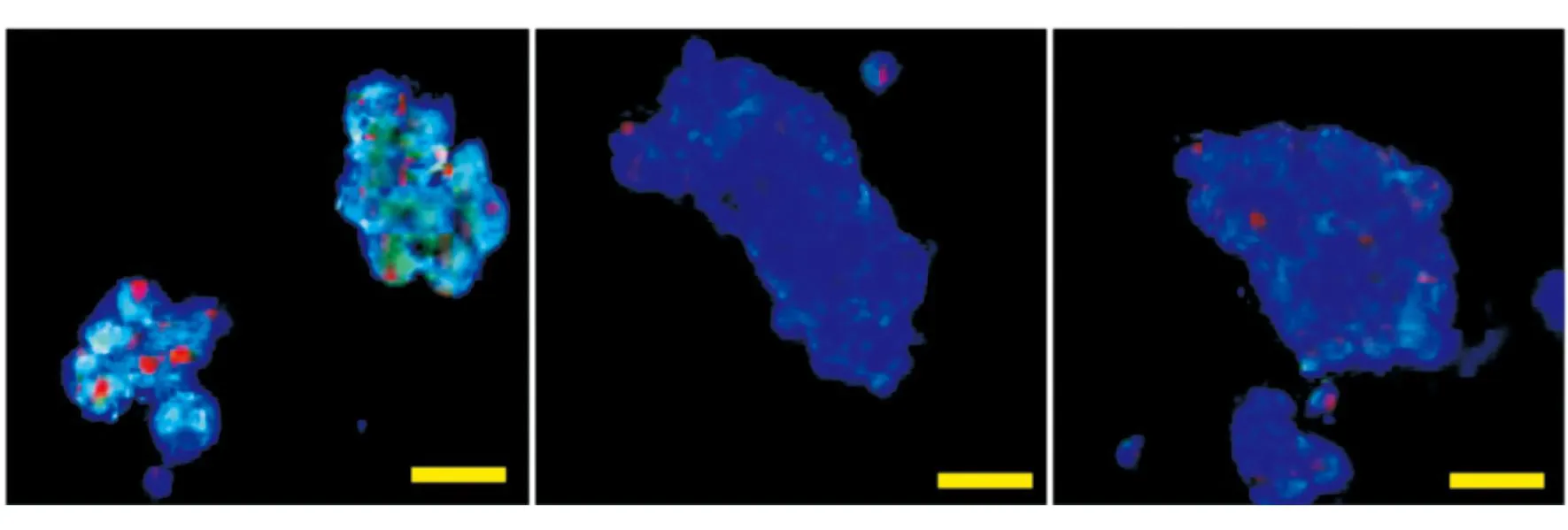
2.3Notch-1信号通路在异氟醚诱导NSCs中的作用qRT-PCR结果显示,异氟醚组Notch-1、CBF-1和Hes-1基因的mRNA水平较PBS组及对照组明显下降(P<0.05),见图3。Western blotting结果显示,异氟醚组Notch-1、CBF-1及Hes-1蛋白的表达水平也明显低于PBS组及对照组(P<0.05),见图4。
A:异氟醚组;B:PBS组;C:对照组
图3 qRT-PCR法检测异氟醚处理小鼠NSCs后Notch-1
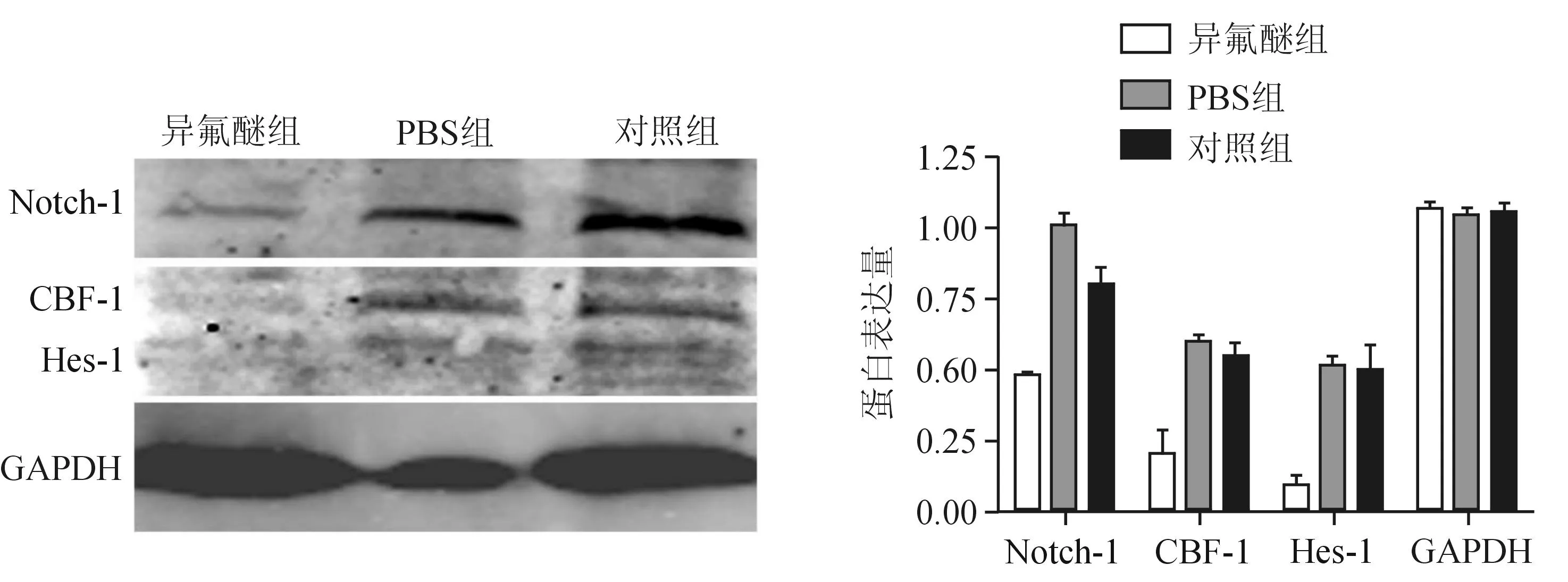
图4 Western blotting法检测异氟醚处理小鼠NSCs后Notch-1信号通路中Notch-1、CBF-1及
3讨论
异氟醚是一种常用麻醉药,已广泛应用于各种外科手术,异氟醚预处理能够有效提高围手术期患者大脑的缺血耐受能力[10]。然而,其对神经细胞具有神经保护作用还是神经毒性作用,至今仍无定论。最近的一项研究[11]表明,在神经前体细胞中,高浓度的异氟醚能够诱导细胞毒性作用,而在低浓度时则可以保护神经细胞。本研究结果发现,用0.25、0.50 mmol/L浓度的异氟醚处理24 h后能明显抑制NSCs的增殖;Annexin V-FITC/PI结果则提示,异氟醚能够诱导NSCs的凋亡,介导神经毒性作用。
在中枢神经系统,Notch信号通路与细胞成熟、再生以及神经前体细胞的成熟密切相关,该通路在神经系统功能动态变化的整个过程中具有重要作用[12]。激活后的Notch-1配体与受体相结合可以导致Notch-1蛋白胞内域向细胞核的转位,然后通过与CBF-1等蛋白组成复合物而激活下游靶基因如Hes-1和HEY等的转录,从而影响细胞的增殖[13]。有研究[14]报道,异氟醚能够诱导内质网应激并激活caspase,异氟醚介导的神经毒性作用在阿尔茨海默病的发病中扮演重要的角色。此外,Olney等[15]研究则发现异氟醚等麻醉药诱导的神经毒性作用是通过增加线粒体通透性进而引起细胞色素C释放介导的。为了进一步探讨Notch-1信号通路在介导异氟醚引起的NSCs凋亡中的机制,本研究检测了Notch-1信号通路中相关基因表达水平的变化,结果显示,0.25 mmol/L异氟醚处理细胞24 h后,Notch-1、Hes-1及CBF-1基因的mRNA水平较对照组和PBS组明显降低,说明异氟醚对Notch-1信号通路具有抑制作用。Western blotting结果发现,异氟醚对Notch-1、Hes-1及CBF-1蛋白的表达也具有抑制作用。以上证实,异氟醚诱导小鼠NSCs凋亡的作用至少部分是由抑制Notch-1信号通路介导的。
综上所述,本研究证实了异氟醚处理细胞24 h对小鼠NSCs有毒性作用,此作用与抑制Notch-1信号通路有关。然而,异氟醚抑制Notch-1信号通路的具体机制仍需更深入的研究。
参考文献
[1]Reynolds BA,Weiss S.Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system[J].Science,1992,255(5052):1707-1710.
[2]Franchi S,Castelli M,Amodeo G,et al.Adult stem cell as new advanced therapy for experimental neuropathic pain treatment[J].Biomed Res Int,2014,2014:470983.
[3]Zou X,Sadovova N,Patterson TA,et al.The effects of L-carnitine on the combination of,inhalation anesthetic-induced developmental,neuronal apoptosis in the rat frontal cortex[J].Neuroscience,2008,151(4):1053-1065.
[4]Bai X,Twaroski D,Bosnjak ZJ.Modeling anesthetic developmental neurotoxicity using human stem cells[J].Semi Cardiothorac Vasc Anesth,2013,17(4):276-287.
[5]Cederholm JM,Froud KE,Wong AC,et al.Differential actions of isoflurane and ketamine-based anaesthetics on cochlear function in the mouse[J].Hear Res,2012,292(1-2):71-79.
[6]Fredriksson A,Pontén E,Gordh T,et al.Neonatal exposure to a combination of N-methyl-D-aspartate and gamma-aminobutyric acid type A receptor anesthetic agents potentiates apoptotic neurodegeneration and persistent behavioral deficits[J].Anesthesiology,2007,107(3):427-436.
[7]Stratmann G,Sall JW,May LD,et al.Isoflurane differentially affects neurogenesis and long-term neurocognitive function in 60-day-old and 7-day-old rats[J].Anesthesiology,2009,110(4):834-848.
[8]Ahmed MM,Dhanasekaran AR,Block A,et al.Protein profiles associated with context fear conditioning and their modulation by memantine[J].Mol Cell Proteomics,2014,13(4):919-937.
[9]Liao YF,Tang YC,Chang MY,et al.Discovery of small molecular (D)-leucinamides as potent,Notch-sparing γ-secretase modulators[J].Eur J Med Chem,2014,79:143-151.
[10]Bein B.Clinical application of the cardioprotective effects of volatile anaesthetics:PRO—get an extra benefit from a proven anaesthetic free of charge[J].Eur J Anaesthesiol,2011,28(9):620-622.
[11]Zhao X,Yang Z,Liang G,et al.Dual effects of isoflurane on proliferation,differentiation,and survival in human neuroprogenitor cells[J].Anesthesiology,2013,118(3):537-549.
[12]Yu ZC,Liu WC,Liu DH,et al.Effect of Notch ligand Delta-1 on the differentiation and maturation of erythroid progenitors in humans[J].Zhonghua Xue Ye Xue Za Zhi,2007,28(6):401-403.
[13]Zanotti S,Canalis E.Notch and the skeleton[J].Mol Cell Biol,2010,30(4):886-896.
[14]Wang H,Dong Y,Zhang J,et al.Isoflurane induces endoplasmic reticulum stress and caspase activation through ryanodine receptors[J].Br J Anaesth,2014,113(4):695-707.
[15]Olney JW,Young C,Wozniak DF,et al.Anesthesia-induced developmental neuroapoptosis.Does it happen in humans?[J].Anesthesiology,2004,101(2):273-275.
Isoflurane Induces the Apoptosis of Mouse Neural Stem Cells by Inhibiting Notch-1 Pathway
HOULengchen1LINFuqing1FUShukun1FENGYa2LIUTe1,3
1.DepartmentofAnesthesiology,TenthPeople'sHospital,TongjiUniversity,Shanghai200072,China;2.DepartmentofNeurology,FirstPeople'sHospital,ShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai200080,China;3.ShanghaiGeriatricInstituteofChineseMedicine,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai200031,China
AbstractObjective:To investigate the influence of isoflurane on neural stem cells and its possible mechanism. Methods:Mouse neural stem cells, isolated and cultured in vitro, were divided into the control group,the phosphate-buffered saline (PBS) group and the isoflurane group.The control group was not intervened.The isoflurane group exposed to isoflurane for 24 h, while the PBS group exposed to the same amount of PBS.Then CCK-8 assay was used to detect the cell proliferation rate.Real-time quantitative polymerase chain reaction was used to detect the mRNA levels of apoptosis-related genes. Expression of apoptosis-related protein was measured with Western blotting. Annexin V-FITC/PI kit was used to assess cell apoptosis. Results: Compared with those in the control group and the PBS group,cell proliferation rate, as well as the mRNA and protein levels of Notch-1,CBF-1 and Hes-1, in the isoflurane group, decreased significantly.There were more apoptotic cells in the isoflurane group than in the control group and the PBS group. Conclusions: Isoflurane can induce the apoptosis of mouse neural stem cells,and the process is closely related to the inhibition of Notch-1 pathway.
Key WordsIsoflurane;Neural stem cells;Notch-1 pathway;Apoptosis
通讯作者刘特,E-mail:liute1979@126.com
中图分类号R614.1
文献标识码A
论著
·
