激光多普勒血流仪评价活体大鼠大脑中动脉栓塞模型成功的可行性分析*
2011-10-24罗玉敏吉训明
刘 宇, 孟 然△, 闫 峰, 罗玉敏, 吉训明△
(1北京大学第九临床医学院,北京世纪坛医院神经内科,北京 100038; 2首都医科大学宣武医院脑血管病研究所,北京 100053)
·实验技术·
激光多普勒血流仪评价活体大鼠大脑中动脉栓塞模型成功的可行性分析*
刘 宇1, 孟 然1△, 闫 峰2, 罗玉敏2, 吉训明2△
(1北京大学第九临床医学院,北京世纪坛医院神经内科,北京 100038;2首都医科大学宣武医院脑血管病研究所,北京 100053)
目的探讨激光多普勒血流仪(LDF)评价活体大鼠脑缺血/再灌注损伤模型制作成功的可行性和可靠性分析。方法10只体重280-310 g的雄性SD大鼠用传统线栓法制作单侧大脑中动脉阻塞(MCAO)模型,神经功能评分,LDF监测插栓前后大鼠脑血流动态变化。于缺血2 h和再灌注24 h断头取脑,TTC染色检测脑片梗死灶体积。结果基线血流均值为(224.99±75.00)PU, 局灶神经功能障碍评分0分。插栓成功MCAO模型,缺血2 h血流均值为(67.23±6.90)PU, 与基线血流差值为157.76PU,降幅约为70%(P<0.01),差异显著。拔拴后血流均值为(216.01±7.30)PU,与缺血2 h血流差值为148.78PU(P<0.01),差异显著;与基线血流差值为-8.98PU(P>0.05),无显著差异。再灌注24 h后,局灶神经功能障碍评分10.35分,脑片TTC染色显示梗死及水肿灶。插栓不成功模型LDF监测显示仍有血流通过,降幅少于基线的50%,再灌注24 h后,局灶神经功能障碍评分0分,TTC染色未见梗死灶。结论LDF对大鼠脑血流的监测是除神经功能评分以外另一种判断活体大鼠MCAO模型制作成功的可靠而实用的方法。
模型,大脑中动脉阻塞; 激光多普勒血流仪
1975年Ster首次报道了用激光多普勒血流测定法(laser Doppler flowmetry, LDF)监测皮肤血流量。1987年Rosenblum将LDF用于神经外科术中脑皮质血流量测定。激光多普勒血流监测是一种实时动态、微创和敏感的微循环血流监测技术,不仅用于神经外科术中对局部脑血流量(regional cerebral blood flow,rCBF)的监测[1],自90年代起也用于监测rCBF的实验研究。
大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型的制作已经成熟[2-9],但对活体成功模型的评判标准尚欠客观,目前国内对活体大鼠模型成功与否的评价仍无明确客观的标准,多以大鼠麻醉清醒后出现插栓对侧前肢不能前伸、运动旋转追尾等表现评价,具有一定的主观性。能否利用客观可行的方法提高对模型成功与否评价的客观性? Schmid-Elsaesser等[2]用LDF评价MCAO模型,发现持续脑血流监测可以用来证明模型制作是否成功,并认为动态血流监测对发现术中出现的蛛网膜下腔出血高度敏感。因此本实验拟通过应用LDF监测大鼠MCAO模型制作过程中大鼠脑血流的动态变化,评价实时动态脑血流监测对大鼠MCAO模型制作成功与否评价的价值。
材 料 和 方 法
1材料
1.1主要试剂与仪器 TTC(2,3,5-氯化三苯基四氮唑,科海军舟生物技术公司)、10%水合氯醛(首都医科大学宣武医院)、激光多普勒血流仪(Perimed;PF5001型;瑞典)、手术显微镜(Carl Zeiss)、反馈式温度调节仪(Harvard Apparatus) 、线栓(北京沙东技术有限公司;型号2838-A)。
1.2动物 SPF级Sprague-Dawley(SD)雄性大鼠10只,体重280-310 g,由维通利华实验动物有限公司提供,动物许可证为SCXK(京)2006-0009。
2方法
2.1模型制作 参照改良线栓法制作MCAO模型[10,11],大鼠称重后,用10%水合氯醛350 mg/kg,腹腔注射麻醉,大鼠俯卧,头部备皮,矢状位剪开额顶部皮肤2 cm,暴露皮下筋膜,用浸满双氧水的棉签摩擦暴露的筋膜,直至暴露出颅骨前囟及右侧半颅骨,应用立体定位仪以前囟为起点向右5 mm,向后3 mm,在该处用牙科钻打孔,至穿透颅骨但未打破硬脑膜为宜。将激光多普勒血流仪的探头固定于孔上,开始记录右侧大脑中动脉供血区域血流变化值,当所示数值平稳,开始制作MCAO模型。颈部备皮,正中剪皮开口,钝性分离腺体和筋膜,术中小心分离右侧颈总动脉(CCA),颈外动脉(ECA),电凝ECA上的2个小分支,将ECA近头端结扎并剪断,近心端紧贴分叉处穿线打松结,于CCA和颈内动脉(ICA)上各置一动脉夹,然后用显微剪在ECA游离端剪一小口,将线栓由此插入动脉,去除ICA上的动脉夹,将线栓慢慢插入ICA,当激光多普勒血流仪显示脑血流量下降至基础值的20%-30%时停止插栓[1],将松结系紧,去除CCA上的动脉夹,缝合皮肤。缺血2 h,拔栓,血流恢复至基线为模型成功。
2.2神经功能评分 采用12分评分法[12-14]。 (1)提尾悬空试验:无明显神经功能缺失为0分,梗死对侧肢体屈曲为1分,梗死对侧肢体外展为2分。(2)肢体放置试验:(a)视觉试验(前方):实验者将动物握于手中,使其前爪悬空,自桌面上方向桌面缓慢斜线靠近此时桌子位于大鼠前方,正常大鼠反应为前肢即刻抓向桌面,损伤大鼠则表现为肢体反应延迟。正常为0分;反应延迟但不超过2 s为1分;反应延迟且超过2 s为2分。(b)视觉试验(侧方),此时桌子位于动物侧方,其余实验方法及评分标准同前。(c)触觉试验(前方),将动物双眼遮住,并使其前爪悬空,此时大鼠应该既看不见,也不能用胡须触及桌面,用其前爪背侧轻触桌面,刺激深度仅达到皮肤和毛发。动物反应及评分同视觉实验。(d)触觉试验(侧方)评分同前。(e)本体觉试验,按压动物前爪,刺激深达肌肉及关节,评分同前。
2.3脑梗死体积的测定 大鼠缺血2 h,再灌注24 h后断头取脑,将鼠脑放在连续模具内进行冠状等距切片,片厚约2 mm,共切6片,用TTC染色,多聚甲醛固定,数码相机摄片。使用Image-Pro Plus软件,计算脑梗死体积[13,15]。梗死体积百分率=(正常侧大脑半球体积-梗塞侧非梗塞区脑组织体积)/正常侧大脑半球体积。
2.4脑血流监测 用Perimed公司提供的LDF数据记录软件(PSW),记录并分析监测期间脑血流变化情况。
3统计学处理
结 果
1LDF监测MCAO模型的脑血流图
MCAO模型成功的大鼠插栓时脑血流降幅距基线达到70%以上(图1),且拔栓后血流迅速恢复接近基线,模型成功率为88%。成功的MCAO模型更多的脑血流图特点见图1。有1只麻醉意外,被排除。有1只出现缺血期间局部血流不能完全阻断,脑血流平均降幅仅达到基线的50%,见图2,此时线栓已插入深度达18 mm且线栓插入和拔出均困难,血流阻断不完全的脑血流图特点见图2。
如图1显示,区域1为基线,此阶段是制作大脑中动脉缺血模型的过程,手术中碰触血管时有血流波动情况发生,基线平均血流值为(224.99±75.00)PU。区域2为缺血阶段,第一个标签表示,将线栓插入大脑中动脉,此时血流量迅速降低,下降幅度约为基线区域的70.12%,插线后平均血流值为(67.23±6.90)PU。区域3为再灌注的起始阶段,第2个标签表示,将线栓拔除后,血流迅速恢复至基线水平,拔栓后平均血流值为(216.01±7.30)PU,恢复至基线血流的96.10%。
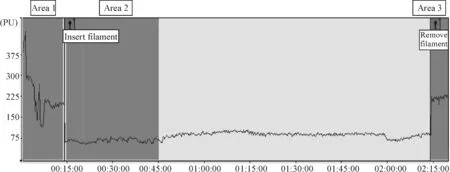
Figure 1. Dynamic changes of cerebral blood flow during MCAO (successful).Horizontal axis: time(min); vertical axis: the relative value of blood flow (PU).Area 1: baseline=(224.99±75.00)PU;Area 2: cerebral blood flow after filament inserted =(67.23±6.90)PU;Area 3: restored cerebral blood flow after filament removed =(216.01±7.30)PU.
图1MCAO过程中血流动态变化(成功)
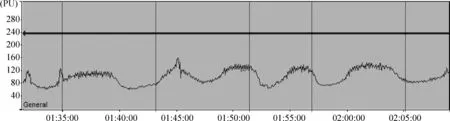
Figure 2. Dynamic changes of cerebral blood flow during MCAO (unsuccessful).Horizontal axis: time (min); vertical axis: the relative value of blood flow (PU).
图2MCAO过程中血流动态变化(不成功)
如图2及表1所示,在缺血期间,插栓局部血管呈现不规则的收缩状态。最大血流为177.34 PU,最小值为57.01 PU,均值为99.67 PU,标准差为22.62,血流呈蠕动样波动,虽变化幅度较显著,但插栓后降幅不超过基线的50%,也不体现明确的插栓缺血/拔栓再灌注的规律。本图所示的情况发生在缺血期间,可能为线栓在血管内有滑动,造成的非持续性阻断血流;另有一些没有完全阻断血流的情况,发生在插栓的过程中,可能由于线栓刺激血管壁导致局部血管发生痉挛,此时线栓已不能再插入,过去常误认为模型成功,只有经TTC染色方能排除。应用LDF持续动态脑血流监测,可以通过脑血流曲线的降幅及波动特点及时发现MCAO模型没有成功。
2MCAO模型LDF监测脑血流动态变化数据
如表2所示,9只大鼠插栓后区域血流量平均值比基线区域下降幅度≥70%,拔栓后区域血流量平均值基本恢复至基线水平,无显著差异,P>0.05。
3TTC染色验证MCAO模型成功
于缺血2 h再灌注24 h后将大鼠断头取脑,冠状等距切片制成脑片,TTC染色病理组织学验证MCAO模型成功见图3, TTC染色显示的白色区域为新鲜梗死病灶。 本研究中模型成功大鼠的脑梗死平均体积为48.4%。24 h后神经功能评分平均值为10.35分。模型不成功,则没有显示白色的局灶梗死损害,见图4。24 h后神经功能评分平均值为0分。
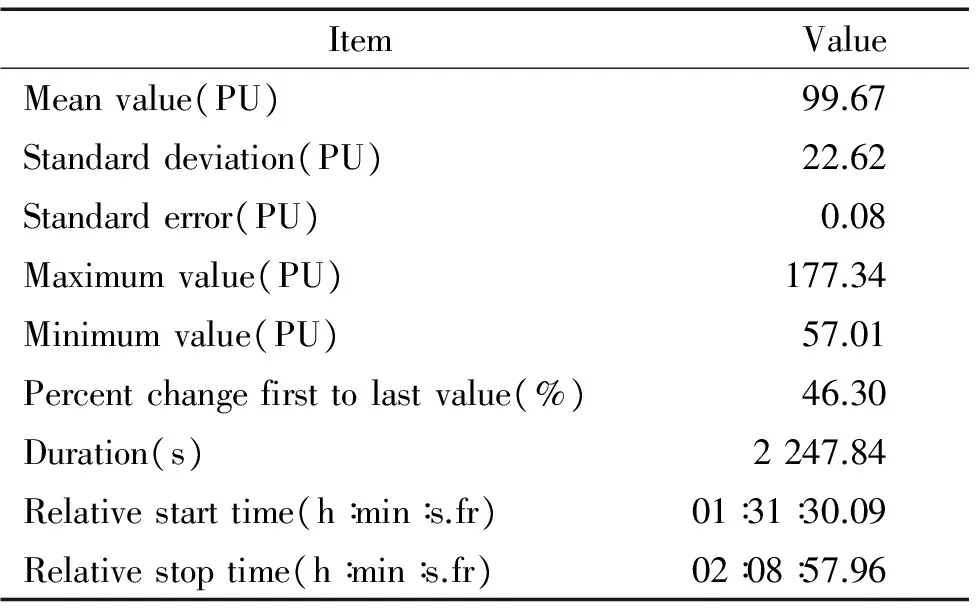
表1 血流变化数据(不成功)

表2 脑血流动态变化情况
*P<0.05vsbaseline.
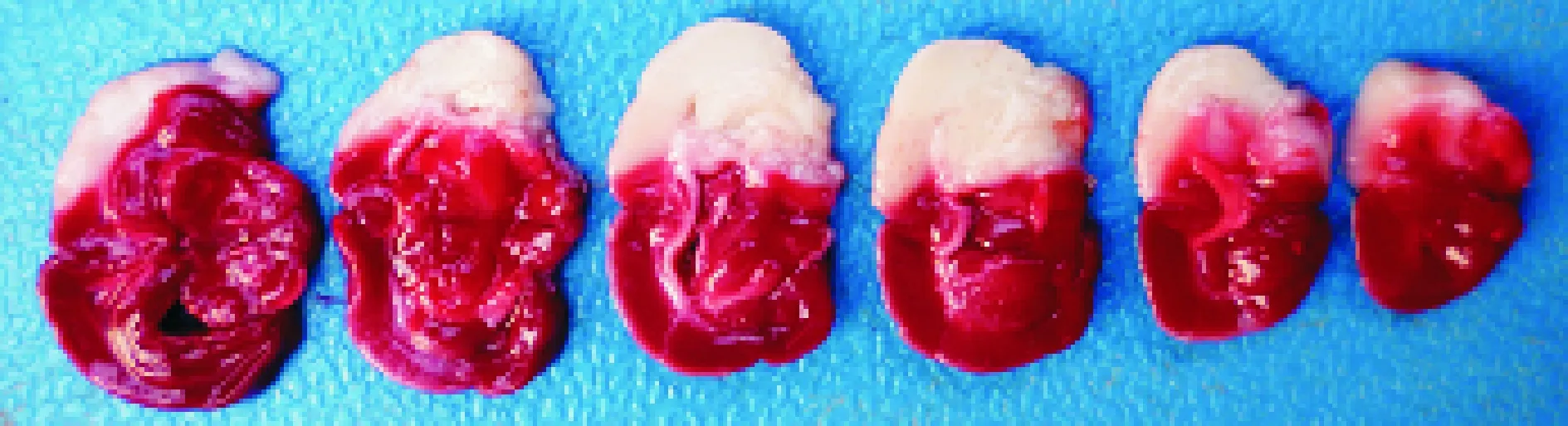
Figure 3. Brain slices stained with TTC (2 h ischemia followed by 24 h reperfusion).
图3TTC染色结果

Figure 4. Brain slices with TTC staining(Blood flow was blocked incompletely,without local infarction).
图4TTC染色结果
讨 论
国内以往对制作MCAO模型是否成功的评价主要依靠对动物存活时神经功能缺陷的评分,这种方法不完全可靠,常因掺杂主观因素造成实验评价误差。MCAO模型制作过程中常会出现干扰评价模型是否成功的因素,如血管痉挛,此时虽然线栓已经不能再插入,但血流量下降程度远没有达到形成模型成功的标准,如果不使用脑血流监测,就此判断模型成功,会使实验出现假阳性的结果。另有一些大鼠造模成功后的临床神经功能评分仍达不到入组标准,处死大鼠后才发现梗塞侧脑梗死体积已经达标,产生假阴性结果,造成实验中人力物力和时间的浪费。为提高对MCAO活体模型制作成功评价的准确性,我们在研究中尝试使用LDF监测脑血流动态变化来评价MCAO活体模型制作是否成功。研究结果显示:LDF监测结果与TTC染色证实了的脑梗死病灶具有很高的一致性,符合率达到88%。LDF监测评价比TTC染色评价更有优势之处是前者不仅提高了对模型成功评价的准确性,同时可以对活体模型进行评价,为对同一MCAO活体模型梗死后再灌注的研究提供了可能。
另外LDF监测可以及时发现大鼠血管的个体差异,可以个体化选择用于栓塞的栓子直径,达到与血管腔直径更好地吻合。有报道显示[11]体重偏小的大鼠,血管管径偏细,用同样的线栓无法插入大脑中动脉,而体重稍大的大鼠血管管径偏大,用同样的线栓不能有效阻断血流达到栓塞满意的效果,对于实验的可比性造成影响。而通过LDF血流量降低程度的监测来控制梗死体积,使每个MCAO模型更具有可比性。国外已采用激光多普勒血流仪评价MCAO模型是否成功[2],而国内在模型制作上尚未见广泛采用这一客观的评价手段,影响实验结果的可比性。本研究显示,把脑血流监测作为评价模型是否成功的指标,不仅不需处死动物就能直接评价活体模型,而且可以提高MCAO模型的可比性,使实验结果更有说服力。
激光多普勒血流测定法是一种准确反映微循环灌注的测量手段,在神经外科领域应用较多。临床常用的另一种超声经颅多普勒技术(TCD)主要用于判断颅内较大血管的血流情况,间接反映血管功能及脑组织的灌注状态,但无法探查脑组织微循环情况。将二者结合优势互补,共同评价脑血流灌注状态将会促进对缺血性脑血管动物模型的缺血/再灌注损伤整个过程中的每个不同病理阶段的脑血管血流动力学的变化情况和药物干预后的动态变化进行观察。本研究结果再次证明LDF对于活体MCAO模型制作成功与否的评价是可靠而实用的。
(致谢:感谢首都医科大学宣武医院脑血管病研究所的闫峰老师及罗玉敏教授、吉训明教授等对模型制作和应用LDF仪对动物模型脑血流监测等工作中提供的仪器、设备和技术指导。)
[1] 吴劲松,陈衔城. 激光多普勒血流测定法在局部脑血流量监测中的应用[J].国外医学:脑血管疾病分册,1999,7(3):162-164.
[2] Schmid-Elsaesser R, Zausinger S, Hungerhuber E, et al. A critical reevaluation of the intraluminal thread model of focal cerebral ischemia: evidence of inadvertent premature reperfusion and subarachnoid hemorrhage in rats by laser-Doppler flowmetry[J]. Stroke,1998, 29 (10):2162-2170.
[3] Zwagerman N, Sprague S, Davis MD, et al. Pre-ischemic exercise preserves cerebral blood flow during reperfusion in stroke[J]. Neurol Res,2010,32(5):523-529.
[4] Zweifel C, Czosnyka M, Lavinio A,et al. A comparison study of cerebral autoregulation assessed with transcranial Doppler and cortical laser Doppler flowmetry[J]. Neurol Res,2010, 32 (4):425-428.
[5] Livnat A, Barbiro-Michaely E, Mayevsky A. Mitochondrial function and cerebral blood flow variable responses to middle cerebral artery occlusion[J]. J Neurosci Methods,2010, 188 (1): 76-82.
[6] Hoyte LC, Papadakis M, Barber PA, et al. Improved regional cerebral blood flow is important for the protection seen in a mouse model of late phase ischemic preconditioning[J]. Brain Res,2006, 1121 (1):231-237.
[7] Harada H, Wang Y, Mishima Y, et al. A novel method of detecting rCBF with laser-Doppler flowmetry without cranial window through the skull for a MCAO rat model[J]. Brain Res Protoc, 2005,14 (3):165-170.
[8] Schöller K, Zausinger S, Baethmann A, et al. Neuroprotection in ischemic stroke-combination drug therapy and mild hypothermia in a rat model of permanent focal cerebral ischemia[J]. Brain Res,2004, 1023 (2): 272-278.
[9] Kim T, Masamoto K, Fukuda M, et al. Frequency-dependent neural activity, CBF, and BOLD fMRI to somatosensory stimuli in isoflurane-anesthetized rats[J]. Neuroimage,2010,52(1):224-233.
[10]Longa EZ, Weinstein RP, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1):84-91.
[11]戴 炯,文 立,熊文浩,等.改良线栓法制备大鼠局灶性脑缺血/再灌注模型[J].上海交通大学学报(医学版),2007,10(10):1218-1222.
[12]朱榆红,吉训明,李春艳,等.缺血后适应对大鼠脑缺血/再灌注损伤的影响[J].中国病理生理杂志,2008,24(11):2151-2155.
[13]Belayev L,Alonso OF,Busto R,et al.Middle cerebral artery occlusion in the rat by intraluminal suture: Neurological and pathological evaluation of an improved model[J].Stroke,1996,27(9):1616-1623.
[14]Bederson JB, Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination[J]. Stroke,1986, 17(3): 472-476.
[15]Lin TN,He YY,Wu G,et al.Effect of brain edema on infarct volume in a focal cerebral ischemia model in rats[J].Stroke,1993, 24(1):117-121.
EvaluationofratMCAOmodelbylaserDopplerflowmetry
LIU Yu1, MENG Ran1, YAN Feng2, LUO Yu-min2, JI Xun-ming2
(1DepartmentofNeurology,BeijingShijitanHospital,TheNinthClinicalMedicalCollegeofPekingUniversity,Beijing100038,China;2CerebrovascularDiseasesResearchInstitute,XuanwuHospitalofCapitalMedicalUniversity,Beijing100053,China.E-mail:victor65@126.com;E-mail:jixm70@hotmail.com)
AIM: To investigate the feasibility and reliability of using laser Doppler flowmetry (LDF) to evaluate the animal model of cerebral ischemia and reperfusion injuryinvivo.METHODSTen Sprague-Dawley (SD) male rats, weighing 280-310 g, were subject to unilateral middle cerebral artery occlusion (MCAO) with the routine method of line-embolism, and the cortical blood flow was continuously monitored by LDF during ischemia and reperfusion in the rats. Meanwhile, the degree of injury induced by cerebral ischemia and reperfusion was evaluated after MCAO by the nervous scoring of rat criteria. Brain slices were obtained by the method of neck end breaking and brain autopsy at the time point of ischemia for 2 h and reperfusion for 24 h. The volumes of infarction in the brain slices were determined by TTC staining.RESULTS(1) In the successful MCAO rats, the average local blood flow remarkably decreased from the baseline value of (224.99±75.00)PU to (67.23±6.90)PU in the ischemic period. The mean difference was 157.76 PU and decreasing amplitude of local blood flow was more than 70% by MCAO. In the reperfusion period, the average local blood flow was rapidly recovered to (216.01±7.30)PU after the embolus was pulled out, which was only slightly lower than that of the baseline level without statistical significance. However, the mean difference of 148.78 PU between the local blood flow of reperfusion and local blood flow of cerebral ischemia for 2 h was found (P<0.01). The average local nervous score was 10.35 at 24 h after cerebral ischemia and reperfusion,higher than that of the baseline (0 point). The infracted evidence with remarkable brain edema in the brain slices was clearly observed with TTC staining. (2) In the unsuccessful MCAO rats, the decrease in local blood flow was less than 50%. The local nervous score was 0 point at 24 h, which was equal to the baseline value. No local infraction and brain edema was observed in the brain slices.CONCLUSIONBesides using the local nervous functional scoring, continuously monitoring of blood flow by LDFinvivois a reliable and useful method to confirm the successful establishment of rat MCAO model.
Models,middle cerebral artery occlusion; Laser-Doppler flow meter
R331
A
1000-4718(2011)03-0620-05
2010-09-12
2010-12-17
国家自然科学基金资助项目(No.30770741);北京市卫生系统高层次卫生技术人才资助项目(No.2009-03-02)
△通讯作者 孟然Tel:010-63926650; E-mail:victor65@126.com;吉训明 Tel: 010-83548256; E-mail:jixm70@hotmail.com
10.3969/j.issn.1000-4718.2011.03.041
