CoREST基因在骨关节炎软骨组织中的表达、分布和意义*
2011-10-24赵赞栋史占军梁锦前吴志宏邱贵兴
肖 军, 赵赞栋, 史占军△, 梁锦前, 吴志宏, 邱贵兴
(1南方医院关节骨病外科, 广东 广州 510515;2北京协和医院骨科, 北京 100730)
CoREST基因在骨关节炎软骨组织中的表达、分布和意义*
肖 军1, 赵赞栋1, 史占军1△, 梁锦前2, 吴志宏2, 邱贵兴2
(1南方医院关节骨病外科, 广东 广州 510515;2北京协和医院骨科, 北京 100730)
目的观察RE-1元件辅助沉默因子(CoREST)基因在正常和骨关节炎(OA)膝关节软骨组织中的表达和分布,分析CoREST基因表达下调对OA的病理意义。方法取材膝关节正常(n=10)和OA(n=12)软骨组织,提取软骨细胞并包埋制备切片,应用real-time PCR技术对比CoREST基因在正常和OA软骨细胞中表达水平的总体差异,应用原位杂交技术观察CoREST基因在正常/OA软骨表、中、深各层组织中的表达和分布的特点。结果CoREST基因在OA软骨细胞中的表达水平显著降低64.6%(P<0.01)。CoREST基因广泛表达于正常软骨组织的表层、中层和深层,以中层表达最为显著,其次为深层和表层。在OA软骨组织中,CoREST基因在浅层细胞簇部分细胞中表达水平升高,在深层潮线状细胞柱中表达水平普遍降低。结论CoREST基因在正常和OA软骨组织细胞中的差异表达和分布与文献报道的X型胶原基因的组织学表达一致。结合前期研究成果,我们认为CoREST的生物功能可能与OA软骨细胞的终末分化相关。
RE-1元件辅助沉默因子; 骨关节炎; 软骨细胞; 原位杂交
骨关节炎(osteoarthritis, OA)是一种以软骨退变、磨损为病理表现的疾病[1]。软骨细胞终末分化,导致合成/分解代谢负平衡,甚至凋亡,是OA软骨缺损修复困难和OA进展的关键原因之一[2]。我们前期实验研究发现OA软骨细胞表达RE-1元件辅助沉默因子[RE-1 silencing transcription factor (REST) corepressor, CoREST]的水平较正常软骨细胞显著降低,诱发软骨细胞表型基因的表达呈现特征性变化,提示CoREST是OA软骨细胞终末分化的始动因子或软骨细胞合成代谢的调节因子[3]。本文旨在通过组织学切片进一步观察CoREST基因在骨关节炎软骨组织中的表达和分布特点,了解CoREST在OA发生和发展过程中的病理意义。
材 料 和 方 法
1资料及分组
OA膝关节软骨组织取材自接受膝关节表面置换的OA患者[n=12,男性2人,女性10人,平均年龄62.7岁(53-72岁)]。OA诊断依据美国风湿病协会2001年版指南。正常软骨组织取材于遗体捐献患者[n=10,男性2人,女性8人,平均年龄65.1岁(60-71岁)],排除膝关节疾病病史。软骨标本取材均经过患者或家属知情同意。
2软骨细胞总RNA的提取和鉴定
液氮速冻后,称取约100 mg软骨组织,研磨成粉末。加入含β-巯基乙醇的RLC缓冲液,应用RNeasy Fibrous Tissue Mini kit(Qiagen)提取组织总RNA。操作步骤按照试剂盒说明书进行。最后步骤采用13 μL DEPC H2O洗脱。所获RNA溶液测量A280/260比值确认纯度合格后,剩余约11 μL RNA溶液直接作为模板进行第1链cDNA的合成。
3第1链cDNA的合成
反转录第1链cDNA采用ReverTra Ace -α-TM kit (Toyobo)。反应体系构成为:RNA溶液11 μL,oligo(dT) 1 μL,5×缓冲液 4 μL,10 mmol/L dNTP混合物 2 uL,ReverTra Ace(1×108U/L)1 μL,RNA酶抑制剂1 μL。反应条件为:30 ℃ 10 min;42 ℃ 20 min;95 ℃ 5 min;4 ℃终止反应。
4Real-timePCR
CoREST和内参照GAPDH引物(表1)通过Roche公司在线程序Universal ProbeLibrary for Human(https://www.roche-applied-science.com/sis/rtpcr/upl/acenter.jsp?id=030000)设计。引物特异性通过Blast程序(NCBI GenBank)验证。

表1 Real-time PCR引物
Real-time PCR试剂选用QuantiTectTMSYBR® Green PCR (Qiagen)。反应条件:94 ℃ 60 s,60 ℃ 20 s,72 ℃ 40 s,循环40次。反应体系构成:cDNA模板2 μL、SYBR master Mix 10 μL、上下游引物(300 nmol/L)各1 μL、DEPC H2O 6 μL。PCR反应首先采用Roter-Gene 3000(Roche)进行,通过双标准曲线法比较CoREST和GAPDH引物的扩增效率。确认扩增效率差异仅0.04后,改用Applied Biosystems 7500系统(ABI)对比CoREST基因表达在正常和OA组软骨细胞之间的差异,实验重复3次。组间差异应用2-ΔΔCt法计算。
5探针的合成与标记
CoRESTmRNA寡核苷酸探针应用Primer 3.0软件设计,序列为5′-CGAG GACTAAAACT AGTGTGATGG ATCGCCATGC CCGGAAACAA AAACGGGAGC-3′。序列特异性经过BLAST(同前)验证。探针采用地高辛5′端标记,由Invitrogen合成。
6软骨组织原位杂交
软骨组织变性、洗涤后直接包埋石蜡,切片厚度4 μm, 贴片后经72 ℃烘烤3 h。二甲苯、乙醇梯度入水,蛋白酶K (100 mg/L ) 37 ℃消化15 min。4% 多聚甲醛固定10 min,2×SSC、三蒸水洗涤后逐级乙醇脱水。滴加预杂液,42 ℃预杂2 h后,滴加40-60 μL变性的杂交液(探针浓度2 mg/L), 45 ℃杂交过夜。室温下2×SSC洗涤5 min 2次,0.5×SSC洗涤15 min 2次,0.2×SSC洗涤15 min 2次,洗去非特异性结合。滴加封闭液,37 ℃孵育30 min,滴加1∶100稀释的兔抗地高辛-BSA抗体。37 ℃孵育60 min,0.1 mol/L PBS洗涤5 min×4次。添加DAB显色45 s,充分水洗后苏木素复染。封片后显微镜下观察原位杂交结果,图像资料导入Image Pro 6.0软件进行分析。CoREST基因阳性表达细胞判定标准为:细胞内出现棕黄色染色的颗粒或斑块。
7统计学处理
CoREST基因表达在正常/OA软骨细胞间的差异和CoREST基因在软骨组织各层表达水平的差异均采用独立样本的t检验进行组间对比统计学分析。
结 果
1CoREST基因在正常软骨和OA软骨细胞中的差异表达
Real-time PCR结果显示OA软骨细胞中CoREST的表达呈现下调趋势。OA软骨细胞中CoREST表达水平相比正常软骨细胞平均降低64.6%,P<0.01,差异显著,见图1。
2CoREST基因在软骨组织中的表达和分布
CoREST基因在OA软骨组织中广泛表达于软骨各层(表层、中层和深层),其中,中层软骨细胞中的CoREST表达量最高,细胞胞浆普遍呈棕黄色染色。深层细胞潮线内软骨细胞CoREST表达量稍少于中层,表现为部分软骨细胞胞浆呈现浅黄色淡染。在表层软骨细胞中,CoREST表达量最少,部分细胞胞浆呈现空泡样改变,CoREST表达缺如。CoREST在正常软骨组织细胞中的mRNA的表达量总体呈现:中层>深层>表层趋势,见图2A、B。
OA软骨表现为表层组织不同程度磨损、裂缝或纤维化。在磨损或裂缝的表面下,浅层软骨细胞呈现团簇样增生,而深层细胞量减少,潮线结构趋于不明显。在表层团簇样增生的细胞中,部分细胞呈现浓染的棕黄色胞浆,说明CoREST高表达。但是,这种表达并不均一,在同一细胞簇的部分其它细胞中,CoREST染色较弱甚至呈现阴性表达。在深层呈潮线排列的软骨细胞中,CoREST染色阳性细胞呈零星分布,整体表达丰度明显低于OA软骨表层和正常软骨,见图3。
缺损灶周围的软骨区域,软骨细胞杂乱增生,排列失去层次和规律,软骨基质呈现纤维化。在这些区域,CoREST基因在绝大部分软骨细胞中表达缺如,细胞胞浆无阳性染色信号,见图4A。在软骨缺损灶底部,CoREST基因表达缺如,见图4B。
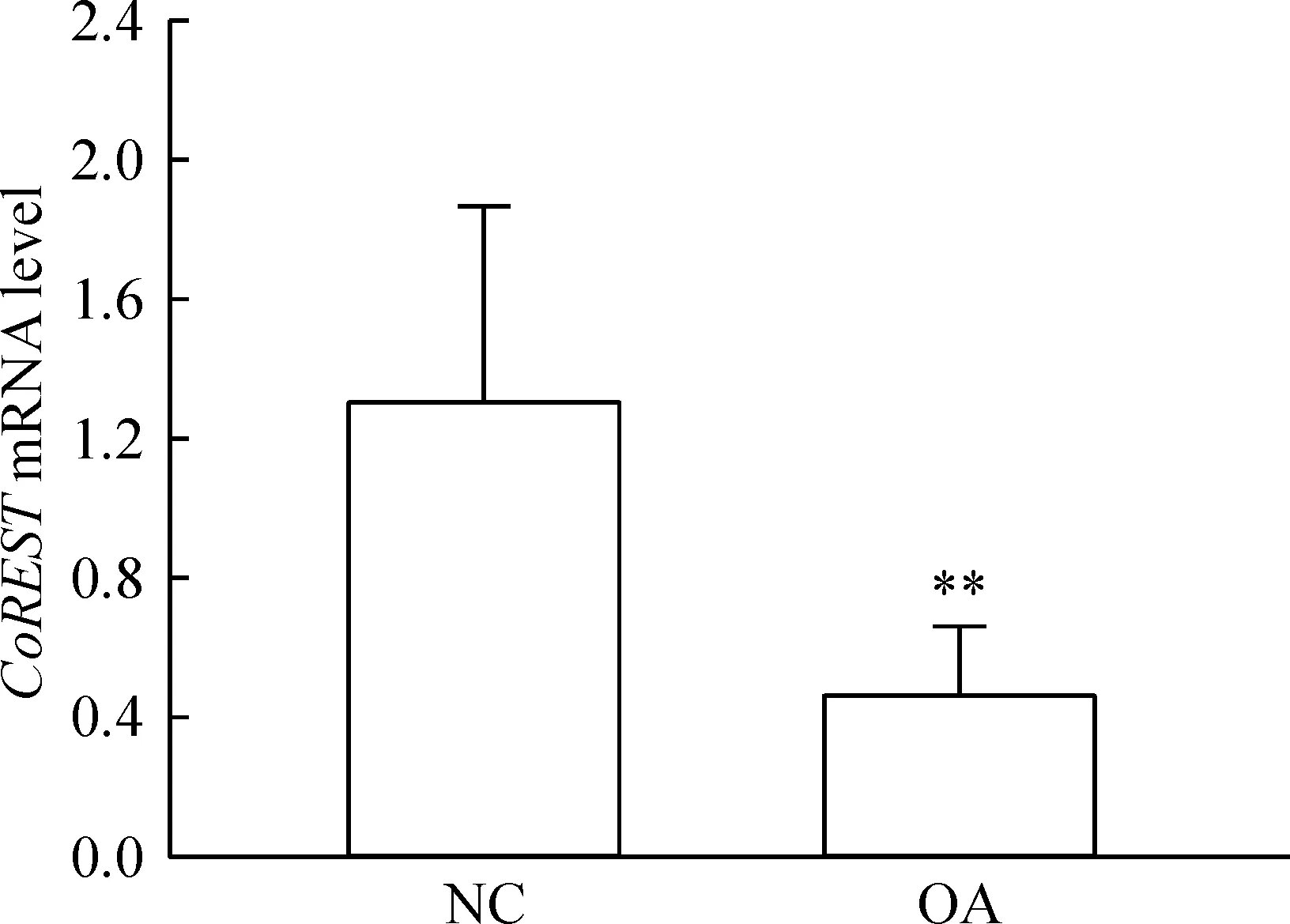

图1正常和OA软骨组织细胞中CoREST基因表达水平对比

Figure 2.CoRESTgene expression in normal cartilage(×100).
图2CoREST基因在正常软骨组织中的表达
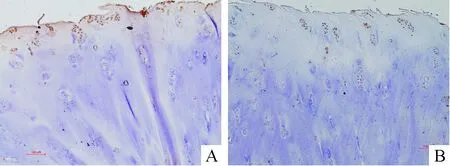
Figure 3.CoRESTgene expression in osteoarthritic cartilage(×100)
图3CoREST基因在OA软骨组织中的表达
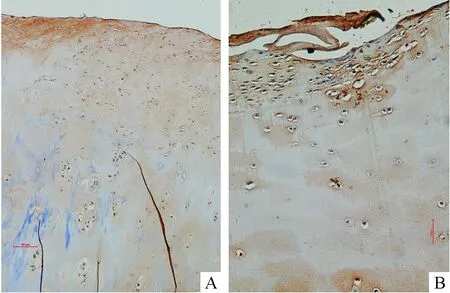
Figure 4.CoRESTgene expression in the region around the cartilage defect (4A,×100;4B,×200).
图4CoREST基因在OA软骨缺损灶周围组织中的表达
讨 论
CoREST的经典定义是一种神经元表型调控因子,它以CoREST/ REST复合体的作用模式,发挥对神经元分化的调控[4]。在非神经元细胞种属中,CoREST被认为通过抑制神经元表型基因的表达,参与维持这些细胞表型的特异性和稳定性[5]。
我们前期研究发现CoREST参与了对OA软骨细胞表型的调控。CoREST在OA软骨细胞中表达下调,导致软骨细胞正常分化表型II型胶原和aggrecan表达水平下降,而终末分化表型X型胶原表达水平升高,提示CoREST是OA软骨细胞终末分化的始动因子,或软骨细胞合成代谢的调控因子[3]。
本文在基因水平上验证CoREST在OA软骨细胞中的差异表达,并观察CoREST基因在不同程度病损的OA软骨组织,以及软骨组织不同区域表达水平的差异,旨在通过观察CoREST与软骨组织细胞区域性病理变化之间的相关性,提供CoREST参与调控OA软骨细胞病理改变的线索。实验结果首先证实CoREST基因表达水平在OA软骨细胞中显著下降,幅度达到64.6%。
原位杂交发现CoREST在OA软骨组织中的表达并非整体降低。CoREST基因广泛表达于正常软骨组织的表层、中层和深层,其中,中层软骨细胞中CoREST表达丰度最高,深层相对较低,表层表达相对较少。在OA软骨中,磨损的软骨表层被增生的细胞团簇所替代,同时,深层潮线状排列的细胞数量较正常减少。虽然CoREST在OA软骨的表达总体下调,但在OA软骨组织浅层增生的细胞团簇中,大部分细胞却呈现CoREST基因的高表达,虽然这种表达并不均一,团簇内部分细胞表达CoREST甚至缺如。在OA软骨深层潮线状排列的细胞中,大部分细胞均表现为CoREST阴性表达或低表达。在纤维化严重的区域和OA软骨缺损区域,CoREST表达水平才整体下降。
可见,CoREST基因表达下降主要集中在OA软骨组织的深层细胞。结合前期的研究成果,我们分析CoREST在组织深层OA软骨细胞的下调表达将诱导深层软骨细胞上调表达X型胶原基因,同时抑制局部II型胶原和蛋白多糖的合成。该分析结果与Aigner等[6]关于X型胶原基因在OA软骨组织中的分布相符-通过原位杂交技术,Aigner证实X型胶原基因主要表达于OA软骨组织的深层细胞,而在表层增生的细胞团簇内中表达较少。另一方面,Nelson等[7]和Pfander等[8]分别通过免疫组织化学技术,证实OA软骨细胞上调表达II型胶原,主要集中于组织深层的软骨细胞,这种现象不能用我们所观察到的CoREST在OA软骨组织各层之间的差异表达来解释。
综上所述,本文原位杂交结果进一步支持将CoREST的生物功能与OA软骨细胞X型胶原基因表达的调控以及软骨细胞的终末分化的调控相关联。而软骨细胞II型胶原等产物的合成代谢可能受到其它调控因子的综合影响,不能以CoREST调控“一元论”解释。CoREST调控软骨细胞终末分化的生物功能和分子通路仍有待深入研究。
[1] 嵇 波,郭长青,金 燕,等.针刀和电针对膝骨关节炎大鼠痛阈和中枢单胺类神经递质的影响[J].中国病理生理杂志,2010,26(6):1091-1095.
[2] Aigner T, McKenna L. Molecular pathology and pathobiology of osteoarthritic cartilage[J]. Cell Mol Life Sci, 2002,59(1):5-18.
[3] Xiao J, Li T, Wu Z, et al. REST corepressor(CoREST) repression triggers phenotypic genes regulation in osteoarthritic chondrocytes[J]. J Orthop Res, 2010,28(12):1569-1579.
[4] Andres ME, Burger C, Peral-Rubio MJ, et al. CoREST: a functional corepressor required for regulation of neural-specific gene expression[J]. Proc Natl Acad Sci USA, 1999,96(17):9873-9878.
[5] Ballas N, Grunseich C, Lu DD, et al. REST and its corepressors mediate plasticity of neuronal gene chromatin throughout neurogenesis[J]. Cell, 2005,121(4):645-657.
[6] Aigner T, Reichenberger E, Bertling W, et al. Type X collagen expression in osteoarthritic and rheumatoid articular cartilage[J]. Virchows Arch B Cell Pathol Incl Mol Pathol, 1993,63(4):205-211.
[7] Nelson F, Dahlberg L, Laverty S, et al. Evidence for altered synthesis of type II collagen in patients with osteoarthritis[J]. J Clin Invest, 1998,102(12):2115-2125.
[8] Pfander D, Rahmanzadeh R, Scheller EE. Presence and distribution of collagen II, collagen I, fibronectin, and tenascin in rabbit normal and osteoarthritic cartilage[J]. J Rheumatol, 1999,26(2):386-394.
DifferentialexpressionanddistributionofCoRESTinosteoarthriticcartilage
XIAO Jun1, ZHAO Zan-dong1, SHI Zhan-jun1, LIANG Jin-qian2, WU Zhi-hong2, QIU Gui-xing2
(1DepartmentofOrthopaedics,NanfangHospital,Guangzhou510515,China;2DepartmentofOrthopaedicsandTraumatology,PekingUnionMedicalCollegeHospital,Beijing100730,China.E-mail:zhanjunshi@yahoo.com.cn)
AIM: To analyze the role of RE-1 silencing transcription factor corepressor (CoREST) in the pathogenesis of osteoarthritis (OA) by observing the differential expression and distribution ofCoRESTgene in the normal and osteoarthritic knee cartilages.METHODSThe samples of knee cartilage were obtained from the normal donors (n=10) and the patients undergoing total knee arthroplasty with the diagnosis of OA (n=12). The chondrocytes were isolated and paraffin sections were prepared. The expression levels ofCoRESTgene were determined in the normal and osteoarthritic chondrocytes by real-time PCR. The mRNA expression and distribution ofCoRESTin the individual layers, including the superficial, middle and deep layer of the normal and OA cartilage, were observed by the method ofinsituhybridization.RESULTSCompared with normal chondrocytes,CoRESTgene expression was down-regulated by 64.6% (P<0.01) in OA chondrocytes.CoRESTmRNA was generally expressed in all the superficial, middle and deep layers of the normal cartilage, in which the highest was in the middle layer and then in the deep and superficial layers. In OA cartilage, CoREST mRNA expression was up-regulated dominantly in the cell clusters of the superficial layer, whereas down-regulated in the cell columns of the deep layer.CONCLUSIONThe expression and distribution ofCoRESTgene between normal and OA chondrocytes are similar to those of the reported type X collagen. Based on the achievements of our previous study, we consider that the biological function of CoREST is correlated with the terminal differentiation of OA chondrocytes.
RE-1 silencing transcription factor corepressor; Osteoarthritis; Chondrocytes;Insituhybridization
R68
A
1000-4718(2011)03-0585-04
2010-08-16
2010-11-11
南方医科大学南方医院院长基金资助项目(No.2008C009);广东省医学科研基金资助项目(No.A2010362)
△通讯作者 Tel: 020-61641722; E-mail: zhanjunshi@yahoo.com.cn
10.3969/j.issn.1000-4718.2011.03.032
