中国红豆杉内生放线菌En-1的分离、鉴定及其次生代谢物的研究
2011-10-22林岚李靖
林岚,李靖
东南大学医学院生物工程系,江苏 南京 210009
植物与微生物的关系多种多样,植物相关的微生物包括菌根菌(多为真菌)、根际微生物、病原菌、内生菌等等。植物内生菌是生活在健康植物活体内、不会导致宿主出现病害症状的微生物[1],内生菌类群涵盖细菌、放线菌以及真菌。在不同的宿主植物体内存在不同种类的内生菌,它们对宿主的选择存在一定专一性。其共同特征是能定殖在健康植物细胞间隙或细胞内, 并与宿主植物建立和谐的共生关系。
红豆杉Taxus又名紫杉,是公认的濒临灭绝的天然珍稀植物[2]。作为抗癌药物紫杉醇的重要生源,红豆杉一直倍受药学家、天然产物化学家的重视。自20世纪90年代Strobel等[3]从短叶红豆杉中分离得到一株产紫杉醇的内生真菌以来,红豆杉内生菌分离与研究成为一个热点,许多内生真菌相继被分离得到。
目前红豆杉内生菌的研究方面,内生细菌的报道远少于内生真菌,放线菌的报道更少,迄今仅见于意大利学者Quaroni S.研究团队[4-5]和中国学者Wu et al[6]的研究文章。基于此,本文着手从药用植物红豆杉嫩枝与叶中分离内生的原核微生物(细菌、放线菌),并围绕一株内生放线菌En-1展开研究,优化其培养条件,并对其次生代谢产物的结构和抗菌活性进行筛选,为发现结构新颖和活性独特的内生菌代谢产物奠定良好基础,而且为研究内生菌是否影响植物药用成分(如紫杉醇及其前体)的生物合成相关研究提供新的切入点。
1 材料与方法
1.1 材料
1.1.1 实验材料
采自中山植物所药用植物园的中国红豆杉Taxus chinensis茎、叶;供试菌大肠杆菌Escherichia coli、金黄色葡萄球菌Staphyloccocus aureus、枯草芽孢杆菌Bacillus subtilis、白色念球菌(又名:白假丝酵母)Canidia albicans、黑曲霉Aspergillus niger均为本实验室保存的中国药典标准菌株,分别代表G-肠道菌、G+球菌、G+杆菌、酵母状真菌和丝状真菌。
1.1.2 试剂
卡那霉素、制霉菌素、吐温-20均购自上海生工公司,苯酚购自国药集团化学试剂公司,NaClO溶液(有效氯含量34.0%~46.0%)、乙醇购自南京化学试剂有限公司。
1.1.3 培养基
高氏一号合成培养基、PDA培养基和牛肉膏蛋白胨培养基成分及配制参见文献[7]。
1.2 方法
1.2.1 样品预处理、表面消毒和内生菌分离
红豆杉嫩枝和叶用自来水流水冲洗后,在加有3~4滴吐温-20的水中浸泡20~25 min,再用流水冲净。然后依次 φ=75%乙醇(1 min)、w=2.0%次氯酸钠(20 min)、φ=75%乙醇(1 min)处理,乙醇、次氯酸钠两种消毒剂处理之间以无菌水清洗3遍,最后无菌水清洗3~4遍,无菌滤纸吸取多余水分。
将上述植物材料表面消毒的末次清洗的无菌水作为对照,与植物样本的叶汁(0.1 mL)在同等条件下铺板,以检查表面消毒的彻底性;同时将经表面消毒的一批植物材料取几个平行样,以其外表面分别在牛肉膏蛋白胨培养基和高氏1号合成培养基平板上轻缓滚动后移走,目的也是检查表面消毒是否彻底。
将表面消毒的植物材料用无菌剪刀剪碎, 置于无菌研钵内,加10 mL生理盐水研磨充分并静置5~10 min,吸取1 mL清亮的叶汁移至另一无菌试管,依次10倍稀释,得到一系列稀释液,分别进行涂板(0.2 mL/平板)。每个稀释度的样品,做3个重复[9]。分离内生细菌,采用含50 μg·mL-1制霉菌素(以抑制真菌生长)的牛肉膏蛋白胨培养基[10];分离内生放线菌,采用含50 μg·mL-1卡那霉素、50 μg·mL-1制霉菌素、φ=0.25%酚(以抑制真菌和细菌的生长)的高氏1号合成培养基[9-10]。上述抗生素各自配成100 mg·mL-1的贮存液, 并经0.22 μm滤膜除菌。在分离到的内生菌中,有一株放线菌(命名为En-1)引起特别关注,其菌落形态、显微观察 (参见1.2.2) 和产土腥素能力提示En-1为链霉菌。将该菌株冻存于φ=20%甘油中(-70 ℃)。
1.2.2 内生放线菌的显微观察
采用插片法制作放线菌 En-1自然生长情况下的镜检片[7],在光学显微镜下观察放线菌的菌丝和孢子, 并拍照。
1.2.3 内生菌En-1的分子生物学鉴定
以放线菌通用引物 F-primer (5’-AGAGTT TGATCMTGGCTCAG) 和 R-primer (5’-TACG GYTACCTTGTTACGACTT) PCR扩增全长的16S rRNA 基因(~1.5 kb)。PCR 反应体系(50 μL):1 μL F-primer (20 μmol·L-1),1 μL R-primer (20 μM),5 μL 10×酶缓冲液(不含 Mg2+),4 μL dNTPs (2.5 mmol/L),3 μL MgCl2(25 mmol·L-1),0.5 μL Taq 酶(5 U·μL-1)和 1 μL 模板 DNA 及 34.5 μL MiniQ 超纯水。PCR 反应参数:94 ℃ 5 min;95 ℃ 40 s,52 ℃30 s,72 ℃ 2 min,27 个循环;72 ℃延伸 5 min。琼脂糖凝胶电泳检测扩增的目的条带。纯化的PCR产物由南京金斯特生物科技公司进行 16S rDNA测序。
将获得的16S rDNA序列通过Blast在GenBank上进行相似性序列检索,将其序列与其高同源性(>99%)的已知菌株16S rDNA序列在Mega 4.0软件中进行分析,用neighbor-joining方法构建系统发育树。
1.2.4 红豆杉浸出液对En-1菌生长的影响
红豆杉针叶冲净后,加入装有适量双蒸水的500 mL三角瓶中煮沸15~20 min,经过滤得到宿主植物浸出液。以添加宿主植物红豆杉针叶浸出物的培养基作为实验组,未添加的培养基作为对照组,分别进行内生放线菌的震荡培养。培养1周后,离心法收获菌体,称量菌体鲜质量、干质量(以其生物量为生长指标),比较实验组和对照组的生长量,以考察宿主植物针叶浸出物是否影响内生放线菌En-1的体外生长。
1.2.5 En-1菌发酵液上清的抗菌活性测试
将灭菌的琼脂培养基完全融化倒在培养皿内,待其凝固作为下层。然后将融化的营养琼脂冷至约50 ℃混入供试菌,将混有供试菌的培养基约10 mL加到已凝固的下层琼脂上待凝(上层)。再在上层含菌培养基对称放置4个牛津杯,杯中加入离心收集的、并经滤膜(0.22 μm)除菌的En-1菌培养13~14 d的发酵液上清0.2 mL,置适宜温度下培养(若供试菌为细菌,则37 ℃培养18~24 h;若供试菌为真菌,则28 ℃培养28~48 h),观察抑菌圈大小。
1.2.6 内生放线菌的液体培养与粗提取物
内生放线菌En-1分别接种于高氏1号、PDA液体培养基各1 L,每500 mL液体培养基接入8小块含孢子的琼脂块 (4 mm×4 mm),于28 ℃,140 r/min振荡培养13~14 d后,收获培养物。离心,弃沉淀,收集上清。将合并的上清分别用等体积的乙酸乙酯萃取有机成分,然后在旋转蒸发仪(EYELAN-1000)蒸去乙酸乙酯,再通过除盐、除蜡后,得到的样品即为粗提取物。
“山高皇帝远啊,我就给你说,我们这儿摆个摊儿……政府都要管制你的,他们(购物店的人)不管的,人民币,实话实说。”○15四川省松潘县川主寺镇商店店主。
1.2.7 液体培养基的优化以及抗菌活性测试
采用不同C、N源与pH值的组合#1–9(见表1),除了表中成分外,培养基中其余成分如下:K2HPO4·3H2O 0.5 g·L, NaCl 0.5 g·L, FeSO4·7H2O 0.01 g·L-1, MgSO4·7 H2O 0.5 g·L-1, 每种配方设 3 个重复,分装于250 mL三角瓶中。摇瓶接种、振荡培养以及培养物的提取方法, 同1.2.6。将不同培养基中发酵产物的粗提物各20 mg分别溶于1 mL甲醇: 水(50:50,体积比),经0.22 μm滤膜除菌后,取0.2 mL用于牛津杯抗菌测试, 同体积(0.2 mL)的φ=50%甲醇作为对照。
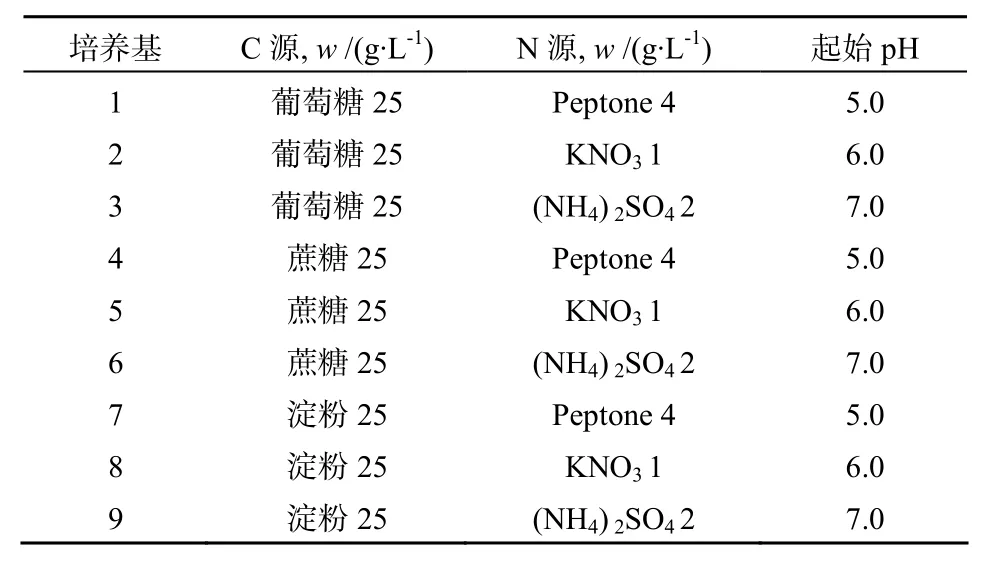
表1 内生放线菌的发酵培养基优化
1.2.81H-NMR测试
采用1H-NMR测试法对内生菌粗提物的结构多样性进行筛查。5~10 mg的粗提物溶于氘代氯仿(1H-CHCl3)或氘代二甲亚砜(1H-DMSO)溶剂,以四甲基硅烷(TMS)作为内标,在Bruker DRX-500核磁共振仪进行波谱测定。
1.2.9 统计学分析
1.2.4 中实验组和对照组En-1菌生物量的数据处理采用Excel软件计算Mean ± SD, 并用SPSS 17.0进行差异显著性分析,P <0.01被认为差异显著。
2 结果与分析
2.1 内生放线菌的分离纯化与显微观察
通过设计选择性培养基,分离得到了3株内生细菌和1株放线菌。其中放线菌(命名为En-1)引起关注,因为放线菌次生代谢物极具多样性,迄今发现的抗生素有2/3来源于放线菌, 而且有关红豆杉内生放线菌的研究报道尚少见。放线菌En-1,在高氏1号合成培养基上生长良好,幼龄时为浅灰色、表面干燥的小菌落,在生长中期,菌落颜色加深并且其上出现白色孢子堆,菌落表面出现皱褶,而培养基因为En-1分泌的色素呈现浅褚色(图1a),随菌龄增长,色素颜色转深,变成红褐色。这株放线菌在PDA平板上生长,呈表面湿润的淡黄色菌落,无色素分泌。但在接种时,发现其菌落与PDA培养基结合致密,不易用接种环挑取。可能PDA培养基不利于该菌产孢。一般而言,高氏1号合成培养基是公认的放线菌生长的适宜培养基。
放线菌在经过了生长旺盛期后,进入次生代谢(一般13~14 d)。色素为典型的放线菌次生代谢产物,故我们可通过色素的合成和分泌,判断放线菌是否处于次生代谢阶段。高氏1号合成培养基中碳源是淀粉,适于放线菌产孢。孢子堆积,使放线菌菌落形态呈现干粉状。在显微镜下观察,清晰可见波曲状的孢子链以及散落的单个圆形孢子, 孢子表面光滑(图1b)。综合平板培养特征、产生挥发性的土腥素(赋予其特殊的土腥味)和显微观察, 初步鉴定该菌为链霉菌属。
2.2 基于16SrDNA序列的内生放线菌En-1鉴定
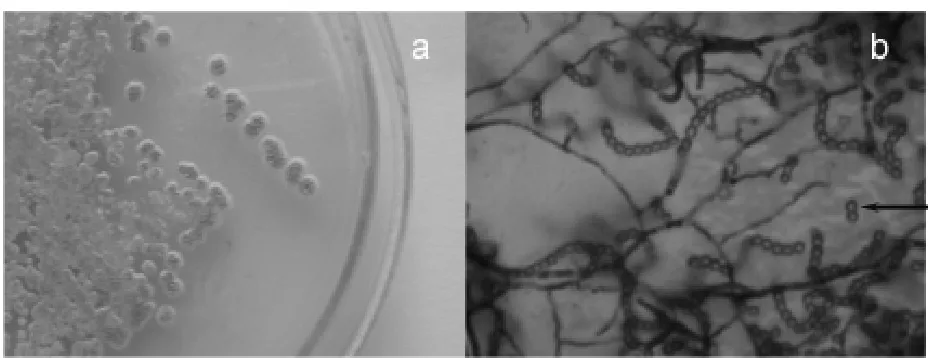
图1 内生放线菌En-1的平板培养和孢子的显微观察Fig. 1 The plating culture of endophytic actinomycete En-1 and microscopic observation of its spores
序列结果在Genbank上Blast比对后,构建的系统发育树如图2所示。基于16S rDNA序列的系统发育分析表明,与En-1菌株亲缘关系最近的是Streptomyces pseudogriseolus和 Streptomyces althioticus,可以确定En-1菌株为链霉菌Streptomyces sp.。
2.3 宿主植物浸出液促进内生放线菌En-1生长
通过添加浸出物(添加组)和未加浸出物(对照组)的摇瓶培养物生物量之比较,可考察宿主植物浸出液对内生放线菌菌体生长的影响。如图3所示,添加组中放线菌鲜质量、干质量均大于对照组(P<0.005),表明宿主组织浸出物对其该菌的初生代谢(菌体生物量)有极显著的促进作用,提示在自然生境中内生菌在宿主植物体内定殖有利于其自身生长增殖。
2.4 内生放线菌En-1发酵产物的抑菌活性
内生放线菌En-1在高氏1号培养基中震荡培养13 d,得到发酵液上清,通过琼脂扩散法测试其抑菌活性。5株供试菌分别为 3株细菌[大肠杆菌(G-)、金黄色葡萄球菌和枯草杆菌(G+)]、1株酵母状真菌(白色念球菌)、1株丝状真菌(黑曲霉)。以上供试菌因其非致病性和标准性,常用作实验室筛选人或动物病原菌的抗生素的敏感菌株。实验结果表明(图4),在黑曲霉平板上牛津杯放置的周围出现明显的抑菌圈,而其它的供试菌平板上没有出现可见的抑菌圈,说明 En-1菌发酵液上清对黑曲霉生长具有抑制作用。提示 En-1菌能产生抑制丝状真菌生长的次生代谢物,因而该菌可作为进一步提纯抗丝状真菌化合物的资源菌。
2.5 内生放线菌En-1液体培养与粗提取物
该放线菌En-1在高氏1号合成培养基的摇瓶培养物, 经离心、乙酸乙酯萃取,有机相呈亮黄色,多次萃取,至萃取相无色。该菌在 PDA摇瓶培养物, 经同样处理,萃取相呈灰黄–土黄色,萃取一次即可。提示该菌在高氏1号比在PDA培养基中产生更具多样化的次生代谢物。这点也由粗提物的NMR谱图(图5)佐证。

图2 基于16S rDNA序列的内生菌株En-1的系统发育树Fig. 2 The phylogenetic tree of endophytic actinomycete strain En-1 based on 16S rDNA sequences

图3 红豆杉针叶浸出物对内生放线菌En-1生长的影响Fig.3 The effects of Taxus needle leaf extracts on the biomass of En-1
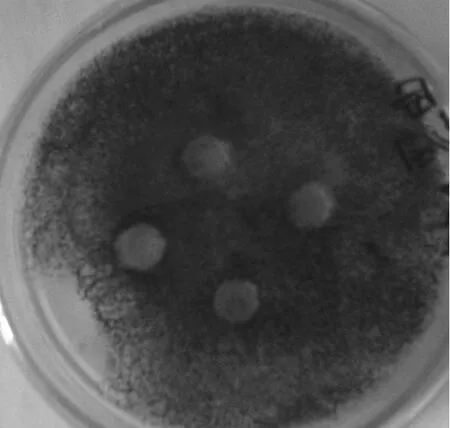
图4 内生放线菌En-1发酵产物的抑菌活性测试Fig. 4 The inhibitory effects of the En-1 fermentative products against Aspergillus niger
2.6 培养条件的优化
在9种不同培养基配方中,#1–3配方均以葡萄糖为碳源,第#1、#3培养基中该菌发酵产物的结构多样性明显优于#2培养基(图6a, 6c vs图6b)。#4–6配方均以蔗糖为碳源,第#4、#6培养基中该菌发酵产物的结构多样性(图 6d, 6f)明显少于#5培养基(图 6e);#5中的发酵产物(图 6e)在 δH5.0~5.5有一吸收峰, 可能是-C=C-上的不饱和H所致; #5中发酵产物在δH8.0左右有多个小峰, 可能是芳烃上的氢或者-N-H-、-OH基上的活泼氢所致,而且δH3~4间出现多峰。
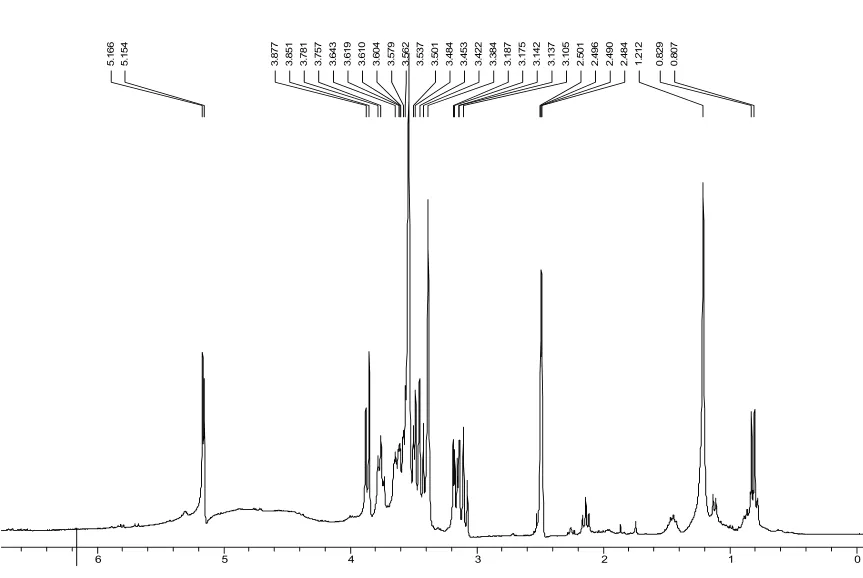
图5 内生放线菌En-1的乙酸乙酯粗提物的1H-NMR谱Fig. 5 The spectrum of ethyl acetate extracts of the fermentative filtrate of En-1 strain by 1H-NMR analysis in which the specimens were dissolved in 1H-DMSO and TMS was used as internal standard

图6 内生放线菌En-1在不同培养基中发酵液粗提物的1H-NMR图谱Fig. 6 The 1H-NMR spectra of crude extracts derived from fermentative products of En-1 in different culture media with altered formulations
#7–9配方均以淀粉为碳源,#8培养基中发酵产物的结构多样性(图 6h)明显优于#7和#9(图 6g,6i)。如图所示,#8中发酵产物的NMR谱(图6h)在δH3.5~5.0间有多个小峰, 按常理推断是糖基所致,但是 NMR测试之前样品以乙酸乙酯萃取, 后续处理也没有带入水相成分, 再之,培养基中碳源物质为淀粉(多聚物), 若淀粉被微生物分解产生少量葡萄糖等单糖成分, 也会作为速效碳源优先于迟效碳源(淀粉)被菌吸收和代谢, 况且收获发酵液时该菌已处于次生代谢期, 因此排除了该处信号峰来自培养基成分残留的可能性。文献[19]认为,δH3.5~5.0间的多重峰也可能来自C联O上的或C联N上的H。#8产物在δH5.0~5.5间的吸收峰可能来自不饱和键-C=C-上的H; 在δH6.0~8.0之间,除溶剂 CDCl3造成的吸收峰之外, 还有多个小峰, 提示苯环氢的存在; δH大于8.0的低场区还有很小的峰。总之,#8配方适于该菌次生代谢产物的产生,其产物的化学结构表现出多样性。
对不同培养基配方#1– #9中的En-1菌发酵液上清进行牛津杯抗菌试验。结果表明(图7),来自#7、#8、#9配方的放线菌En-1产物具有抑制黑曲霉的活性,以#8配方中产物的抑菌圈直径最大;而其它培养基配方中 En-1菌次生代谢物则无抑菌圈出现。
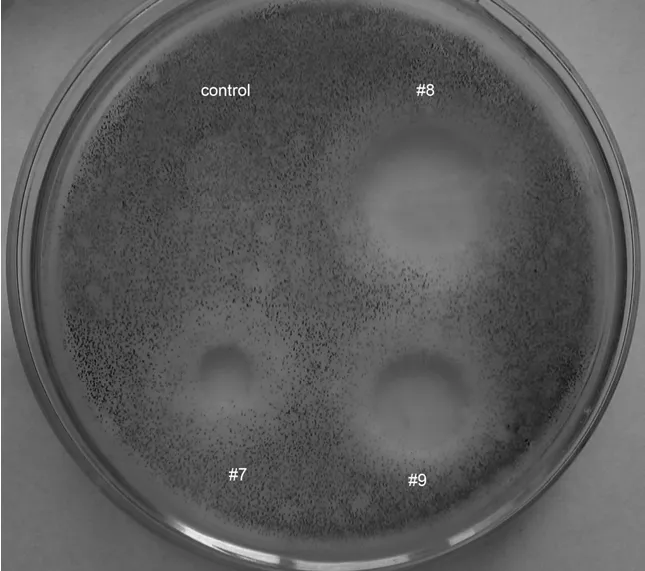
图7 En-1菌在不同培养基中发酵产物的抗菌活性测试Fig.7 The anti-microbial effects of the En-1 fermentative products derived from different culture media
基于以上结构筛查和抗菌测试结果,#8配方为En-1菌次生代谢物的最佳发酵培养基。
3 讨论
在内生菌的分离过程中, 植物样本的预处理步骤至关重要。我们用流水冲洗去掉植物材料表面的尘土,再以添加表面活性剂的水溶液处理材料表面,以便酒精、漂白粉溶液更好移去含蜡质的植物样本(如针叶)上附生菌。本文采用w=2.0%NaClO溶液处理20 min,优于HgCl2稀溶液短时处理的效果。丁小维等[11]用 w=0.1% HgCl2溶液浸泡 8 min来处理红豆杉的茎,分离得到2株内生细菌,但该文献未见内生放线菌的报道。我们采用相对温和的NaClO代替HgCl2作为主要消毒剂,避免HgCl2对植物组织的毒性,而且能达到预期消毒效果。我们采取的表面消毒程序经两种不同方法(末次清洗的水样涂板、植物样本滚动的平板培养对照实验)的验证,是彻底的、有效的。通过选择分离培养方法得到4株原核微生物,其中1株放线菌经鉴定为链霉菌Streptomyces sp.。
通过1H-NMR技术测定产物的化学结构,可知放线菌随培养条件变化,其次生代谢产物的结构也发生改变。虽然波谱分析的仍是混合物,但能给出重要结构信息:通过各成分所含H的不同化学位移(δ),推断放线菌次生代谢物的结构多样性;提示我们在筛选新化合物时,有目的进行发酵条件的优化。一般而言,菌体增长快的时期(生物量快速积累时期)绝非该菌次生代谢物合成旺盛的时期,初生代谢和次生代谢的不同步是我们在进行次生代谢物研究时必需考虑的重要因素[12-13]。可通过改变培养条件,使微生物从初生代谢转入次生代谢,产生多样化的次生代谢物;也可通过一些前体饲喂或诱导子处理,提高人们所需要的次生代谢物的产量;还可通过基因工程方法改造微生物次生代谢途径中关键酶,使微生物过量合成和/或积累某种次生代谢物[14]。
内生菌次生代谢产物的化学结构多样性蕴藏着生物活性的多样性,在制药业、农业上具有重要的应用潜力。放线菌作为药用化合物的重要来源,倍受学者和研发人员的重视[15]。从传统来源比如土壤放线菌中筛到的新药物的速度正在减缓[16-17],重复分离到已知化合物的几率在不断上升,因此寻找新的放线菌来源变得极为重要。植物内生放线菌因其生长在植物活体内,生态环境独特,与宿主植物共同进化并定殖于宿主组织细胞间隙或细胞内的放线菌必然有独特的策略来竞争和生存,通常它们会分泌化学物质或信号分子来获取营养(但对宿主植物不会产生有害影响,二者和平共处)、或者通过诱导宿主产生新的代谢产物来抵御逆境,争取生存资源,这使得内生放线菌成为结构新颖和疗效独特的药物先导化合物的重要资源之一。
在这一资源库中往往会发现一些全新的应用价值很高的抗菌化合物。Strobel研究小组近年曾在澳大利亚北部土著部落附近的药用植物蛇藤Kennedia nigriscans中分离到一株新的链霉菌 Streptomyces NRRL 30562,该菌能产生新颖的多肽抗生素munumbicins A、B、C和D,这些抗生素具有广谱抗菌以及抗疟原虫活性[19]。同一研究小组随后从澳大利亚北部的有叶蕨类植物Grevillea pteridifolia中分离到一株新的内生链霉菌Streptomyces sp. NRRL 30566, 它能产生一种具有广谱抑菌活性的新型抗菌素kakadumycins, 特别针对G+细菌抑菌能力强,因此对治疗耐药性 G+菌引起的感染症有重要价值[20]。这些都彰显了利用植物内生放线菌筛选药用抗菌活性物质的巨大潜力[6,21]。
本文报道的内生链霉菌En-1能产生抑真菌活性的次生代谢物,具有较大的应用潜力。因为En-1生活在植物体内、不对植物产生危害作用, 其产物经过与植物(高等生物)漫长的共进化过程,证明是对高等真核生物是无毒的,即宿主植物作为内生菌代谢产物的天然毒性选择系统,推断后者对于高等真核细胞的生物安全性。有研究认为[18], 以内生菌为资源库,获得对人类细胞低毒药剂的几率将大大增加。En-1菌分泌抗丝状真菌的代谢物,对于宿主植物而言是有益的,为该裸子植物(红豆杉)提供抵御真菌感染的物质基础。今后需要进一步对该菌抗菌活性物质的化学结构进行研究以及探明其抑菌机理,特别是活体内(in vivo)抑菌机制。
4 结论
通过选择性分离方法从表面消毒的中国红豆杉嫩枝、叶中分离得到内生链霉菌En-1。实验表明宿主红豆杉叶浸出物能促进 En-1菌的体外生长,而且该菌次生代谢物对5株标准供试菌中的黑曲霉具有抑制活性。En-1菌株发酵培养基优化实验并结合波谱法测定产物的结构多样性,结果显示,8# 配方(淀粉 25 g·L-1, KNO31 g·L-1, K2HPO4·3H2O 0.5 g·L-1, NaCl 0.5 g·L-1, FeSO4·7H2O 0.01 g·L-1,MgSO4·7H2O 0.5 g·L-1)为其产生次生代谢物的最佳培养基。
[1] STROBEL G, DAISY B. Bioprospecting for microbial endophytes and their natural products[J]. Microbiology and Molecular Biology Reviews, 2003, 67 (4): 491-502.
[2] 张炯炯.红豆杉植物资源的开发利用[J].生物学杂志,2000, 17(4):30-31.ZHANG Jiongjiong. The exploitation and utilization of Taxus plant resources [J]. Journal of Biology, 2000, 17(4):30-31.
[3] STIERLE A, STROBEL G, STIERLE D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew[J].Science ,1993, 260(5105): 214-216.
[4] CARUSO M, COLOMBO A L, FEDELI L, et al. Isolation of endophytic fungi and actinomycetes taxane producers [J]. Annals of Microbiology, 2000, 50: 3-13.
[5] CARUSO M, COLOMBO A L, CRESPI-PERELLINO N, et al.Studies on a strain of Kitasatospora sp. paclitaxel producer [J]. Annals of Microbiology, 2000, 50: 89-102.
[6] WU Yingying, LU Chunhua, QIAN Xiaoming, et al. Diversities within genotypes, bioactivity and biosynthetic genes of endophytic actinomycetes isolated from three pharmaceutical plants [J]. Current Microbiology, 2009, 59(4): 475-482.
[7] 沈萍,陈向东.微生物学实验[M].4版.北京:高等教育出版社, 2008.SHEN Ping, CHEN Xiangdong. Experiment of Microbiology [M]. 4th ed. Beijing: High Education Press, 2008.
[8] WANG Y, ZHANG Z, Ruan J. Phylogenetic analysis reveals new relationships among members of the genera Microtetraspora and Microbispora [J]. International Journal of Systemic Bacteriology,1996, 46(3): 658-663.
[9] GYANESHWAR P, JAMES EK, MATHAN N, et al. Endophytic colonization of rice by a diazotrophic strain of Serratia marcescens [J].Journal of Bacteriology, 2001, 183(8): 2634-2645.
[10] WANG Y, ZHANG Z S, RUAN J S, et al. Investigation of actinomycete diversity in the tropical rainforests of Singapore[J].Journal of Industrial Microbiology and Biotechnology, 1999,23(3):178-187.
[11] 丁小维, 刘开辉, 邓百万, 等. 中国红豆杉内生细菌的分离鉴定及活性研究[J]. 微生物学通报, 2008, 35(10): 1577-1580.DING Xiaowei, LIU Kaihui, DENG Baiwan, et al. The isolation and identification of endophytic bacteria from Taxus chinensis and the studies of their activity[J]. Microbiology Bulletin, 2008, 35(10):1577-1580.
[12] 刘志恒, 姜成林. 放线菌现代生物学与生物技术[M]. 北京: 科学出版社, 2004.LIU Zhiheng, JIANG Chenglin. The Modern Biology and Biotechnology of Actinomycetes [M]. Beijing: Science Press, 2004.
[13] 刘志恒. 放线菌: 微生物药物的重要资源[J]. 微生物学通报, 2005,32(6): 143-145.LIU Zhiheng. Actinomycetes: important source of drug[J].Microbiology Bulletin, 2005, 32(6): 143-145.
[14] 周军, 唐雅君, 张惠展. 放线菌次生代谢途径的设计[J]. 生物工程进展, 1999, 19(5): 40-45.ZHOU Jun, TANG Yajun, ZHANG Huizhan. The design of actinomycete secondary metabolic pathways [J]. Progress in Biotechnology, 1999, 19(5): 40-45.
[15] 黄麟, 许严伟, 匡岩巍, 等. 土壤放线菌Streptomyces sp.2215代谢物的分离鉴定及抗肿瘤活性研究[J]. 天然产物研究与开发, 2009,21(2): 235-238.HUANG Lin, XU Yanwei, KUANG Yanwei, et al. Purification and identification of antitumor secondary metabolites from soil Streptomyces sp. 2215[J]. Natural Product Research and Development,2009, 21(2): 235-238.
[16] WANG J, SOISSON SM, YOUNG K, et al. Platensimycin is a selective FabF inhibitor with potent antibiotic properties[J]. Nature, 2006,441(7091): 358-361.
[17] CLARDY J, FISCHBACHM A, WALSH C T. New antibiotics from bacterial natural products[J]. Nature Biotechnology, 2006, 24(12):1541-1550.
[18] 李强,刘军,周东坡, 等. 植物内生菌的开发与研究进展[J]. 生物技术通报, 2006, 3: 33-37.LI Qiang, LIU Jun, ZHOU Dongpo, et al. Advance on exploitation and research of endophyte [J]. Biotechnology Bulletin, 2006, 3: 33-37.
[19] CASTILLO U F, STROBEL G A, FORD E J, et al. Munumbicins,wide-spectrum antibiotics produced by Streptomyces NRRL 30562,endophytic on Kennedia nigriscans[J]. Microbiology, 2002, 148(9):2675-2685.
[20] CASTILLO U F, JAMES K H, GARY A S, et al. Kakadumycins, novel antibiotics from Streptomyces sp. NRRL 30566, an endophyte of Grevillea pteridifolia [J]. FEMS Microbiology Letters, 2003, 224(2):183-190.
[21] EL-SHATOURY S, ABDULLA H, EL-KARAALY O, et al.Bioactivities of endophytic actinomycetes from selected medicinal plants in the world heritage site of Saint Katherine, Egypt [J].International Journal of Botany, 2006, 2(3): 307-312.
