体外抗体功能修饰抑制性KIR对人NK细胞的影响
2011-10-22吴功强赵妍敏来晓瑜
吴功强,赵妍敏,黄 河,来晓瑜
(1.浙江大学医学院附属第一医院骨髓移植中心、血液研究所,浙江杭州310003;2.义乌市中心医院血液科,浙江义乌322000)
异基因造血干细胞移植(allo-HSCT)是目前恶性血液病治愈的唯一有效途径,但存在移植后移植物抗宿主病(GVHD)、复发和免疫重建等移植相关问题,尤其是如何在防止GVHD的同时诱导足够强的移植物抗白血病(GVL)作用,是目前临床移植工作者最大的难题[1-2]。许多的动物实验和临床观察均提示allo-HSCT后,由于KIR-配体不相合导致供者NK细胞活化,活化的NK细胞具有促进移植物的植入、阻止T细胞介导的GVHD、攻击宿主白血病细胞发挥GVL效应[3-4]。因此,如何人工改造或修饰KIR活性,使供者的KIR抑制性受体抑制而激活NK细胞,对改善移植疗效具有重要的意义。本研究在建立人NK细胞的体外培养体系的基础上,研究单克隆抗体封闭抑制性受体KIR2DL1和KIR2DL2/KIR2DL3后对人NK细胞功能的影响。
1 材料和方法
1.1 细胞株 人慢性粒细胞白血病细胞株K-562细胞和急性早幼粒白血病细胞株NB4细胞均为本实验室所提供,人Burkitt淋巴瘤Raji细胞株由浙江大学医学院附属第一医院血液病研究所提供。
1.2 试剂 RPMI 1640培养基和胎牛血清购于GIBCO公司,重组人白介素-2(rhIL-2)及rhIL-15购于Biolegend公司,非放射性细胞毒测定试剂盒购于Promega公司,T淋巴细胞尼龙毛柱为浙江大学免疫所赠送,丝裂霉素购于Sigma公司,TGF-β1因子ELISA检测试剂盒购自上海朗顿公司,rhGM-CSF、rhIL-4及 LPS均为浙江大学医学院附属第一心血管病研究所赠送,KIR2DL1的封闭抗体抗 CD158a单抗及KIR2DL2/KIR2DL3抗体为抗 CD158b单抗购于BD公司,人AB血清购于天津灏洋生物公司,FITC-CD3、PE-CD56购于 Invitrogen公司,X-VIVO 15培养液购于Lonza公司,Rosettesep NK提取试剂盒购自Stem cell公司。
1.3 人NK细胞分选和培养及鉴定 采用Rosettesep NK提取试剂盒分选人NK细胞,在含10%人AB血清的X-VIVO 15培养基中加入分选获得的NK细胞、200 u/ml的rhIL-2及20 ng/ml的rhIL-15,每隔2~3 d半量换液。将分选所得的NK细胞加入FITC标记的抗CD3和PE标记的CD56抗体,在室温下避光孵育15 min,流式细胞仪检测 CD3-CD56+的细胞比例。同型对照采用分选前的单个核细胞。
1.4 树突状细胞(DC)的培养 取新鲜分离的健康成人外周血,收集单个核细胞,然后悬浮于无血清RPMI-1640培养基中,将细胞转移至6孔培养板,贴壁培养2 h。将上清吸掉,然后用37℃预温的无血清RPMI-1640培养基洗弃悬浮细胞,共3遍。在贴壁细胞中加入rhGM-CSF(20 ng/ml)、rhIL-4(2 ng/ml)、15% 胎牛血清的完全培养基RPMI 1640,隔天半量换液,第5天收集悬浮细胞作为未成熟DC,加100 ng/ml的LPS继续培养2 d收集的细胞作为成熟DC。
1.5 抗体修饰对NK细胞杀伤肿瘤细胞及DC的功能实验 杀伤实验采用乳酸脱氢酶释放法(LDH),具体步骤参照非放射性细胞毒测定试剂盒说明书进行。
1.6 混合淋巴细胞反应(mixed leukocyte reaction MLR) 取健康志愿成人外周血,收集单个核细胞。正常人单个核细胞经丝裂霉素处理作为刺激细胞;取同种异体单个核细胞,经尼龙毛柱纯化得到的T淋巴细胞作为反应细胞,刺激细胞与反应细胞比例为1∶5。同时取与反应T细胞同一个体的外周血,采用Rosettesep NK提取试剂盒分选人NK细胞,与混合抗体CD158a+b(0、5、10、20 μg/ml)分别共同孵育60 min;然后,加入到混合淋巴细胞反应体系,与T细胞的比例为1∶5,种入96孔板(用于T淋巴细胞增殖反应的测定)及6孔培养板中(用于测定细胞因子水平);在培养箱中培养72 h后,在6孔培养板收集培养液上清,-80℃冻存备用。用CCK-8方法测定,具体步骤参照试剂盒说明书进行。
1.7 ELISA定量测定TGF-β1的蛋白质表达水平 在上述混合淋巴细胞培养3 d后收集上清液,具体按照ELISA试剂盒操作说明书测定。
1.8 统计学分析 采用SPSS 13.0统计软件。实验数据以均数±标准差(±s)表示,多组均数之间的比较采用单因素方差分析,两两之间的比较采用q检验。以P<0.05为差别有统计学意义。
2 结果
2.1 人NK细胞分离鉴定结果 人NK细胞分选前,外周血单个核细胞中CD3-CD56+细胞比例占10.30%,分选后提高到86.47%(图1)。

图1 人NK细胞分选前后的比较Fig.1 Percentage of NK cells before/after isolation
2.2 KIR2DL1抗体修饰对NK细胞杀伤能力的影响 如表1所示,以CD158a单抗封闭KIR2DL1后,NK细胞对NB4细胞的杀伤能力增强(8.38% ±5.23%vs 26.51% ±1.48%),随抗体浓度的增加而提高,各组间比较差异均有统计学意义(P<0.05);对Raji细胞的杀伤活性提高较小,仅 0 μg/ml组与 20 μg/ml组间比较(3.88% ±1.11%vs 13.01% ±6.56%),差异有统计学意义(P<0.05),而其余各组间比较差异无统计学意义(P>0.05);对K-562细胞的杀伤作用,则基本没有变化(P>0.05)。效靶比均为10∶1。
表1 单抗封闭KIR2DL1后NK细胞对白血病细胞的杀伤作用Table 1 Cytotoxicity of NK cell to different leukemia cells after KIR2DL1 blockade(±s,%)
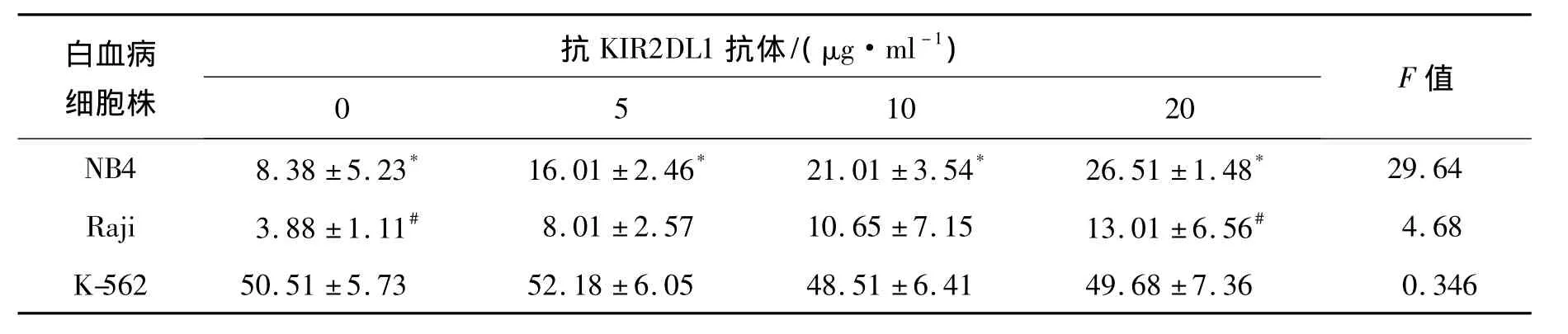
表1 单抗封闭KIR2DL1后NK细胞对白血病细胞的杀伤作用Table 1 Cytotoxicity of NK cell to different leukemia cells after KIR2DL1 blockade(±s,%)
NB4细胞各组间比较,*P<0.05;Raji细胞各组间比较,#P<0.05.
白血病细胞株抗KIR2DL1抗体/(μg·ml-1 10 20 F值)0 5 29.64 Raji 3.88±1.11# 8.01±2.57 10.65±7.15 13.01±6.56# 4.68 K-562 50.51±5.73 52.18±6.05 48.51±6.41 49.6 NB4 8.38±5.23* 16.01±2.46* 21.01±3.54* 26.51±1.48*8±7.36 0.346
2.3 KIR2DL2/2DL3抗体修饰对NK细胞杀伤能力的影响 如表2示,以抗体CD158b封闭KIR2DL2/2DL3后,NK细胞对NB4细胞的杀伤能力增强(8.72% ±4.27%vs 25.68% ±2.32%),并随抗体浓度的增加而提高,各组间差异均有统计学意义(P<0.05);对Raji细胞的杀伤活性提高较小,仅0 μg/ml组与20 μg/ml组比较(3.05% ±1.67% vs 12.51% ±4.51%),差异有显著性(P<0.05),而其余各组间比较无统计学差异(P>0.05)。对K-562细胞的作用,则基本没有变化(P>0.05)。效靶比均为 10∶1。
表2 单抗封闭KIR2DL2/2DL3后NK细胞对白血病细胞的杀伤作用Table 2 Cytotoxicity of NK cell to different leukemia cells after KIR2DL2/2DL3 blockade(±s,%)

表2 单抗封闭KIR2DL2/2DL3后NK细胞对白血病细胞的杀伤作用Table 2 Cytotoxicity of NK cell to different leukemia cells after KIR2DL2/2DL3 blockade(±s,%)
NB4细胞各组间比较,*P<0.05;Raji细胞各组间比较,#P<0.05.
白血病细胞株抗KIR2DL2/2DL3抗体/(μg·ml-1)F 0 5 10 20值36.34 Raji 3.05±1.67# 7.35±3.47 10.01±6.43 12.51±4.51# 8.13 K-562 49.01±7.26 51.38±4.52 49.22±5.82 46.3 NB4 8.72±4.27* 15.51±2.17* 19.85±2.34* 25.68±2.32*5±5.20 0.75
2.4 KIR2DL1与KIR2DL2/2DL3抗体联用对NK细胞杀伤能力的影响 如表3所示,10 μg/ml抗 CD158a单抗及 10 μg/ml CD158b 单抗封闭KIR后,NK细胞对NB4细胞的杀伤能力明显增强(8.57% ±3.57%vs 23.18% ±3.56%),2个抗体具有协同作用;而对Raji细胞的作用,虽然两个抗体联用杀伤能力有所提高(3.74% ±2.35%vs 10.34% ±5.83%),但没有达到统计学意义(P>0.05);对K-562细胞的作用,则基本没有变化,无论是单一抗体还是联用,杀伤活性均无明显改变(P>0.05)。效靶比均为10∶1。
2.5 NK细胞对DC的影响 如图2所示,在效靶比为10∶1的情况下,NK细胞经抗体封闭后,对 DC的杀伤活性明显提高(2.20% ±1.10%vs 37.59% ±5.06%),随封闭抗体浓度的增加而增高,各组间比较差异均有统计学意义(P<0.05)。

表3 单抗封闭KIR2DL1和KIR2DL2/2DL3后NK细胞对白血病细胞杀伤作用Table 3 Cytotoxicity of NK cell to different leukemia cells after KIR2DL1 and KIR2DL2/2DL3 blockade

图2 NK细胞对DC的杀伤作用Fig.2 Cytotoxicity of NK cell to DC
2.6 混合淋巴细胞反应
2.6.1 T细胞的增殖活性 如图3所示,抗CD158a与CD158b单抗封闭KIR后,反应细胞的增殖指数降低(77.85% ±8.31%vs 43.05%±5.95%)。各组与0 μg/ml组比较差异均有统计学意义(P<0.01)。NK细胞与反应细胞比例为1∶5。
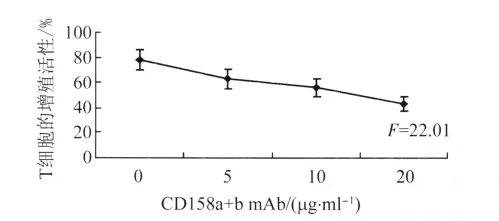
图3 混合淋巴细胞反应Fig.3 Mixed lymphocyte reaction
2.6.2 TGF-β1的表达水平 如图4所示,抗CD158a与CD158b单抗封闭KIR后,TGF-β1含量有所提高,随封闭抗体浓度的提高,各组与0μg/ml组比较差异均有统计学意义(P<0.01)。

图4 混合淋巴细胞反应中TGF-β1含量Fig.4 The levels of TGF-β1 in mixedlymphocyte reaction
3 讨论
杀伤细胞免疫球蛋白样受体(killer cell immnoglobulin—like receptor,KIR)主要分布在NK细胞表面,KIR的配体主要为HLA-I类抗原,包括HLA-A、B和C,其中主要为HLA-C类抗原。KIR可分为抑制型和活化型两大类。由于抑制型KIR与配体的亲和性较强,因此在正常情况下,KIR与自身靶细胞的HLA-I类分子相合,抑制NK细胞的活化,从而使自身正常细胞避免自身免疫。而在造血干细胞移植中,当供受者之间存在KIR-配体不相合时,则KIR的信号传递活化NK细胞功能,溶解靶细胞,即“丢失自我(missing self)假说[6]。
既往一些临床研究以及我们在非亲缘移植中发现[3-4,6],供受者之间 KIR-配体不相合时产生的活化NK细胞,具有促植入作用、发挥GVL效应以及减轻GVHD的作用。因此,供者NK细胞的活化具有十分重要的地位。在动物实验中证实,用单克隆抗体封闭抑制性KIR而导致NK细胞活化,具有促进NK细胞的抗肿瘤效应。Tajima等[7]采用 Ly49A阻断剂可明显增强Ly49A+NK细胞对表达H-2Dd的肿瘤细胞的杀伤作用。胥昀等[8]研究发现,以抗体修饰抑制性Ly49受体有助于活化NK细胞,提高抗肿瘤能力。但是,至今尚未见体外人KIR功能修饰后NK细胞杀伤活性改变的研究报道。
CD158分子是KIRs家族成员,其主要成员有CD158a和 CD158b。CD158a分子主要为KIR2DL1,CD158b分子主要为 KIR2DL2/KIR2DL3。这些KIR成员通过结合靶细胞的HLA-C位点而抑制NK细胞的杀伤活性,是NK细胞表面重要的抑制性受体。我们认为通过封闭CD158a及CD158b分子可使KIR抑制性受体无法进行抑制性信号的传递,从而激活NK细胞的杀伤活性。
本研究作为KIR功能修饰研究的体外部分,以人的NK细胞作为研究对象,研究抗体封闭抑制性受体KIR后,NK细胞杀伤活性的改变。本研究中采用的肿瘤细胞株为K-562、Raji及NB4细胞,其中 K-562细胞表面不表达HLA-ABC 分子[9];Raji及 NB4 细胞表面表达HLA-ABC分子,而且HLA-C位点均为杂合型。K-562及NB4细胞均为髓系细胞株,而Raji为淋系细胞株。实验结果提示抗体修饰KIR后,NK细胞对NB4细胞的杀伤活性明显增强。对Raji细胞影响很小。既往临床研究以及我们在非亲缘造血干细胞移植中表明,在淋系白血病移植中,供受者KIR-配体不相合并不能减少复发风险。而在非淋系白血病患者中却能明显减少复发风险,有研究表明,部分淋系白血病细胞表面缺乏或降低表达一些NK细胞表面活化受体的配体,如淋巴细胞表面缺乏黏附分子——白细胞功能相关抗原-1(leukocyte function antigen-1,LFA-1)、MICA/B和或自然杀伤细胞活化性配体UL16结合蛋白(UL16-binding proteins,ULBPs)1-3分子,导致这些淋巴细胞对NK细胞的杀伤作用不敏感[10]。本研究发现,Raji细胞耐受NK细胞的杀伤,是否Raji细胞表面降低或缺乏表达上述的一些分子的表达?我们下一步将检测Raji细胞及其他淋系细胞表面的分子表达,从而来进一步论证淋系白血病耐受NK细胞的杀伤的机制。人NK细胞对K-562具有很强的杀伤能力(达50%左右),但抗体修饰KIR后,NK细胞的对K-562杀伤活性并没有多大改变,这与其表面不表达HLAABC分子有关。
我们发现正常NK细胞对成熟的DC杀伤活性较低,基本处于耐受状态(NK细胞与DC的KIR-配体相合),但以抗体封闭KIR抑制性受体后,NK细胞对DC的杀伤活性明显提高。原因在于成熟的DC表面高表达MHC-I分子[11],因而活化前NK细胞几乎不能杀伤成熟的DC,但经抗体封闭KIR后导致KIR-配体不相合,活化NK细胞,从而对DC杀伤活性明显提高。这说明人为造成KIR-配体不相合所导致的NK细胞的活化主要是通过杀伤成熟DC,从而减少了DC将抗原递呈给T细胞,也减少了T细胞的活化。
在混合淋巴细胞反应体系中,NK细胞经不同抗体浓度封闭后,T细胞的增殖活性明显降低。我们检测反应体系中的TGF-β1表达水平,在经抗体封闭后,该因子的含量明显提高,可见TGF-β1与T细胞的增殖受抑相关。有研究表明在急性GVHD和急性移植物排斥的发生过程中,除了细胞以外,细胞因子也起重要作用[12-13]。Tamber 等[12]发现,TGF-β1 基因型高表达者其GVHD发生率较低,对GVHD有保护作用。小鼠的异基因BMT实验发现,激活的供者NK细胞抑制GVHD的部分原因可能是通过促进 TGF-β1 产生而致[14]。TGF-β1 是一个很强的免疫抑制因子,通过影响淋巴细胞的增殖分化及调节其他细胞因子的产生来发挥其免疫抑制作用[15-16]。因而,我们可以预测经抗体封闭活化后的NK细胞能通过分泌TGF-β1,进而抑制T细胞的增殖、活化,这可能也是阻止T细胞介导的aGVHD发生的机制之一。
本实验从体外角度证实了对人NK细胞上的抑制性受体进行抗体修饰后可以增强NK细胞抗肿瘤的能力,并减少T细胞的活化;推测,这可以减少GVHD的发生。下一步我们将开展体内研究,运用小鼠单克隆抗体封闭Ly49受体,在小鼠GVHD模型和白血病骨髓移植模型中研究对NK细胞的活化作用及对骨髓移植后GVHD和GVL的影响,以及KIR单克隆抗体运用于临床的前期研究。
[1]SHI Ji-min,HUANG He,CAI Zhen,et al(施继敏,黄 河,蔡 真,等).Study on unrelated donor allogeneic bone marrow transplantation with Bu-CY2 conditioning regimen for myelodysplastic syndrome[J].Journal of Zhejiang University:Medical Sciences(浙江大学学报:医学版),2006,35(2):122-126.(in Chinese)
[2]LUO Yi,PAN Jie,SHI Ji-min(罗 依,潘 杰,施继敏).Clinical observation of Gleevec combined with myeloablative allogeneic stem cells transplantation in treatment of chronic myeloid leukemia[J].Journal of Zhejiang University:Medical Sciences(浙江大学学报:医学版),2007,36(4):343-347.(in Chinese)
[3]RUGGERI L,CAPANNI M,URBANI E,et al.Effectiveness of donor natural killer cell alloreactivity in mismatched hematopoietic transplants[J].Science,2002,295(5562):2097-2100.
[4]RUGGERI L,MANCUSI A,CAPANNI M,et al.Donor natural killer cell allorecognition of missing self in haploidentical hematopoietic transplantation for acute myeloid leukemia:challenging its predictive value [J].Blood,2007,110(1):433-440.
[5]WU G Q,ZHAO Y M,LAI X Y,et al.The beneficialimpactofmissingKIR ligandsand absenceofdonorKIR2DS3 geneon outcome following unrelated hematopoietic SCT for myeloid leukemia in the Chinese population [J].Bone Marrow Transplant,45(10):1514-1521.
[6]LJUNGGREN H G,KARRE K.In search of the‘missing self’:MHC molecules and NK cell recognition [J].Immunol Today,1990,11(7):237-244.
[7]TAJIMA K,MATSUMOTO N,OHMORI K,et al.Augmentation of NK cell-mediated cytotoxicity to tumor cells by inhibitory NK cell receptor blockers[J].Int Immunol,2004,16(3):385-393.
[8]XU Yun,HUANG He(胥 昀,黄 河).Effects on activity of mouse NK cells by inhibitory Ly49 receptors blockade [J].Journal of Zhejiang University:Medical Sciences(浙江大学学报:医学版),2009,38(2):130-135.(in Chinese)
[9]ZHANG Cai,TIAN Zhi-gang,HOU Gui-hua(张彩,田志刚,侯桂华).Influence of HLA class I molecules expression on tumor cell resistance to NK lysis and the IFN-gamma regulatory effect[J].Chinese Journal of Oncology(中华肿瘤杂志),2001,23(5):369-372.(in Chinese)
[10]ROMANSKIA,BUGG,BECKERS,etal.Mechanisms of resistance to natural killer cellmediated cytotoxicity in acute lymphoblastic leukemia [J].Exp Hematol,2005,33(3):344-352.
[11]FERLAZZO G,TSANG M L,MORETTA L,et al.Human dendritic cells activate resting natural killer(NK)cells and are recognized via the NKp30 receptor by activated NK cells[J].J Exp Med,2002,195(3):343-351.
[12]TAMBUR A R,YANIV I,STEIN J,et al.Cytokine gene polymorphism in patients with graft-versushost disease [J].Transplant Proc,2001,33(1-2):502-503.
[13]VISENTAINER J E,LIEBER S R,PERSOLI L B,et al.Serum cytokine levels and acute graft-versushost disease after HLA-identical hematopoietic stem cell transplantation [J].Exp Hematol,2003,31(11):1044-1050.
[14]SEAMAN W E.Natural killer cells and natural killer T cells[J].Arthritis Rheum,2000,43(6):1204-1217.
[15]MOU H B,LIN M F,CEN H,et al.Prevention of murine acute graft-versus-host disease by recipient-derived TGFbeta1-treated dendritic cells[J].Transplant Proc,2004,36(5):1604-1606.
[16]HATTORI H,MATSUZAKI A,SUMINOE A,et al.Polymorphisms of transforming growth factor-beta1 and transforming growth factor-beta1 type Ⅱreceptor genes are associated with acute graftversus-host disease in children with HLA-matched sibling bone marrow transplantation [J].Bone Marrow Transplant,2002,30(10):665-671.
