琐琐葡萄总黄酮在体外对乙型肝炎病毒的影响
2011-10-18李海波
刘 涛,马 龙,*,赵 军,李海波
(1.新疆医科大学公共卫生学院毒理学教研室,新疆 乌鲁木齐 830011;2.新疆维吾尔自治区药物研究所,新疆 乌鲁木齐830004;3.江苏省南通市疾病预防控制中心,江苏 南通 226006)
琐琐葡萄总黄酮在体外对乙型肝炎病毒的影响
刘 涛1,马 龙1,*,赵 军2,李海波3
(1.新疆医科大学公共卫生学院毒理学教研室,新疆 乌鲁木齐 830011;2.新疆维吾尔自治区药物研究所,新疆 乌鲁木齐830004;3.江苏省南通市疾病预防控制中心,江苏 南通 226006)
目的:考察琐琐葡萄总黄酮体外抗乙型肝炎病毒(HBV)的效果。方法:用HBV DNA转染人肝癌细胞所得的HepG 2.2.15细胞株为模型,ELISA法测定用药后8d细胞培养上清液中HBsAg和HBeAg含量,计算琐琐葡萄总黄酮对HBsAg和HBeAg分泌的抑制率,荧光定量PCR法测定HBV DNA的变化,MTT比色法检测细胞毒性。结果:琐琐葡萄总黄酮在12.5~100μg/mL范围内,均能不同程度地减少细胞培养上清液中HBsAg和HBeAg的含量,且细胞毒性小,半数中毒剂量(TC50)为284.91μg/mL,对HBsAg半数有效剂量(IC50)为327.56μg/mL、对HBeAg为215.34μg/mL,对HBsAg治疗指数(TI)为0.87、对HBeAg治疗指数为1.32;总黄酮质量浓度100μg/mL时对HBV DNA的抑制率为47.63%。结论:琐琐葡萄总黄酮具有一定的体外抗HBV作用。
琐琐葡萄;总黄酮;乙型肝炎病毒;细胞培养
乙型肝炎病毒(HBV)感染不仅会导致急慢性乙型肝炎的发生,而且与肝硬化、原发性肝癌关系密切。近年来,国内外对传统天然药物的抗病毒研究日益重视,抗乙肝病毒药物研究虽然取得了一些进展,但目前仍缺乏比较理想的治疗药物[1]。因此,从丰富的中草药植物资源中寻找新的有效抗HBV药物,已成为我国抗病毒中药发展的必然趋势。1987年,美国Sells等[2]将带有HBV DNA全基因组及抗G418的重组质粒转染人肝癌细胞株Hep G建立了2.2.15细胞株,它能长期稳定地向细胞培养上清液中分泌HBsAg、HBeAg和完整的Dane’s颗粒,是目前体外筛选和评价抗乙肝病毒药物较理想的细胞模型[3]。黄酮是维吾尔药琐琐葡萄(Vitis vinifer L.)的主要组成成分之一[4],具有调节免疫[5]、抗氧化[6]、抗肿瘤[7]、抗病毒[8]、抗辐射[9]等多种生物活性。课题组前期研究显示琐琐葡萄总黄酮对免疫性肝损伤具有较好的保护作用[10],且对肝癌细胞HepG2的增殖具有显著的抑制作用[11]。为探讨琐琐葡萄总黄酮的抗HBV效应,本实验以Hep G 2.2.15细胞株为模型,研究琐琐葡萄总黄酮在体外抗HBV的生物活性。
1 材料与方法
1.1 材料与试剂
HepG 2.2.15细胞株购自武汉大学物种保藏中心,传代于高糖DMEM培养基(每1000mL含100万单位青霉素、1.0g链霉素、100mg G418和10%灭活胎牛血清)中培养。
DMEM培养基、G418(Geneticin)、青霉素-链霉素美国Gibco公司;胎牛血清 杭州四季青生物制品公司;HBsAg和HBeAg ELISA检测试剂盒 上海华美生物工程公司;HBV DNA荧光定量PCR检测试剂盒 上海申友生物技术有限公司;噻唑蓝(MTT) 美国Amresco公司;二甲基亚砜(DMSO)、0.025%胰蛋白酶-EDTA美国Sigma公司;拉米夫定(3-TC,批号06120028) 葛兰素史克制药苏州有限公司。
1.2 仪器与设备
CO2培养箱 美国Napco公司;XD-2倒置显微镜重庆光电仪器有限公司;生物安全柜 美国Labconco公司;XD 711型酶标仪 上海迅达医疗器械有限公司;Thermo IEC冷冻高速离心机 美国热电公司;Opticon实时荧光定量PCR仪 美国MJ Research公司;AB104-N型分析天平 Mettler-Toledo上海有限公司。
1.3 琐琐葡萄总黄酮的制备
琐琐葡萄药材粉碎后以去离子水回流提取2次,每次1h,合并提取液,减压浓缩至一定量,加入5倍体积95%乙醇,充分混匀,静置12h,过滤得滤液A。药渣以8倍量95%乙醇回流提取2次,每次1h,合并提取液,减压浓缩至浸膏,浸膏以水混悬后,石油醚萃取脱脂,再经乙酸乙酯萃取,其中乙酸乙酯部分减压浓缩后,以95%乙醇溶解,放置12h,析出沉淀,过滤得滤液B;滤液A、滤液B及乙酸乙酯萃取后液体合并,减压浓缩,上AB-8 型大孔吸附树脂,依次以水、50%和95%乙醇进行梯度洗脱,收集50%乙醇洗脱馏分,减压浓缩,真空干燥,即得琐琐葡萄总黄酮。按参考文献[12]方法测定其总黄酮含量为35.28%。
1.4 细胞毒性实验
细胞接种48h后,倾去培养基,分别加入含不同质量浓度样品培养基培养,第4天换含同样样品的培养基,8d后加入5mg/mL的MTT溶液,每孔10μL,37℃孵育4h后,加入DMSO,每孔150μL,混匀,使甲臢完全溶解,用酶标仪在490nm波长处测定吸光度(A给药组)。以相同条件、相同体积不含样品的培养基培养的细胞作为对照,测定其吸光度(A细胞对照组),按公式(1)计算细胞抑制率,求出半数中毒剂量(TC50)。空白组为测定时平行操作的空白对照组,测定吸光度(A空白组)。

1.5 药物活性实验
实验设无药物细胞对照组、不同质量浓度药物组及阳性对照组和空白对照组。HepG 2.2.15细胞接种48h后,倾去培养基,各质量浓度药物组分别加入含琐琐葡萄总黄酮(100、50、25、12.5μg/mL)的培养基、各质量浓度阳性对照组分别加入含3-TC(100、10、1μg/mL)的培养基,每孔200μL,每个质量浓度3个复孔,同时每板各设6个细胞对照孔加入同体积无药物培养基作为细胞对照组,置37℃,5% CO2培养箱中培养,每4d换含同样样品的培养基,第8天分别收集细胞培养上清液,置-20℃保存备用,待测HBsAg、HBeAg和HBV DNA。
1.6 HBsAg和HBeAg的检测
采用ELISA试剂盒测定细胞培养上清液中HBsAg和HBeAg的浓度,以P/N(即样品的吸光度与空白对照吸光度的比值)表示。根据公式(2)计算各浓度药物对HBsAg和HBeAg的抑制率,计算半数有效浓度IC50。
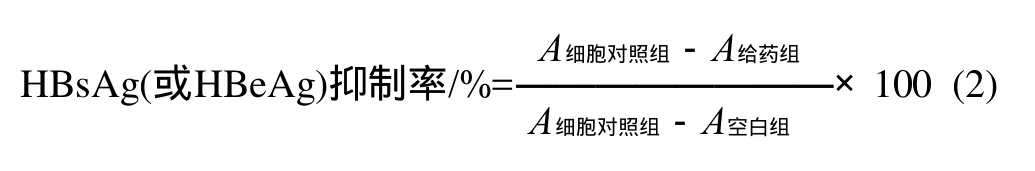
式中:A给药组为不同质量浓度的药物实验组的吸光度;A空白组为试剂盒测定时不加酶结合底物而平行操作的空白对照组;A细胞对照组为不加药物处理的细胞对照组。
结合细胞毒性实验所得TC50计算各样品的治疗指数(TI),综合判断药物效果。TI= TC50/IC50,TI>2为有效低毒;1<TI≤2为低效有毒;TI≤1为受试物毒性大,不宜于用于抗HBV治疗。
1.7 HBV DNA的测定
按照HBV DNA荧光定量PCR试剂盒说明书操作,测定细胞培养上清液中HBV DNA的拷贝数。根据公式(3)计算各受试物对HBV DNA的抑制率。

式中:C给药组为不同质量浓度的药物实验组的HBV DNA拷贝数;C细胞对照组为不加药物处理的细胞对照组的HBV DNA拷贝数。
2 结果与分析
2.1 琐琐葡萄总黄酮对HepG 2.2.15细胞的毒性作用
MTT法测定细胞抑制率,结果显示琐琐葡萄总黄酮及3-TC对Hep G 2.2.15细胞的毒性较小,其TC50分别为284.91μg/mL 和244.77μg/mL(表1、2)。

表1 琐琐葡萄总黄酮体外抗HBV效果Table 1 Inhibition effects of total flavones from Vitis vinifer L. on HBV in vitro

表2 琐琐葡萄总黄酮的治疗指数Table 2 Therapeutic indexes of total flavones from Vitis vinifer L. for HBsAg and HbeAg
2.2 琐琐葡萄总黄酮对HBsAg和HBeAg分泌的影响
在琐琐葡萄总黄酮和3-TC对HepG 2.2.15细胞分泌HBsAg的IC50分别为327.56μg/mL和315.37μg/mL,其TI为0.87和0.78;对HBeAg的IC50分别为215.34μg/mL和9051.01μg/mL,其TI分别为1.32和0.03,提示在此实验条件下,琐琐葡萄总黄酮抑制HepG 2.2.15分泌HBsAg和HBeAg的效果均优于3-TC(表1、2)。
2.3 琐琐葡萄总黄酮对HBV DNA的影响
琐琐葡萄总黄酮对HepG 2.2.15细胞分泌HBV DNA的抑制作用随质量浓度的增大而逐渐增强,而3-TC可显著抑制HBV DNA的分泌,各质量浓度组DNA拷贝数<103,超出试剂盒检测下限(表1)。
3 讨 论
琐琐葡萄为葡萄科小无核红葡萄品系药食兼用植物,药用果实,主产于我国新疆吐鲁番、和田、鄯善等地[13];在维吾尔医临床主要应用于脾胃不和、头晕腰酸、神志不安以及小儿麻疹和肝炎等病症的治疗[14-15],为探讨琐琐葡萄的抗病毒药效,本研究应用Hep G 2.2.15细胞株对琐琐葡萄总黄酮进行了抗HBV活性筛选,结果显示:琐琐葡萄总黄酮用药8d后,对HepG 2.2.15细胞分泌HBsAg、HBeAg具有显著抑制作用,半数有效剂量(IC50)HBsAg为327.56μg/mL、HBeAg为215.34μg/mL,治疗指数(TI)分别为HBsAg 0.87、HBeAg 1.32,抑制效果均优于阳性对照药物拉米呋啶,且药物细胞毒性较小,半数中毒剂量(TC50)为284.91μg/mL;而琐琐葡萄总黄酮对HBV DNA也表现出一定的抑制作用,在100μg/mL时抑制率达到47.63%。细胞培养具有易于控制实验条件和均衡性好的特点,但体外实验研究结果不能反映体内所特有的免疫调节及代谢对药物效果的影响。因此,本研究结果虽然显示琐琐葡萄总黄酮在体外具有一定的抗HBV生物学活性,与维吾尔医临床应用效果相一致,但进一步证实其抗病毒作用还须结合体内实验来确定,其作用机制也有待于深入研究。
[1] 王灵台. 中西医治疗慢性乙型肝炎的问题和对策[J]. 中国中西医结合杂志, 2009, 29(7): 583-584.
[2] SELLS M A, CHEN M L, ACS G, et al. Production of hepatitis B virus particles in HepG2 cells transfected with cloned hepatitis B virus DNA[J]. Proc Natl Acad Sci USA, 1987, 84(4): 1005-l009.
[3] 成军, 斯崇文. HBV DNA转然细胞系的建立及应用研究进展[J]. 国外医学: 流行病与传染病分册, 1994, 21(2): 60-64.
[4] 马龙, 刘涛, 向阳, 等. 新疆葡萄中3种生物活性物质的含量分析[J].中国食品卫生杂志, 2006, 18(1): 28-31.
[5] 汪敏, 王维民, 谌素华. 芒果皮黄酮的免疫调节作用[J]. 食品研究与开发, 2010, 31(8): 23-25.
[6] 王海敏, 虞海霞, 董蕊, 等. 苕子蜜总酚酸和总黄酮含量测定及抗氧化活性的研究[J]. 食品科学, 2010, 31(1): 54-57.
[7] 王岚, 康琛, 杨伟鹏, 等. 藤梨根正丁醇提取物和总黄酮苷抗肿瘤作用研究[J]. 中国中药杂志, 2010, 35(16): 2184-2186.
[8] 何忠梅, 白冰, 王慧, 等. 千里光总黄酮体外抗肿瘤和抗病毒活性研究[J]. 中成药, 2010, 32(12): 2045-2047.
[9] 雷筱芬, 陈木森. 黄酮类化合物抗辐射研究进展[J]. 江西农业大学学报, 2007, 29(6): 1039-1042.
[10] 刘涛, 马龙, 赵军, 等. 琐琐葡萄总黄酮对小鼠免疫性肝损伤保护作用的研究[J]. 新疆医科大学学报, 2007, 30(11): 1226-1229.
[11] 张琳, 马龙, 刘涛, 等. 琐琐葡萄提取物多糖、黄酮对肝癌细胞HepG2的增殖抑制作用[J]. 新疆医科大学学报, 2009, 32(5): 529-532.
[12] 中华人民共和国国家药典委员会编. 中国药典: 一部[M]. 北京: 化学工业出版社, 2005: 247.
[13] 刘勇民. 维吾尔药志[M]. 乌鲁木齐: 新疆科技卫生出版社, 1999: 496.
[14] 新疆维吾尔自治区卫生厅. 维吾尔药材标准:上册[M]. 乌鲁木齐: 新疆科技卫生出版社, 1993: 41.
[15] 刘涛, 马龙, 堵年生. 葡萄的生物学作用研究进展[J]. 自然杂志, 2002,249(2): 84-85.
Inhibitory Effects of Total Flavones from Vitis vinifer L. on Hepatitis B Virus in vitro
LIU Tao1,MA Long1,*,ZHAO Jun2,LI Hai-bo3
(1. Department of Toxicology, College of Public Health, Xinjiang Medical University,830011, China;2. Institute of Materia Medica of Xinjiang,830004, China;3. Nantong Center for Disease Control and Prevention, Nantong 226006, China)
Objective: To investigate the inhibitory effects of total flavones from Vitis vinifer L. on hepatitis B virus (HBV)replication and their toxicity in cultured human hepatocellular liver carcinoma cell line HepG 2.2.15 transfected with HBV DNA.Methods: After 8 days of treatment with total flavones from Vitis vinifer L., the contents of HBsAg and HBeAg in the cell culture supernatant of HepG 2.2.15 were measured by ELISA to calculate the inhibitory rates against the secretion of HBsAg and HBeAg, the change in HBV DNA was monitored by real-time PCR, and cytotoxicity test was performed using MTT assay.Results: Addition of total flavones from Vitis vinifer L. in a dosage range of 12.5 to 100μg/mL could reduce the contents of HBsAg and HBeAg in the cell culture supernatant of HepG 2.2.15 to different extents. Little cytotoxic effect was observed with a median toxic concentration (TC50) of 284.91 μg/mL. The median effective doses (IC50) on HBsAg and HBeAg were 327.56 μg/mL and 215.34 μg/mL, and the therapeutic index for HBsAg and HbeAg were 0.87 and 1.32, respectively. Total flavones from Vitis vinifer L. at 100 μg/mL could inhibit HBV DNA by 47.63%. Conclusion: Total flavones from Vitis vinifer L. have inhibitory effects on HBV in vitro.
Vitis vinifer L;flavones;hepatitis B virus;cell culture
R965
A
1002-6630(2011)05-0270-03
2010-06-17
国家自然科学基金项目(30660157)
刘涛(1974—),女,副教授,博士,主要从事新疆特色药食兼用植物开发应用基础研究。E-mail:xjmult@sina.com
*通信作者:马龙(1957—),男,教授,硕士,主要从事新疆特色药食兼用植物开发应用基础研究。E-mail:xjmult@163.com
