表面活性剂稳定性碱性蛋白酶纯化及性质研究
2011-10-18高兆建侯进慧
高兆建,李 超,侯进慧
(徐州工程学院食品(生物)工程学院,江苏 徐州 221008)
表面活性剂稳定性碱性蛋白酶纯化及性质研究
高兆建,李 超,侯进慧
(徐州工程学院食品(生物)工程学院,江苏 徐州 221008)
从地衣芽孢杆菌(Bacillus licheniformis)XG12发酵液中分离纯化表面活性剂稳定性碱性蛋白酶,并对酶学性质进行研究。利用硫酸铵分级盐析、DEAE-Sepharose阴离子交换层析和Sephadex G-75分子筛凝胶过滤层析等方法,分离纯化到了均一的酶蛋白,酶纯度提高了42.6倍,回收率为25.3%。SDS-PAGE及Sephadex G-75分子筛凝胶过滤层析显示酶蛋白为单亚基蛋白,分子质量约为29.5kD。在pH7.0~11.0范围内酶活性及稳定性较高,最适作用pH值为10.0,最适作用温度40℃。Mg2+、Ca2+及Mn2+对酶有明显激活作用。丝氨酸蛋白酶特异性抑制剂强烈抑制酶活性,表明所纯化到的蛋白酶为丝氨酸蛋白酶。酶分别对终质量浓度为0.1g/100mL的阴离子表面活性剂SDS、阳离子表面活性剂CTAB和体积分数为1%的非离子型表面活性剂Tween-80、Tween-20、Triton X-100以及氧化剂均具有很强的稳定性。
地衣芽孢杆菌XG12;碱性蛋白酶;分离纯化;表面活性剂;酶学性质
蛋白酶是一类重要的工业水解用酶,年销售量约占世界酶销售总量的60%[1],从工业用酶角度考虑,蛋白酶是最为重要的一类水解酶。它广泛应用于工业生产的众多行业中,如洗涤剂、食品加工、动物饲料、制药、制革、诊断试剂、蚕丝脱胶、多肽合成及污水处理等领域[2-3]。具有重要工业应用价值的蛋白酶主要从微生物中获得,而认为相对安全的芽孢杆菌属和黑曲霉属微生物是蛋白酶的主要来源。近年来,因芽孢杆菌属微生物蛋白酶高产量、高稳定性等优势,人们越来越倾向于芽孢杆菌属蛋白酶的研究[4]。近年来已经从克劳氏芽孢杆菌(Bacillus clausii)[5]、莫哈韦芽孢杆菌(Bacillus mojavensis A21)[6]、嗜盐芽孢杆菌(haloalkaliphilic Bacillus sp.)[7]等芽孢杆菌属微生物中分离到表面活性剂稳定性蛋白酶。这些蛋白酶能否在食品加工以及其他行业中使用还受到诸多因素的限制,如环境pH值、温度、氧化剂以及金属离子等对蛋白酶活性及稳定性的影响。
本实验室分离到一株产生表面活性剂稳定性蛋白酶的地衣芽孢杆菌(Bacillus licheniformis)XG12,初步研究发现该菌株所产蛋白酶稳定性较好。地衣芽孢杆菌表面活性剂稳定性丝氨酸碱性蛋白酶的研究在国内外尚未见同类报道。本研究报道了该酶的分离纯化和酶学性质。
1 材料与方法
1.1 试剂与仪器
DEAE-Sepharose、Sephadex G-75 瑞典 Amersham pharmacia公司;其他常规试剂均为国产或进口分析纯。
蛋白电泳槽 美国Bio-Rad公司;GR21G型落地式冷冻离心机 日本日立公司。
1.2 菌种与培养基
蛋白酶高产菌株由本实验室分离筛选得到,经鉴定并命名为Bacillus licheniformis XG12。
培养基和培养条件:接种适量的B. licheniformis XG12菌悬液于产酶培养基(葡萄糖10g/L、蛋白胨5g/L、CaCl22g/L、MgSO4·7H2O 0.01g/L、KH2PO40.1g/L、K2HPO40.5g/L、酵母浸膏2g/L、NaCl 0.15g/L、FeSO4·7H2O 0.01g/L、MnSO4·4H2O 0.01g/L)中,pH10.0,40℃,200r/min培养48h。发酵培养物在4℃条件下8000r/min离心15min,去除细胞,上清液作为粗酶液进行下面的分离纯化操作。
1.3 酶的分离纯化
将发酵液离心取上清液,进行硫酸铵分级盐析(40%~70%饱和度),沉淀溶于20mmol/L的Tris-HCl缓冲液(pH8.0)中,对相同的缓冲液充分透析,12000r/min离心10min后,取2mL离心后的上清液上样DEAESepharose fast flow (2.5cm×30cm)阴离子交换柱,用0~1.0mol/L的NaCl溶液(20mmol/L Tris-HCl,pH8.0)进行线性梯度洗脱,洗脱速度为0.6mL/min。测定各收集管洗脱液的酶活力。合并有活性的收集管,装入透析袋,用聚乙二醇20000进行包埋,浓缩后取0.6mL样品上样Sephadex G-75 (1.6cm×90cm)分子筛凝胶柱,用0.02mol/L NaCl(溶于20mmol/L Tris-HCl,pH8.0)溶液进行洗脱,洗脱速度为0.4mL/min。收集有酶活性部分检测酶纯度及用于酶学性质的研究。
1.4 酶活性测定
参考Kembhavi等[8]的方法,并对其略有修改。取0.5mL待测酶液加入到1mL含有1g/100mL干酪素的20mmol/L的甘氨酸-NaOH缓冲溶液(pH10.0)中,40℃水浴保温15min后,加入1mL 10g/100mL的三氯乙酸溶液终止反应,再将以上混合物置于室温存放15min,12000r/min离心15min去除沉淀。上清液采用福林-酚试剂法测定蛋白质含量。标准曲线是以0~50mg/L的酪氨酸制作。空白对照为加入三氯乙酸溶液后再加入酶液,其他同上面一样。蛋白酶活性的定义:1个单位的蛋白酶活性为在实验条件下每分钟干酪素释放lμg酪氨酸所需的酶量。所有的测定都重复3次,取其平均值。
1.5 蛋白浓度测定
采用Lowry法[9],以牛血清白蛋白制作标准曲线对蛋白浓度进行定量。
1.6 分子质量的测定
1.6.1 凝胶过滤
蓝色葡聚糖上样Sephadex G-75凝胶色谱柱,测定柱空隙体积(Vo),然后上样标准蛋白及样品蛋白,测定各蛋白的洗脱体积(Ve),以各标准蛋白的洗脱体积同柱空隙体积的比率(Ve/Vo)同标准蛋白的分子质量对数(lgMW)制作标准曲线。然后从标准曲线中求出该蛋白酶的表观分子质量。标准蛋白为兔磷酸化酶B、牛血清白蛋白、兔肌动蛋白、胰蛋白酶抑制剂、鸡蛋清溶菌酶作标准蛋白。
1.6.2 SDS-PAGE凝胶电脉
按Laemmli[10]的方法进行SDS-PAGE凝胶电脉,分离胶质量分数12%,浓缩胶质量分数5%。将样品及标准蛋白(兔磷酸化酶B(97400D)、牛血清白蛋白(66200D)、兔肌动蛋白(43000D)、牛碳酸酐酶(31000D)、胰蛋白酶抑制剂(20100D)、鸡蛋清溶菌酶(14400D))进行SDS-PAGE电泳,然后以相对迁移率对分子质量作图,从图中求出该蛋白酶的分子质量。
1.7 蛋白酶性质研究
1.7.1 温度和pH值对酶活性的影响
蛋白酶最适温度的测定在0.02mol/L的甘氨酸-NaOH缓冲溶液(pH10.0)中,不同温度(10~90℃)条件下进行酶促反应。热稳定性测定是将酶在不同温度(40~80℃)条件下保温120min,从开始每隔30min 取出一支试管,于冰水中冷却后,按照1.4节方法测定残余酶活力。以未经过热保温的酶液作为空白对照(100%),计算相对酶活力。
纯化后的蛋白酶在不同pH6.0~12.0条件下进行酶促反应以测定其最适pH值。测定pH值稳定性是将酶液加入到20mmol/L的不同pH值缓冲液中,再于40℃保温1h,然后按照1.4节方法测定剩余蛋白酶的活力,计算相对酶活力。所用缓冲液为:pH6.0~7.5的磷酸氢二钠-磷酸二氢钠缓冲液,pH8.0~8.5的Tris-HCl缓冲液,pH9.0~10.5的甘氨酸-氢氧化钠缓冲液,pH11.0~12.0的磷酸氢二钠-氢氧化钠缓冲液。
1.7.2 金属离子、抑制剂和表面活性剂对酶活力的影响
取适当稀释的酶液,向其中分别加入用蒸馏水配制的金属盐溶液,使金属离子终浓度达到5mmol/L,40℃保温1h后,按1.4节方法测定残余酶活力。
将各种不同的酶抑制剂与纯化后的酶液混合达到一定终浓度,在40℃孵育1h后,按照按1.4节方法测定残余相对酶活力。
为测定表面活性剂对酶稳定性的影响,将纯化后的酶液同不同浓度不同表面活性剂、氧化剂在40℃孵育1h,再以1.4节方法测定残余相对酶活力。以上均以不加金属离子、表面活性剂、氧化剂及抑制剂的酶液作为空白对照(100%)。
2 结果与分析
2.1 蛋白酶的分离纯化
发酵液离心分离菌体,上清液采用40%~70%饱和度硫酸铵分级盐析后,得到的沉淀蛋白溶解在20mmol/L Tris-HCl(pH8.0)缓冲溶液中。充分透析后,发酵液中大部分的黄褐色色素及部分杂蛋白被分离到透析液中,同时粗酶液深度浓缩。样品上样阴离子交换柱DEAESepharose FF,缓冲溶液充分洗脱,去除未结合的杂蛋白,A280nm在0.02以下时,改用NaCl线性梯度洗脱,洗脱曲线如图1所示。

图1 DEAE-Sepharose FF离子交换层析Fig.1 DEAE-Sepharose fast flow ion exchange chromatography of the protease
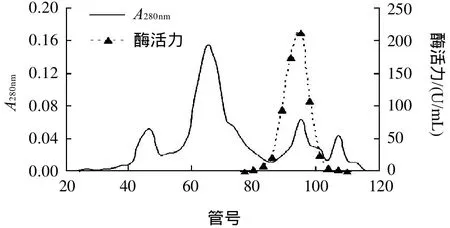
图2 Sephadex G-75分子筛凝胶过滤层析Fig.2 Sephadex G-75 gel filtration chromatography of the protease
由图1可知,洗脱得到一个大的主峰和3个小的蛋白峰。经检测,大的主峰没有酶活性,而第一个小峰检测到强的蛋白酶活力。从蛋白洗脱曲线及收集管颜色判断,样品中大部分杂蛋白及残余色素经该柱层析后,完全同酶蛋白分开。酶蛋白洗脱出的NaCl浓度约为0.4mol/L。合并含酶活力的收集管,浓缩后,上样分子筛凝胶柱Sephadex G-75,洗脱得到4个小的蛋白峰。检测到第3个蛋白峰含有较强酶活性(图2)。经过以上纯化步骤后,蛋白酶比活力达到1695.5U/mg,纯化了42.6倍,回收率25.3%(表1)。

表1 地衣芽孢杆菌XG12蛋白酶的分离纯化Table 1 Isolation and purification of the alkaline protease from B. licheniformis XG12
经过以上各步分离纯化的酶液SDS-PAGE检测,结果见图3。最后分离纯化后的酶液电泳显示单一条带,表明酶蛋白达到电泳纯,同标准分子质量蛋白对照显示,蛋白酶表观分子质量约为29.5kD,与通过Sephadex G-75色谱柱测得的分子质量相一致。由此推断,纯化到的蛋白酶是单亚基蛋白。微生物来源的碱性蛋白酶分子质量一般在15~36kD。菌株XG12蛋白酶与报道的碱性蛋白酶相比较,比源于枯草芽孢杆菌(Bacillus subtilis PE-11)(15kD)[11]、库特氏菌(Kurthia spiroforme sp.)(8kD)[12]的蛋白酶分子质量要大,但小于来自嗜盐嗜碱芽孢杆菌(Bacillus sp.)(30~32kD)[7]的蛋白酶分子质量。
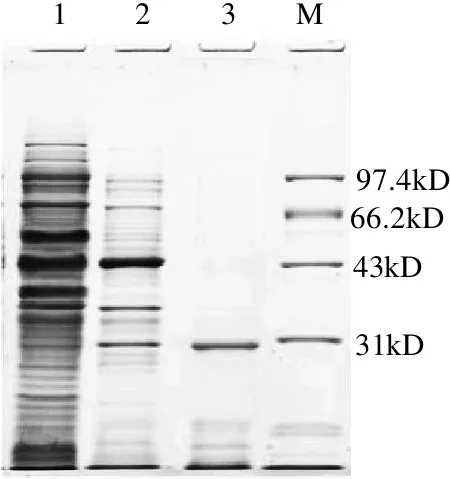
图3 地衣芽孢杆菌XG12蛋白酶SDS-PAGE图谱Fig.3 SDS-PAGE of the fractions containing B. licheniformis XG12 protease obtained from successive purification steps
2.2 蛋白酶的酶学性质
2.2.1 蛋白酶最适作用温度及热稳定性

图4 温度对地衣芽孢杆菌XG12蛋白酶活性的影响Fig.4 Effect of temperature on B. licheniformis XG12 protease activity
如图4所示,在温度20~60℃范围内,都具有较强活性,相对酶活力都在80%以上,而在60℃以上或20℃以下,所测酶活性较低。酶最适作用温度为40℃,比所报道的大部分芽孢杆菌蛋白酶最适温度都要低,如短小芽孢杆菌(Bacillus pumilus)(60℃)[13]、莫哈韦芽孢杆菌(Bacillus mojavensis)(60℃)[14]、嗜热芽孢杆菌(thermophilic Bacillus sp. PS719)(75℃)[15]等。蛋白酶在较低的温度下具有高活力,从节约能源角度考虑,具有重要意义。将蛋白酶添加到食品原料中,在降低温度条件下,可以达到更好的水解效果。

图5 温度对地衣芽孢杆菌XG12蛋白酶稳定性的影响Fig.5 Effect of temperature on B. licheniformis XG12 protease stability
如图5所示,此蛋白酶在40~60℃非常稳定,经过90min的孵育后,残余相对酶活力都在80%以上。但在80℃条件下孵育30min,残余酶活会大幅度降低。整体而言,同所报道的其他微生物如嗜盐嗜碱芽孢杆菌(haloalkaliphilic Bacillus sp.)[7]、棒曲霉(Aspergillus clavatus ES1)[16]等蛋白酶比较,地衣芽孢杆菌XG12蛋白酶热稳定性较好,在常规的食品加工时间内温度即使上升到60℃蛋白酶活性也不会大幅下降。
2.2.2 蛋白酶的最适作用pH值及稳定性
纯化后的蛋白酶在不同pH值的缓冲体系中,40℃条件下测定酶活性,结果如图6所示,蛋白酶在pH7.5~11之间所测相对酶活力均在在70%以上,最适作用pH值与所报道的枯草芽孢杆菌蛋白最适pH值一致[11],为pH10.0,具有典型的碱性蛋白酶特征[17-18],故地衣芽孢杆菌XG12蛋白酶属于碱性蛋白酶。而文献所报道的如从蜡状芽孢杆菌(Bacillus cereus BG1)、绿脓杆菌PseA(Pseudomonas aeruginosa PseA)[19-20]等菌株来源的碱性蛋白酶最适pH值在8.0~9.0之间,当超过10.0时,活性几乎完全丧失。

图6 pH值对地衣芽孢杆菌XG12蛋白酶活性及稳定性的影响Fig.6 Effect of pH on B. licheniformis XG12 protease activity and stability
如图6所示,酶的pH值稳定性曲线同活性曲线基本一致,在pH7.0~11.0之间保持85%以上的酶活性,而在pH7.0以下,酶活性则急速下降,表明蛋白酶在碱性环境下非常稳定。
2.2.3 金属离子对酶活性的影响
从表2可见,Cu2+、Fe2+、Hg2+在所检测范围内可以抑制30%~60%的酶活性,Zn2+对酶的抑制活性较弱;Ba2+、Na+、K+对酶活性的影响不明显;Mg2+、Ca2+、Mn2+对蛋白酶有较强的激活作用,Mg2+的激活作用最强,可以使酶活性提高30%以上,这与所报道的枯草芽孢杆菌(Bacillus subtilis PE-11)碱性蛋白酶[11]相同。初步推测,Mg2+在酶的活性中心结构方面具有一定的功能。
2.2.4 蛋白酶抑制剂对酶活力的影响
纯化的蛋白酶同不同种类的抑制剂孵育1h后,最适作用条件下检测酶活力,结果如表3所示。半胱氨酸蛋白酶抑制剂如碘乙酸盐(iodoacetate,0.05mmol/L)、E64(0.2mmol/L)、β-巯基乙醇(β-mercaptoethanol,1mmol/L)、半胱氨酸(cysteine,5mmol/L)对酶活力基本没有抑制作用;天冬氨酸蛋白酶抑制剂抑肽素(pepstatin,1mmol/L)对酶也没有抑制作用。金属酶抑制剂EDTA和EGTA基本没有抑制作用。胰凝乳蛋白酶抑制剂(0.1mmol/L)几乎可以完全抑制酶活性。大豆胰蛋白酶抑制剂(soybean trypsin inhibitor,0.05mmol/L)处理后仍有65%的酶活力残存。而丝氨酸蛋白酶特异性抑制剂PMSF(phenylmethanesulfonyl fluoride,2mmol/L)、抑肽酶(aprotinin,0.5mmol/L)、弹性蛋白酶抑制剂(elastinal,0.2mmol/L)以及3,4-二氯异香豆素(3,4-dichloroisocoumarin,2mmol/L)完全抑制酶活力,表明该酶活性中心可能含有丝氨酸残基,故该地衣芽孢杆菌XG12蛋白酶归为丝氨酸蛋白酶。

表2 金属离子对地衣芽孢杆菌XG12蛋白酶活性的影响Table 2 Effects of metal ions on B. licheniformis XG12 protease activity

表4 表面活性剂、氧化剂对酶活力的影响Table 4 Effect of surfactants and oxidants on B. licheniformis XG12 protease activity

表3 蛋白酶抑制剂对地衣芽孢杆菌XG12蛋白酶活力的影响Table 3 Effects of protease inhibitors on protease activity from B. licheniformis XG12
2.2.5 表面活性剂、氧化剂对酶活性的影响
表4显示,非离子型表面活性剂Triton X-100、Tween-20及Tween-80对地衣芽孢杆菌XG12蛋白酶均没有抑制作用,而Tween-20及Tween-80还具有较强的激活作用,Tween-20能使酶活力提高到124%。阳离子表面活性剂十六烷基三甲基溴化铵(CTAB)对酶活性没有影响。强阴离子表面活性剂SDS往往是很多酶的抑制剂,而0.1g/100mL的SDS能够激活蛋白酶酶活性达113%。氧化剂双氧水、过硼酸钠、次氯酸钠对酶活性有较低的影响,在40℃孵育1h,酶活性损失仅为20%~25%,表明该酶耐受氧化剂的能力很强。
3 结 论
目前,虽然有几种来自芽孢杆菌属的丝氨酸蛋白酶被分离纯化,但地衣芽孢杆菌这个属的胞外碱性丝氨酸蛋白酶还未见报道,本实验采取硫酸铵分级盐析、DEAE-Sepharose阴离子交换层析和Sephadex G-75分子筛凝胶过滤层析的方法,纯化到了电泳纯的蛋白酶。
已报道的丝氨酸蛋白酶活性和稳定性对环境条件的要求比较严格,有的碱性蛋白酶即使在较短的时间内也很快失去了活性。本实验从地衣芽孢杆菌XG12中分离并纯化了胞外碱性丝氨酸蛋白酶,该酶也与其他的碱性丝氨酸蛋白酶相似,分子质量29.5kD,最适反应温度为40℃。酶学性质研究表明,地衣芽孢杆菌XG12碱性丝氨酸蛋白酶不仅在较低的温度下具有高活性,而且在较广的碱性条件下和较高的温度下都能维持高活性并十分稳定,而且高浓度的表面活性剂、氧化剂都对酶活性没有多大影响,甚至能促进酶活性。实验表明该酶在60℃维持90min酶活还在80%以上;在pH7.0~11.0之间孵育1h,测得酶活性高于85%。不同种类的洗涤剂处理1h,酶活性都保持在100%以上,而Tween-20及Tween-80对酶还有强烈的激活作用。相对来说,它是一种很稳定的碱性丝氨酸蛋白酶。这些优良特性使蛋白酶在食品等领域有着潜在应用价值。
[1] RAO M B, TANKSALE A M, GHATGE M S, et al. Molecular and biotechnological aspects of microbial proteases[J]. Microbiology and Molecular Biology Reviews, 1998, 62(3): 597-635.
[2] GUPTA R, BEG Q K, LORENZ P. Bacterial alkaline proteases: molecular approaches and industrial applications[J]. Applied Microbiology and Biotechnology, 2002, 59(1): 15-32.
[3] KUMAR C G, MALIK R K, TIWARI M P. Novel enzyme-based detergents: an Indian perspective[J]. Current Science, 1998, 75(12):1312-1318.
[4] JOO H S, KUMAR C G, PARK G C, et al. Oxidant and SDS-stable alkaline protease from Bacillus clausii I-52: production and some properties[J]. Journal of Applied Microbiology, 2003, 95(2): 267-272.
[5] JOO H S, CHANG C S. Production of an oxidant and SDS-stable alkaline protease from an alkaophilic Bacillus clausii I-52 by submerged fermentation: Feasibility as a laundry detergent additive[J]. Enzyme and Microbial Technology, 2006, 38(1/2): 176-183.
[6] HADDAR A, BOUGATEF A, AGREBI R, et al. A novel surfactant-stable alkaline serine-protease from a newly isolated Bacillus mojavensis A21. Purification and characterization[J]. Process Biochemistry, 2009,44(1): 29-35.
[7] PATEL R K, DODIA M S, JOSHI R H, et al. Purification and characterization of alkaline protease from a newly isolated haloalkaliphilic Bacillus sp.[J]. Process Biochemistry, 2006, 41(9): 2002-2009.
[8] KEMBHAVI A A, KULKARNI A, PANT A A. Salt-tolerant and thermostable alkaline protease from Bacillus subtilis NCIM No 64[J]. Applied Biochemistry and Biotechnology, 1993, 38(1/2): 83-92.
[9] PETERSON G L. Determination of total protein[J]. Methods Enzymology, 1983, 91: 86-105.
[10] LAEMMLI U K. Cleavage of structural proteins during the assembly of bacteriphoge T4[J]. Nature, 1970, 227: 680-685.
[11] ADINARAYANA K, ELLAIAH P, PRASAD D S. Purification and partial characterization of thermostable serine alkaline protease from a newly isolated Bacillus subtilis PE-11[J]. AAPS Pharm Sci Technol,2003, 4(4): 1-9.
[12] STEELE D B, FISKE M J, STEELE B P, et al. Production of a lowmolecular-weight, alkaline-active, thermostable protease by a novel spiral-shaped bacterium Kurthia spiroforme, sp. nov.[J]. Enzyme and Microbial Technology, 1992, 14(5): 358-360.
[13] KUMAR C G. Purification and characterization of a thermostable alkaline protease from alkalophilic Bacillus pumilus[J]. Letters in Applied Microbiology, 2002, 34(1): 13-17.
[14] BEG Q K, GUPTA R. Purification and characterization of an oxidationstable, thiol-dependent serine alkaline protease from Bacillus mojavensis[J]. Enzyme and Microbial Technology, 2003, 32(2): 294-304.
[15] HUTADILOK-TOWATANA N, PAINUPONG A, SUNTINALERT P.Purification and characterization of an extracellular protease from alkaliphilic and thermophilic Bacillus sp. PS719[J]. Journal of Bioscience and Bioengineering, 1999, 87(5): 581-587.
[16] HAJJI M, KANOUN S, NASRI M, et al. Purification and characterization of an alkaline serine-protease produced by a new isolated Aspergillus clavatus ES1[J]. Process Biochemistry, 2007, 42(5): 791-797.
[17] SINGH J, BARTA N, SOBTI R C. Serine alkaline protease from a newly isolated Bacillus sp. SSR1[J]. Process Biochemistry, 2001, 36(8/9): 781-785.
[18] BANIK R M, PRAKASH M. Laundry detergent compatibility of the alkaline protease from Bacillus cereus[J]. Microbiological Research,2004, 159(2): 135-140.
[19] GUPTA A, ROY I, KHARE S K, et al. Purification and characterization of a solvent stable protease from Pseudomonas aeruginosa PseA[J].Journal of Chromatography A, 2005, 1069(2): 155-161.
[20] GEOK L P, RAZAK C, RAHMAN R, et al. Isolation and screening of an extracellular organic solvent-tolerant protease producer[J]. Biochemical Engineering Journal, 2003, 13(1): 73-77.
Purification and Characterization of Surfactant-stable Protease
GAO Zhao-jian,LI Chao,HOU Jin-hui
(College of Food (Biological) Engineering, Xuzhou Institute of Technology, Xuzhou 221008, China)
A surfactant-stable alkaline protease was isolated and purified from Bacillus licheniformis XG12, and its enzymatic properties were also characterized. A protease with high purity from strain XG12 was purified by precipitation with ammonium sulfate, DEAE-Sepharose ion exchange chromatography and Sephadex G-75 gel filtration chromatography. The purified protease exhibited a 42.6-fold enhancement in specific activity and its recovery rate was 25.3%. The enzyme was composed of a single polypeptide chain with an apparent molecular mass of 29.5 kD as determined by SDS-PAGE. This alkaline protease was highly active and stable in the pH range of 7.0-11.0 with an optimal pH of 10.0. The maximum activity of this alkaline protease was observed at 40 ℃. In addition, this protease could be activated by divalent cations such as Mg2+, Ca2+and Mn2+and inhibited by serine-protease inhibitors, suggesting that this alkaline protease was a serine-protease. Moreover, this alkaline protease also exhibited extreme stability towards anionic (0.1% SDS), cationic (0.1% CTAB), non-ionic surfactants (1% Tween-80, 1%Tween-20 and 1% Triton X-100) and oxidants. Due to its promising properties, this alkaline protease from Bacillus licheniformis XG12 will have potential applications in food and laundry detergents.
Bacillus licheniformis XG12;protease;purification;surfactant;characterization
Q814.1
A
1002-6630(2011)05-0211-06
2010-06-24
徐州工程学院青年培育基金项目(XKY2009123)
高兆建(1976—),男,讲师,博士,研究方向为食品生物技术。E-mail:gaozhaojian@126.com
