DLL1-ICD基因真核表达载体的构建及转染鉴定
2011-10-14郭政崔丽娟黄瑾
郭政,崔丽娟,黄瑾
(石河子大学医学院生化教研室/新疆地方与民族高发病教育部重点实验室,石河子832002)
DLL1-ICD基因真核表达载体的构建及转染鉴定
郭政,崔丽娟,黄瑾
(石河子大学医学院生化教研室/新疆地方与民族高发病教育部重点实验室,石河子832002)
通过克隆DLL1-ICD(Delta-like1细胞内区域)的cDNA及测序鉴定,构建pEGFP-C1-DLL-ICD真核表达载体并进行细胞转染,为研究Notch信号通路与Neuritin的关系奠定基础。首先根据小鼠全长DLL1 cDNA序列,设计DLL-ICD PCR引物,以小鼠胎脑cDNA文库为模板,利用PCR技术扩增DLL1-ICD cDNA。将扩增出的基因片段克隆至pEGFP-C1载体,进行DNA序列测定。并进一步将测序正确的pEGFP-C1-DLL1-ICD真核表达载体转染HEK293细胞。结果显示:成功克隆了DLL1-ICD的cDNA片段,测序结果与基因文库中的DLL1-ICD序列一致,并在转染真核细胞后获得了较好地表达。表明pEGFP-C1-DLL1-ICD真核表达载体构建成功,并在293细胞中成功表达了DLL1-ICD-EGFP融合蛋白。研究结果为进一步探讨Notch信号通路与神经系统疾病的分子机制奠定基础。
DLL1-ICD;真核表达载体;转染Notch信号通路
Notch最初是在果蝇体内被发现,该基因的部分功能缺失会在果蝇翅膀的边缘造成一些缺刻[1]。后续的研究表明,Notch基因位点突变导致果蝇在胚胎期死亡,在死亡的胚胎中,神经组织完全取代了上皮组织从而使神经组织异常丰富;雌性的杂合子果蝇翅膀发生多种缺刻,次刚毛发育异常。1983年,果蝇的Notch基因被克隆[2-3]。
Notch信号途径是一种连接并调节细胞之间的通讯方式,通过侧抑制和信号诱导实现对相邻细胞命运的控制,参与了细胞的增殖,分化和凋亡等重要过程,被认为在多细胞生物细胞发育的细胞分化中起中心作用[4-5]。已有研究表明Notch途径某些分子的基因突变或功能缺失与肿瘤,遗传性疾病,阿尔茨海默症等多种疾病的发生发展有关[6-9]。
迄今为止,多细胞生物有机体的研究表明,Notch信号途径都包括配体-受体-转录因子三联体,一般认为这就是Notch信号通路的核心组件[10]。Notch是一个进化过程中高度保守的跨膜受体蛋白家族,在脊椎和无脊椎动物中均存在且广泛分布和表达在多种组织。Deltal(又称delta-like 1,DLL1)是脊椎动物Notch的两个配体之一,Delta1(又称delta-like 1或DLL1)是脊椎动物Notch的两个配体之一,它与Notch受体结合激活 Notch信号通路,决定细胞分化的命运,参与调控许多组织的生长发育。DLL1为单次跨膜糖蛋白,属于DSL(Delta,Serrate,Lag-2)蛋白家族,小鼠Delta1基因全长2.86 kb,ORF编码722个氨基酸,包括一个545个氨基酸的胞外区,27个氨基酸的跨膜区和一个150个氨基酸的细胞质区。人类DLL1基因定位于染色体6q27,全长3.04 kb中,ORF编码723个氨基酸,与小鼠Delta-1蛋白有88%同源性。DLL1的细胞内区域与 E3泛素连接酶特异结合,是DLL1泛素化和内吞,激活Notch信号通路所必须的结构域[11]。
本实验扩增了DLL1细胞内区域(Delta-like1 inter cell domain,DLL1-ICD)的 cDNA并测序,构建了真核表达载体pEGFP-C1-DLL1-ICD,为进一步探讨Notch信号通路与神经系统疾病的发生机制提供了重要的研究基础。
1 材料与方法
1.1 主要仪器
PCR仪(Bio-RAD);凝胶图像分析仪(Bio-RAD);高速离心机(Kendro Laboratory Products Germany);超高速离心机(Beckman Coulter,Inc.);摇床(DHZ-032 SHA KER)。
1.2 主要试剂
DNA纯化回收试剂盒和质粒DNA小量纯化抽提试剂盒(BioDev);质粒pEGFP-C1(Clontech);受体菌 DH5α由本室保存;DNA电泳槽(Bio-RAD);HEK293细胞由本实验室保存;Lipofectamine 2000(Invitrogen)。
1.3 方法
1.3.1 引物
根据小鼠cDNA文库中DLL1全基因序列,设计扩增DLL1-ICD的引物,引物由上海生工合成。5′端引物 :5′-CG gaattc T ATGTGCGTCCGGCTGAAGCT-3′Tm=64加 EcoRI酶切位点。3′端引物 :5′-CG ggatcc CACCTCAGTCGCTATAACACA-3′Tm=62加BamHI酶切位点。
1.3.2 PCR扩增
反应物为:Primer1,Primer2,10×PCR buffer,25mmol/L dNTP,template,Pfu DNA polymersase,MiliQH2O,总反应体系50μL。PCR条件:94℃5 min预变性,94℃30 s,62℃30 s,72℃45 s,35个循环;72℃延伸10 min。扩增产物进行1%琼脂糖凝胶电泳鉴定,切胶回收目的DNA片段。
1.3.3 pEGFP-C1-DLL1-ICD真核表达载体的克隆
EcoRI/BamHI双酶切pEGFP-C1载体和目的基因片段,载体割胶回收和基因片段 PCR纯化,将目的片段连接进pEGFP-C1载体,转化DH5α菌,菌落PCR初步鉴定阳性克隆后测序验证。
1.3.4 pEGFP-C1-DLL1-ICD真核表达载体转染HEK293细胞
在96孔板中以1×104/孔接种细胞,24 h后用Lipofectamine 2000转染pCDNA3.1-DLL1-ICD,6 h后换液继续培养36 h,在倒置荧光显微镜下观察转染结果。
2 结果
2.1 DLL1-ICD cDNA的克隆与pEGFP-C1-DLL1-ICD真核表达载体的构建
DLL1-ICD cDNA基因编码序列为465bp。采用PCR以小鼠cDNA文库为模板克隆出DLL1-ICD cDNA。PCR产物用1%琼脂糖凝胶电泳分离,在500 bp稍下方可见一条特异性条带(图1)。

图1 DLL1-ICD cDNA的PCR扩增结果Fig.1 DLL1-ICD cDNA amplitied by PCR
与预测目的基因片段大小相近。泳道1为DNA分子量标准,泳道2~7为 PCR产物。该465 bp条带被纯化出,并被克隆至载体pEGFP-C1(图2)。共选抗生素重划筛选的 16个阳性菌落用DLL1-ICD特异性引物煮菌 PCR鉴定,结果(图3)表明16个菌落均为阳性。选7号菌落抽提质粒,用pEGFP-C1通用测序引物正向,反向测定了DLL1-ICD cDNA 的 5′和 3′端 ,经 BLAST 分析 ,与已知的DLL1-ICD基因序列一致,结果(图4)表明所克隆的DLL1-ICD cDNA是正确的。
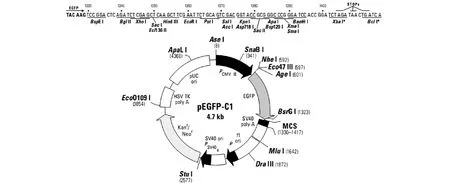
图2 pEGFP-C1质粒图谱Fig.2 The map of pEGFP-C1Plasmid frolile

图4 Dll1-ICD cDNA序列测定Fig.4 Dll1-ICD cDNA sequence analysis
2.2 pEGFP-C1-DLL1-ICD真核表达载体转染HEK293细胞
将pEGFP-C1-DLL1-ICD瞬时转染至 HEK293细胞,培养36 h,在荧光显微镜下观察转染结果,图片显示293细胞整个胞浆呈现绿色荧光(图5),表明pEGFP-C1-DLL1-ICD真核表达载体在 HEK293细胞中成功表达了DLL1-ICD-EGFP融合蛋白。

图5 DLL1-ICD-EGFP融合蛋白在HEK293中的表达Fig.5 DLL1-ICD-EGFP fusion protein expressed in HEK293
3 讨论
Notch信号通路在生物发育的整个阶段对细胞的分化、迁移和增殖起着至关重要的作用。Notch蛋白家族成员是进化过程中非常保守的跨膜受体,它与配体DLL1结合通过细胞间的相互作用调控多种组织细胞的命运[12-13]。
DLL1蛋白是脊椎动物Notch家族的配体之一,从生物学结构上看,是单次跨膜糖蛋白,包括细胞外区、跨膜区和细胞内区。当细胞表面的DLL1配体结合Notch后,使Notch发生两次蛋白裂解,第一次裂解使内外区断裂分开,第二次裂解释放Notch胞内区(NICD),使其从细胞膜上脱离。
NICD是Notch的活性形式,它被转运进入细胞核并与CSL结合,而后形成NICD-CSL复合物,该复合物可激活Notch诱导基因(Notch-inducible genes)的转录。直接诱导转录的靶基因是 E(spl)(Enhancer of Split),E(spl)是碱性螺旋-环-螺旋(basic helix-loop-helix,bHL H)类转录因子,它又激活了转录抑制因子 HES1和 HES2,下调了proneural基因的表达,从而抑制了神经元祖细胞的分化。而 HES1的失活就会导致proneural基因的表达上调,加速神经元祖细胞的分化[14-15]。同时,有研究表明DLL1可以激活Notch信号通路,促进祖细胞向树突状细胞分化[16-17]。敲除DLL1基因的小鼠在胚胎发育过程中死亡,表现为体节与神经发育缺陷[18-19]。因此,可以预见DLL1基因在神经系统疾病的发生、发展和转化过程中发挥着重要的作用。本研究通过DLL1-ICD的克隆和基因序列分析,构建了pEGFP-C1-DLL1-ICD真核表达载体,并进行了转染鉴定,研究结果为深入研究其在神经系统疾病的作用奠定了基础。
[1]Hiroyuki K,Kousuke O.Detection of Notch signaling molecules in ameloblastomas[J].Oral Pathol Med,2008,37(4):228-234.
[2]Gwen L,Raul U.Primers on Molecular Pathways-Notch[J].Pancreatology,2008,8(2):103-104.
[3]Ryuhei O,Hachiro T,Setsuya A.Notch signaling:Its role in epidermal homeostasis and in the pathogenesis of skin diseases[J].Dermatol,2008,49(3):187-194.
[4]Katsuto H,Naoko N,Izumi T,et al.Notch signaling is necessary for GATA3 function in the initiation of T cell development[J].Eur J Immunol,2008,38(4):977-985.
[5]Hiromi S,Toshiyuki O,Ryoichiro K.Oscillations in Notch Signaling Regulate Maintenance of Neural Progenitors[J].Neuron,2008,58(1):52-64.
[6]Alan G,Salome L,Emma S,et al.Dendritic cell expression of the Notch ligand jagged is not essential for Th2 response induction in vivo[J].Eur J Immunol,2008,38:1043-1049.
[7]David W,Sarah A,Paul M,et al.Co-regulation of Gremlin and Notch signalling in diabetic nephropathy[J].Acta Bioch Bioph Sin,2008,1782(1):10-21.
[8]Thshinori H,Hiroki K,Byron H,et al.Hesr1 and Hesr2 may act as early effectors of Notch signaling in the developing cochlea[J].Dev Biol,2008,316(1):87-99.
[9]Edward Y,Matt D,Cosimo C,et al.Neuralized function as an E3 ubiquitin ligase during Drosophila development[J].Curr Biol,2001,11(21):1675-1679.
[10]Jeffrey P,Kathryn E,Jennifer R,et al.Notch Signaling and Morphogenesis of Single-Cell Tubes in the C.elegans Digestive Tract[J].Dev Cell,2008,14(4):559-569.
[11]Cosimo C,Gabrielle L,et al.The Neuralized homology Repeat 1 Domain of Drosophila Neuralized Mediates Nuclear Envelope Association an Delta-dependent Inhibition of Nuclear Import[J].J Mol Bio,2008,375(4):1125-1140.
[12]Helmut K.Neuralized:Regulating Notch by Putting A-way Delta[J].Dev Cell,2001,1(6):725-731.
[13]Evangelia K,Shigeo S,Chieri T,et al.nerualized-like1(Neurl1)Targeted to the Plasma Membrane by N-Myr-istoylation Regulates the Notch Ligand Jagged1[J].Biol Chem,2008,283(7):3846-3853.
[14]Elias P,Chrysoula P,Kristin M,et al.neuralized Encodes a Peripheral Membrane Protein Involved in Delta Signaling and Endocytosis[J].Dev Cell,2001,1(6):807-816.
[15]Tonis T,Kaia P,Natale B,et al.Dendritic Localization of Mammalian neuralized mRNA Encoding a Protein with Transcription Repression Activities[J].Mol Cell Neurosci,2002,20(4):649-668.
[16]Eric C,Gisele A,Chres K,et al.Drosophila Neuralized Is a Ubiquitin Ligase that Promotes the Internalization and Degradation of Delta[J].Dev Cell,2001,1(6):783-794.
[17]Allison J,Francois S.Bearded Family Members Inhibit Neuralized-Mediated Endocytosis and Signaling Activity of Delta in Drosophila[J].Dev Cell,2006,10(2):245-255.
[18]Stefano D,J.YU,R.Zinzen,et al.Dorsal-Ventral Pattern of Delta Trafficking Is Established by a Snail-Tom-Neuralized Pathway[J].Dev Cell,2008,10(2):257-264.
[19]Roland L,Francois S.Unequal Segregation of Neuralized Biases Notch Activation during Asymmetric Cell Division[J].Dev Cell,2003,5(1):139-148.
Construction of Mammalian Expression Vector of DLL1-ICD and Transfection
GUO Zheng,CUI Lijuan,HUANGJin
(Department of Biochemistry,Shihezi University School of Medicine/Laboratory of Endemic and Ethnic Diseases,Shihezi 832002,China)
To construct and identify mammalian expression vector of DLL-ICD(Delta-like1 inter cell domain)using cloning and transfection technique,the pair of primers were decigned based on musculus cDNA sequence,and the DLL1-ICD was amplified by PCR.And then the PCR product was cloned into the vector pEGFP-C1 which was analyzed by sequence.Finally,mammalian expression vector of pEGFP-C1-Dll1-ICD was transfected into 293 cells.Musculus Dll1-ICD cDNA was cloned and analyzed,and the sequence of gene from pEGFP-C1-Dll1-ICD is identical With DII1-ICD in Genbank.After transfected,Dll1-ICD-EGFP fusino protein was expressed in 293 cells.The results set up the foundation to investigate the mechanism of Notch signaling in nervous system disease.
DLL1-ICD;Mammalian expression vector;Transfection,Notch Signaling pathway
R735.8 < class="emphasis_bold">文献标识码:A
A
2010-03-10
国家自然科学基金项目 (30760063)
郭政(1981-),男,硕士生,专业方向为神经营养因子与神经再生。
黄瑾(1963-),女,教授,从事神经营养因子与神经再生的研究;e-mail:huangjin623@163.com。
