产低温蛋白酶海洋细菌的筛选及发酵条件
2011-10-10郭艾英张志雯
郭艾英,凌 云,张志雯
(1河北科技师范学院生命科技学院,河北秦皇岛,066600;2中粮华夏长城葡萄酒有限公司)
蛋白酶是一类可催化蛋白质水解反应的酶,是重要的工业用酶之一,已被广泛应用于食品、洗涤、皮革、饲料等工业。目前国内蛋白酶在常温和低温下酶活力不高,不能满足市场需求,大规模用酶主要依赖进口[1]。海洋微生物自身生长环境(高压、高盐、低温、低营养、低光照等)决定其分泌的胞外酶具有在低温和高盐存在下能够继续保持较高的活力,并且经过温和的热处理即可使低温酶活力丧失或低温菌株选择性失活,而不会影响产品的品质,这使得该酶也能够应用于某些条件苛刻的生产工艺中[2~4]。对海洋微生物低温酶的研究与开发,已在国内外引起了广泛关注。由海洋微生物生产低温酶已成为发达国家开发新型酶制剂的重要途径[5~7],国内已经从黄海海水、北极沉积物或海水中分离到多株产低温蛋白酶的菌株[1,8~10],其菌种、酶的性质也不尽相同。作者首次从渤海海域采集的样品分离获得一株产蛋白酶活力较高的菌株HYM-16,初步鉴定为黄色杆菌属,该菌株所产的蛋白酶在4℃条件下处理48 h,酶活保持不变,属低温酶,笔者对其生长条件进行分析,以期为工业应用和后续研究奠定理论和应用基础。
1 材料和方法
1.1 样品采集
2009年10月上旬于渤海秦皇岛海域东经119°60′,北纬39°93′附近,采集海水样品共20份。
1.2 培养基
1.2.1 营养琼脂培养基 牛肉膏5 g/L,蛋白胨10 g/L,琼脂20 g/L,作为菌体初筛和斜面菌种保藏用。
1.2.2 筛选培养基 葡萄糖 0.5 g/L,KH2PO40.5 g/L,K2HPO40.5 g/L,酪蛋白 10 g/L,琼脂 20 g/L,用于筛选蛋白酶产生菌。
1.2.3 种子培养基 葡萄糖5 g/L,蛋白胨10 g/L。
1.2.4 基础发酵培养基 葡萄糖0.5 g/L,K2HPO40.5 g/L,KH2PO40.5 g/L,蛋白胨 10 g/L。以上培养基pH 7.2~7.4,均用陈海水代替蒸馏水配制,121℃灭菌30 min。
1.3 菌株筛选
1.3.1 菌株初筛 将采集到的样品经肉汤培养基富集培养24 h,用灭菌陈海水进行梯度稀释后涂布营养琼脂培养基,于25℃培养箱中培养,待形成单菌落,再点种于筛选平板进行初筛。培养48 h后,在菌落周围滴加10 g/L三氯乙酸,以铺满平板为度。选取水解圈较大的菌株,平板划线纯化,斜面保藏,备用。
1.3.2 菌株复筛 将初筛菌株接种于装液量50 mL种子培养基的250 mL三角瓶中,180 r/min,25℃震荡培养48 h,收集发酵液进行酶活力测定。
1.4 酶活力测定
将发酵液在4 500 r/min,4℃离心10 min,取上清液作为粗酶液,采用Folin-酚法测定蛋白酶活力[11]。以1 mL酶液在一定条件下每分钟水解酪蛋白产生1 μg酪氨酸所需的酶量定义为1个酶活单位(U)。
1.5 发酵培养条件的优化
1.5.1 培养时间对菌株产酶的影响 挑1环菌株接入种子培养基,180 r/min,震荡培养12 h,以体积分数为 0.01 的菌液转接发酵培养基,180 r/min,25 ℃震荡培养,分别培养 12,24,36,48,60,72 h,测定发酵液中蛋白酶活力。
1.5.2 接种量对产酶的影响 将震荡培养12 h的种子液,分别以体积分数为0.005,0.010,0.015和0.020的菌液转接发酵培养基,180 r/min,25℃的条件下震荡培养,48 h后测定发酵液中蛋白酶活力。
1.5.3 摇床转速对产酶的影响 将震荡培养12 h的种子液,以体积分数为0.01的菌液转接发酵培养基,控制摇床转速分别为120,140,160,180,200,220 r/min,25 ℃的条件下震荡培养,48 h 后测定发酵液中蛋白酶活力。
1.5.4 不同碳源、氮源对产酶的影响 在基础发酵培养基中分别加入相同质量浓度(0.5 g/L)的4种碳源(麦芽糖、蔗糖、乙酸钾、淀粉)和4种氮源(硝酸钾、酵母粉、豆饼粉、硫酸铵),研究其对产酶的影响。将震荡培养12 h的种子液,以体积分数为0.01的接种量,培养48 h后测定发酵液中蛋白酶活力。
1.5.5 不同金属离子对产酶的影响 在基础发酵培养基中分别添加质量浓度为0.1 g/L的4种不同金属离子(Mg2+,Mn2+,Fe2+,Ca2+),将震荡培养12 h的种子液,以体积分数0.01接种量,培养48 h后测定发酵液中蛋白酶活力。
1.5.6 培养基优化试验 选择影响酶活的碳源、氮源和金属离子为考虑因素,选用L9(34)正交设计(表1),以酶活力为指标,优化培养基的组成成分。
2 结果与分析
2.1 菌株的分离
将取得的水样20份,经富集培养,稀释涂布,培养18~24 h后得到148个单菌落,挑取单菌落于筛选平板上培养,37株分泌蛋白酶。挑选其中D/d大于3的13株经摇瓶复筛,依据Folin-酚法测定蛋白酶活,确定HYM-16号菌株,酶活达410.1×103U·L-1,是一株性能良好的出发菌株。国内报道的出发菌株的活力在100×103U·L-1上下[10]。该菌株在筛选平板上培养48 h时所形成的水解圈如图1所示。

表1 正交试验因素水平表 g·L-1

图1 HYM-16菌株在筛选平板培养48 h产生的水解圈
2.2 菌种的初步鉴定
筛选的HYM-16菌株为长杆状,在营养琼脂培养基上菌落呈圆形同心环,脐状,边缘整齐,表面闪光,油脂状,浅黄色。生理生化反应为革兰氏染色阴性,接触酶阳性,好氧,能在甲醇、乙醇、丙醇丁醇和有机酸为唯一碳源时异养生活。根据《常见细菌系统鉴定手册》[12]相关内容,初步鉴定为黄色杆菌属(Xanthobacter sp.)。
2.3 发酵条件的优化
2.3.1 培养时间对产酶的影响 在不同培养时间处理下,测定酶活力,该菌株在12 h开始产酶,24 h后大量产酶,至48 h时,酶产量达到高峰,酶活为416.6×103U·L-1,继续培养,酶活力显著下降(图2)。其原因可能是在发酵前期菌体经过短暂的适应期即进入对数生长期,外部环境有利于菌体的生长和代谢产物的合成,在48 h产酶量达到最大;到发酵后期,培养基中的营养物质减少,产物量及有害代谢物的增多抑制菌体的生长和产物的合成,造成酶活力的下降,因此选择48 h为最佳培养时间。
2.3.2 不同接种量对产酶的影响 在三角瓶装液量相同的条件下,测试了不同接种量对产酶的影响(图3)。结果表明,接种量的大小对产酶影响较大,接种量较低和较高都会抑制酶活,体积分数0.01时蛋白酶活力最大。小于0.01时,随接种量的增加其产酶活力也增大,再增加接种量,酶活反而降低。这可能是接种量较小时,菌体产生的胞外酶较少,影响菌体对营养物质的利用,抑制产酶,而接种量较大时,菌体生长过快,发酵液黏度增加,造成溶氧不足,影响产物的合成。

图2 不同培养时间对产酶的影响

图3 不同接种量对产酶的影响
2.3.3 不同摇床转速对产酶的影响 在其它条件相同的情况下控制不同的摇床转速,测定发酵液中蛋白酶活力(图4)。结果表明,随着摇床转速的增加,产酶量增多,180 r/min时产酶量最大,为411.3×103U·L-1,再增大转速,产酶量有所下降。说明摇床转速影响培养液的溶氧量,适当的溶氧水平有利于该菌株的生长和代谢产物的合成,但溶氧太高反而抑制蛋白酶的形成。
2.3.4 不同碳源、氮源对产酶的影响 在产酶基础培养基中试验了相同浓度的4种碳源和氮源,培养后测定蛋白酶活力(图5)。结果表明,碳源中蔗糖效果最好,产酶量最高,酶活为506.4×103U·L-1,其次为葡萄糖和淀粉。蔗糖优于葡萄糖的原因可能是菌体以蔗糖作为碳源可解除葡萄糖效应,与国外报道的葡萄糖抑制蛋白酶的生成相似[13];淀粉作为一种廉价的碳源也具有较高的产酶水平,可能是其中含有复杂蛋白成分具有诱导作用。
菌株利用有机氮源产酶能力均高于无机氮源,其中豆饼粉效果最好,达468.0×103U·L-1(图6),酵母浸出物和蛋白胨次之。其原因可能是无机氮源成分较单一,影响产酶量;(NH4)2SO4为生理酸性物质,影响产酶环境的pH,抑制蛋白酶的分泌,因而产量最低,此研究结果与Sinha报道的硫酸铵对产酶的促进作用存在分歧[14];而有机氮源中可能含有的无机盐、较丰富的B族维生素及生长因子促进了蛋白酶的产生,与Sen和Gajju等的研究结果一致[13,15]。因此确定豆饼粉为后续试验氮源。

图4 摇床不同转速对产酶的影响
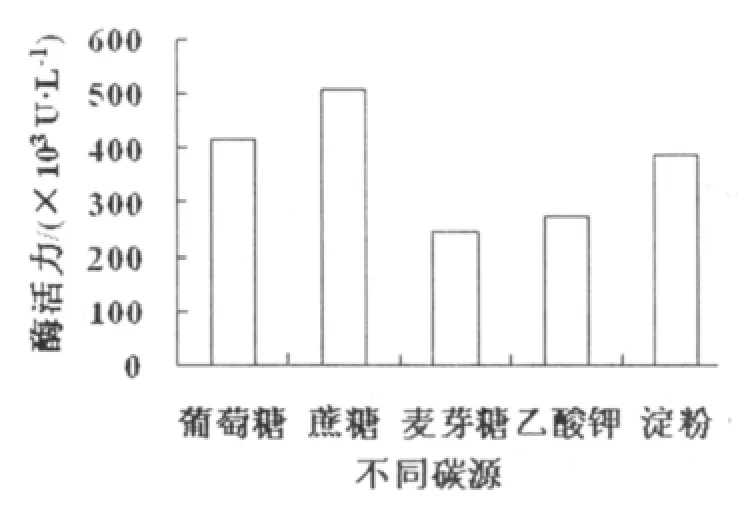
图5 不同碳源对产酶的影响
2.3.5 金属离子对产酶的影响 在基础发酵培养基中分别以适宜浓度添加4种金属离子考察对蛋白酶活的影响(图7),结果表明,较低金属离子浓度下,与对照相比,Mg2+和Ca2+对该菌产酶具有促进作用,Fe2+和Mn2+则对蛋白酶抑制作用明显,其中Fe2+作用更强,酶活仅是对照的10.99%。这可能是由于Ca2+和Mg2+稳定酶结构的同时,也起到了激活酶的作用;而Mn2+及Fe2+可能与酶中心的活性基团结合形成化合物,导致蛋白酶活力下降。

图6 不同氮源对产酶的影响
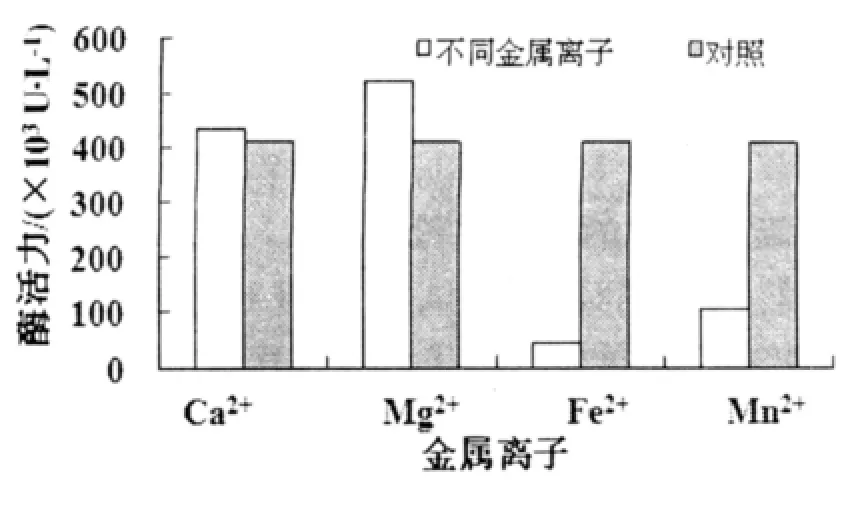
图7 不同金属离子对产酶量的影响
2.3.6 碳源、氮源和金属离子合适浓度对产酶的影响 产酶最适培养基优化试验结果如表2表3所示,由表2各列的极差R值和表3中F值可得,各因素影响主次顺序为B>A>D>C,即在实验设定的因素中,氮源中豆饼粉和碳源蔗糖的添加量对菌株产酶影响显著,而Mg2+的添加量对产酶影响不大,Sun-og等研究结果表明,高浓度的Mg2+有助于提高蛋白酶活力[16]。由2.3.5可知Mg2+的添加能够促进产酶,但其添加量对产酶影响较小,其原因有待进一步考察。在优化培养基因素水平上,对因素A和B,最大数均是K2,因此选择A2B2,对于因素C和D选择最大数C2D1,因此最佳组合为:A2B2C2D1,综合基础培养基得最佳发酵培养基:蔗糖 1 g/L,豆饼粉 20 g/L,MgCl20.4 g/L,K2HPO40.5 g/L,KH2PO40.5 g/L。
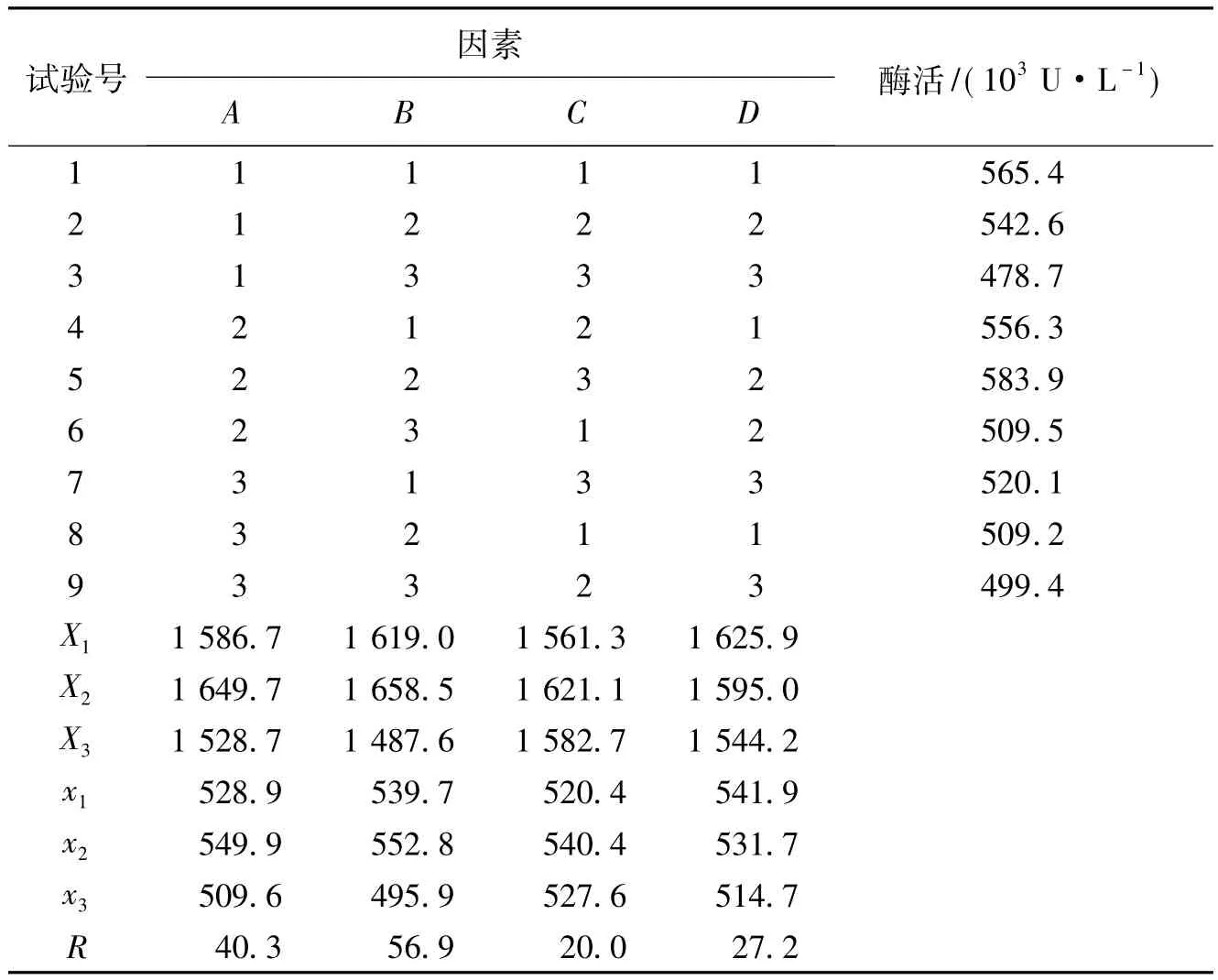
表2 正交试验L9(34)结果及极差分析
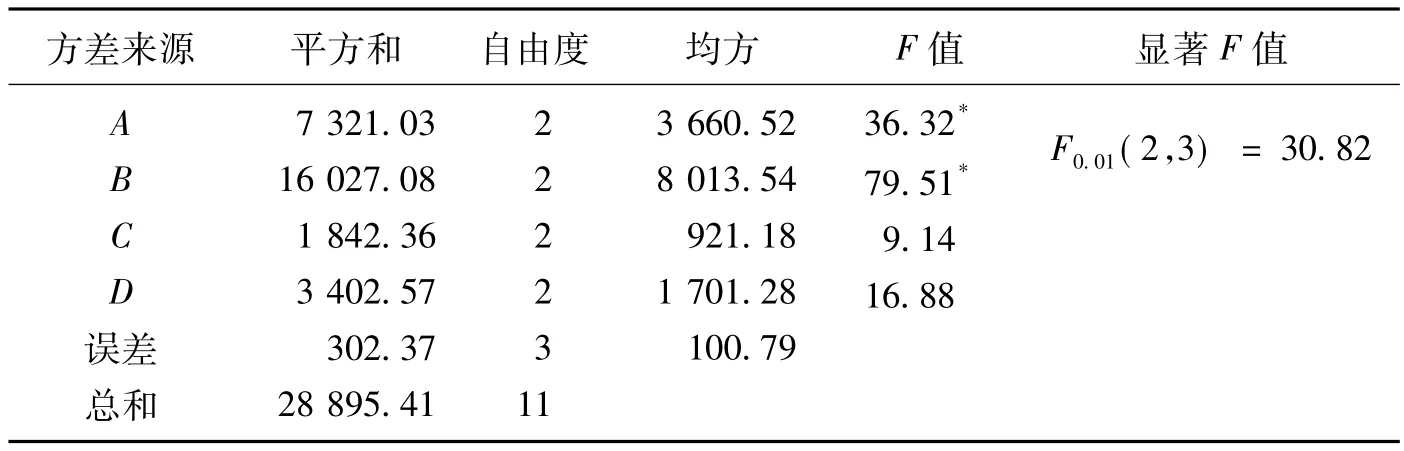
表3 方差分析结果

表4 培养基优化后的蛋白酶活力及相对产率变化
2.4 优化培养条件的验证试验
为了进一步验证正交试验优选出的最佳组合方案A2B2C2D1,将活化菌株接入种子培养基培养12 h后,以体积分数0.01的接种量分别转接最佳发酵培养基和基础发酵培养基,培养48 h,测定酶活(表4)。可知优化后的培养基酶活较基础培养基增加了46.9%,3次试验具有重现性,结果一致。
3 结 论
(1)采用梯度稀释法从渤海海域分离得到148株单菌落,其中37株具有分泌蛋白酶的能力,经过平板初筛和摇瓶复筛确定酶活410.1×103U·L-1的HYM-16为研究的出发菌株,初步鉴定为黄色杆菌属(Xanthobacter sp.)。
(2)研究了发酵条件、培养基成份对发酵产酶的影响。以酶活力为依据,得出在装液量为50 mL的250 mL的三角瓶中,以体积分数为0.01的接种量,180 r/min进行发酵培养,48 h时达到最高产酶水平;最佳的碳源、氮源分别是蔗糖和豆饼粉,Mg2+能够促进产酶。
(3)优化培养条件得出各因素影响主次顺序:豆饼粉>蔗糖>K2HP04>MgCl2;最佳发酵培养基:蔗糖 1 g/L,豆饼粉 20 g/L,MgCl20.4 g/L,K2HPO40.5 g/L,KH2PO40.5 g/L。优化后的培养基较基础培养基酶活提高46.9%。该蛋白酶的稳定性较好,粗酶液在4℃条件下处理48 h后酶活不变,具有进一步开发利用的潜力。
[1]陈静,王淑军,黄炜,等.产低温碱性蛋白酶海洋适冷菌SY的筛选[J].微生物学杂志,2005,25(4):38-42.
[2]GERDAY C M,AITTALEB M,BENTAHIR J P,et al.Cold-adapted enzymes:from dundamentals to biotechnology[J].Tibtech,2000(18):103-107.
[3]MARGESIN R,SCHINNER F.Properties of cold-adapted microorganisms and their potential role in biotechnology[J].Journal of Biotechnology,1994,33(1):1-14.
[4]孙谧,洪义国,李勃生,等.海洋微生物低温酶特性及其在工业中的潜在用途[J].海洋水产研究,2002,23(3):44-49.
[5]SYED H I,RICHARD V G,HAROLD L GRIFFIN.Adhesive properties of a symbiotic bacterium from a wood-boring marine shipworm[J].Appl Environ Microbiol,1990,56(5):1 317-1 322.
[6]HUSTON A L,KRIEER-Brockett B B,DEMING J W.Remarkably low temperature optima for extracellular enzyme activity from Arctic bacteria and sea ice[J].Environmental microbiology,2000,2(4):383-388.
[7]HOSHINO T,ISHIZAKI K,SAKAMOTO T,et al.Isolation of apseudomonas species from fish intestine that produces a protease active at low temperature[J].Lett Applied Microbiology,1997,25(1):70-72.
[8]刘朝谊,郭凯,许峰,等.低温海洋微生物产碱性蛋白酶菌株的筛选[J].淮海工学院学报:自然科学版,2006,15(2):59-62.
[9]曾胤新,蔡明红,陈波,等.一株北极海洋细菌及其蛋白酶的生理生化特征研究[J].极地研究,2000,12(4):263-268.
[10]刘静.产低温蛋白酶菌株的分离鉴定及其酶的提纯与特性研究[D].浙江:浙江大学生命科学学院,2005.
[11]陈向东,彭珍荣,沈萍.碱性蛋白酶高产菌株的选育[J].武汉大学学报:理学版,2003,8(6):13-16.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[13]SEN S,SATYANARAYANA T.Optimization of alkaline protease production by thermophilic Bacill us lichenif ormis S240[J].Ind J Microbiol,1993,33(1):43-47.
[14]SINHA N,SATYANARAYANA T.Alkaline protease production by thermophilic Bacillus lichenif ormis[J].Ind J Microbiol,1991(31):425-430.
[15]GAJJU H,BHALLA C,AGARWAL H O.Thermostable alkaline protease from thermophilic Bacillus coagulans PB-77[J].Ind J Microbiol,1996(36):153-155.
[16]SUN-OG L,JUNICHI K,NOBORU T.Involvement of an Extracellular Protease in Algicidal Activity of the Marine Bacterium Pseudoalteromonas sp.Strain A28[J].Applied and environmental microbiology,2000,66(10):4 334-4 339.
