人胚嗅鞘细胞诱导神经干细胞分化的研究
2011-10-07滕晓华潘林香
刘 波,滕晓华,段 答,周 蓉,潘林香,卢 明
(湖南师范大学第二附属医院,解放军第163医院神经外科,湖南 长沙 410003)
二十世纪九十年代神经干细胞的发现使得人们对中枢神经系统的发育、神经的再生等都有了新的认识,人们对干细胞的了解也将更加全面。神经干细胞的研究仍处于初级阶段,神经干细胞的定向分化仍有较大的难度。嗅鞘细胞(OECs)兼具星型胶质细胞、少突胶质细胞和神经膜细胞的特点,由于其对中枢神经的再生具有促进作用,近年来受到研究人员的高度重视,被广泛用于中枢神经系统损伤的细胞移植研究。本实验利用嗅鞘细胞的上清液中多种成分诱导神经干细胞分化,观察其神经干细胞分化的方向,分化后的存活和电活动情况。
3.3 目前螺虫乙酯在苹果树、梨树、柑橘树和番茄上进行了登记,在在猕猴桃上没有进行登记。推荐在苹果树上的施药方式为3000~4000倍液喷施,在梨树和柑橘树上的推荐剂量为4000~5000倍液,安全间隔期分别为21 d、21 d和20 d;最多施用次数均为2次。本实验以3000倍液稀释液喷施2次,28 d后,猕猴桃中螺虫乙酯母体的残留量为0.06 mg/kg,远高于我国制定的0.02 mg/kg的最大残留限量值。因此螺虫乙酯在猕猴桃中施用合适剂量还有待进一步研究。
1 材料和方法
1.1 主要试剂
DMEM/F12(1:1)、DMEM、B27 添加剂、重组人bFGF、EGF购自 Gbico公司,FBS购于 Hyclone公司,小鼠抗人Nestin、NGFR p75抗体、小鼠抗人NSE抗体为abcam公司产品;tunnel试剂盒购自merck公司,人胚(16周)为经患者同意本院流产的胎儿。
1.2.1 嗅鞘细胞培养和鉴定
嗅鞘细胞在接种后24 h几乎全部贴壁,呈球形。4 d时多数细胞呈三角形、梭形,细胞发出纤细的突起(图1)。 纯化培养2 d后双极细胞所占比例较大,同时也有三极细胞出现。P75免疫反应,几乎均呈阳性,形态呈三角或条梭状,细胞走向不一。通过免疫组化观察,本法培养的细胞纯度可达90%左右(图 2)。
1.2.2 神经干细胞培养和鉴定
1023 静脉溶栓治疗后不明原因早期神经功能恶化相关因素和临床特征分析 黄石仁,沈红健,邢鹏飞,沈 芳,张永巍,吴 涛,邓本强
1.2 神经干细胞诱导分化 分3组,每组设6个标本,A组:嗅鞘细胞上清液诱导神经干细胞分化;B组:RTRA诱导神经干细胞分化;C组:含5%FBS的神经细胞培养基诱导神经干细胞分化
1.2.1 嗅鞘细胞上清液诱导神经干细胞分化
经纯化后的嗅鞘细胞消化后用10%FBS的DMEM/F12培养基接种于6孔培养板内,待细胞完全伸展开后加入神经(DMEM/F12+2%B27)细胞培养基,1天后将多聚赖氨酸包被的盖玻片置于放入6孔培养板内,把神经干细胞接种于玻片上,2~3天半量换液。
迅速取出脑组织并分离两侧海马解剖显微镜下剥除脑膜。D-Hanks液漂洗,用眼科剪反复切割组织,收集入离心管中,吸管反复吹打,再用200目细胞筛过滤后制成单细胞悬液。经细胞计数后,分装入50 mL培养瓶中,细胞数约为5×106/mL,培养基为:DMEM/F12+2%B27+20 ng bFGF+20 ng EGF,每3~4 d换液一次,每6~7 d传代1次。将悬浮培养的细胞球接种于poly-l-lysine包被的载玻片上在10%FBS DMEM/F12中培养4 h,然后用4%多聚甲醛固定30 min,0.01 mol/L PBS冲洗5 min×3次,加入一抗巢蛋白(1:400)后4℃过夜,0.01 mol/L PBS冲洗5 min×3次,SABC显色。
司法实践中,常将《侵权责任法》《人身损害赔偿司法解释》关于雇主无过错的责任规定称为雇主责任。中山大学法学院张民安教授将雇主责任称为“替代责任”[1]15,重庆大学法学院杨署东教授,则将雇主责任称为“转承责任”。民事转承责任是一种责任人因与他人间的特定基础关系而对他人的侵权行为承担民事责任的责任形式。杨教授认为,雇主责任是一种特殊的侵权责任,从属于替代责任。[2]20笔者赞同杨教授观点,认为雇主责任是从属于替代责任的转移承担。雇主转承责任的核心内涵是“责任的转移承担”。
1.2.2 RTRA和5%FBS组
将NSCs接种于多聚赖氨酸包被的盖玻片上,培养基分别为加入5%FBS的神经细胞培养基和加入5×10-6RA的神经细胞培养基,2~3天半量换液。于第10天行NSE、GFAP免疫组化和tunel细胞凋亡检测。
1.2.3 神经干细胞分化后免疫组化检测
把各组分化的细胞经丙酮固定20 min后涂在载玻片上,0.01 mol/L PBS冲洗5 min×3次,加入一抗 NSE(1:300)后 4℃过夜,0.01 mol/L PBS冲洗 5 min×3次,SABC 显色。
总而言之,在企业经营管理工作开展进程中,要积极建立健全完整的监督管理措施,充分考量管理者特质、内部控制机制等因素,确保能有效提升企业的市场价值,维护企业运营管理的动力,并且有效建构完整的发展规划,提高企业的市场竞争力,为企业可持续进步奠定基础。
2.2 神经干细胞的分化情况
神经干细胞4d可形成十几个至几十个细胞组成的呈悬浮生长的细胞球,细胞形态规则,折光性强。以后神经细胞球逐渐变大,7 d左右可形成上百个细胞组成的细胞球(图3 A),细胞克隆球进行Nestin免疫荧光染色,呈Nestin抗原阳性(图3 B)。
“家政服务业从业人员就业前景好,我们在市场调查的基础上,总结为三个原因。” 泓福泰家政服务有限公司负责人方蓓燕向记者介绍道。
于 7d、14d、21d对 A组和 B组行 tunnel细胞凋亡检测,细胞经多聚甲醛固定,按tunnel细胞凋亡检测试剂盒流程染色后苏木素复染。
自从那次跟同学闹事送医院以后,班里同学都用一种奇怪的眼神看他,甚至躲得远远的,曾经在他身边前呼后拥的那些小伙伴们也都疏远了他,简单地说就是大家都怕他。
1.2.5 神经干细胞分化后膜片钳检测
A组细胞于12d行膜片钳检测。钠电流检测:分化的神经细胞钳制在-80mV,给予-80mV至+60mv的系列峰波刺激,步幅为+10mV记录到一系列内向钠电流。钾电流的检测:同样将细胞钳制在-80mV,给予-80mV至+60mV的系列刺激得到慢激活慢失活外向钾电流。
2 结果
2.1 嗅鞘细胞的培养和免疫组织化学结果
迅速取出两侧嗅球,置于D-Hanks平衡盐溶液中除去软膜,然后用D-Hanks液冲洗两遍。在手术显微镜下去膜,剪碎。将剪碎组织离心,800 r/min,3 min后取出,弃去上清液,滴加2 mL 0.125%v/v的胰蛋白酶消化液置于37℃10 min。稍吹打后吸取上清液加入含10%FBS 2 mL DMEM/F12培养基终止消化,重复以上步骤3~4次;收集细胞悬液离心,800 r/min,3 min,弃去上清液,用含10%FBS的DMEM/F12重悬细胞,细胞计数选密度为5×105个/mL接种于50cm斜口细胞培养瓶,放入CO2培养箱(5%CO2,37℃)中培养。于培养第3天换无血清DMEM限制培养基,以后每3天半量换液一次,培养9 d的细胞经消化接种于盖玻片上,培养3 d后用4%多聚甲醛固定,按照SABC方法行神经生长因子受体NGFR p75免疫组化染色。
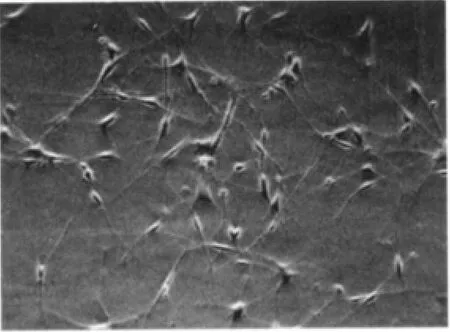
图1 嗅鞘细胞培养第9天结果(×200)
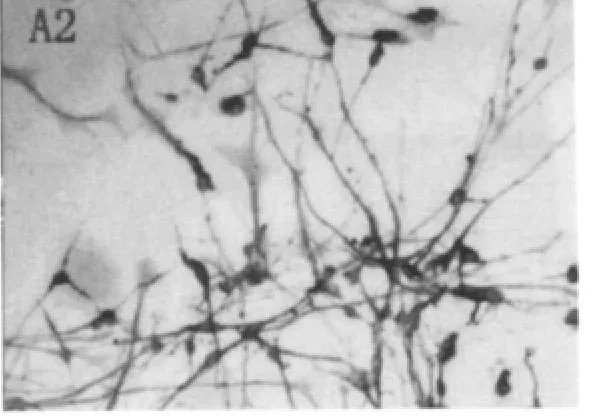
图2 嗅鞘细胞免疫组织化学结果(×200)
例如讲必修2“The Olympic Games”一课时,在上课前三分钟利用Flash让学生感受《we got it》。并且布置上网查阅有关“奥运”信息的作业,大大提高学生学习英语的兴趣。在教学过程中,要注意思想教育工作与教学工作的互相渗透,寓思想教育于教学中。如在学习必修1“Nelson Mandela—a modern hero”一课时,教师要给学生讲述伟人的事迹及优良品质,让学生树立自己心目中的英雄形象,作为自己遇到困难时的激励者。
1.2.4 神经干细胞分化后tunel细胞凋亡检测
A组和B组神经干细胞分化过程基本相似,以不对称双极形为主,少量扁平状细胞(图3 C)。C组几乎全为扁平状细胞。染色结果显示(图3 D),A组NSE阳性率分别为80.3%,B组NSE阳性率77.5%,C组NSE阳性率2%,A组和B组明显高于C组(2%);A组和B组对照无统计学意义 (P>0.05),A组和B组与C组比较差异有统计学意义(P<0.05)。
式中,Kr为回波衰减系数,φn为目标反射的随机相位,为点目标回波瞬时延时时间,发射信号和接收信号进行混频后得
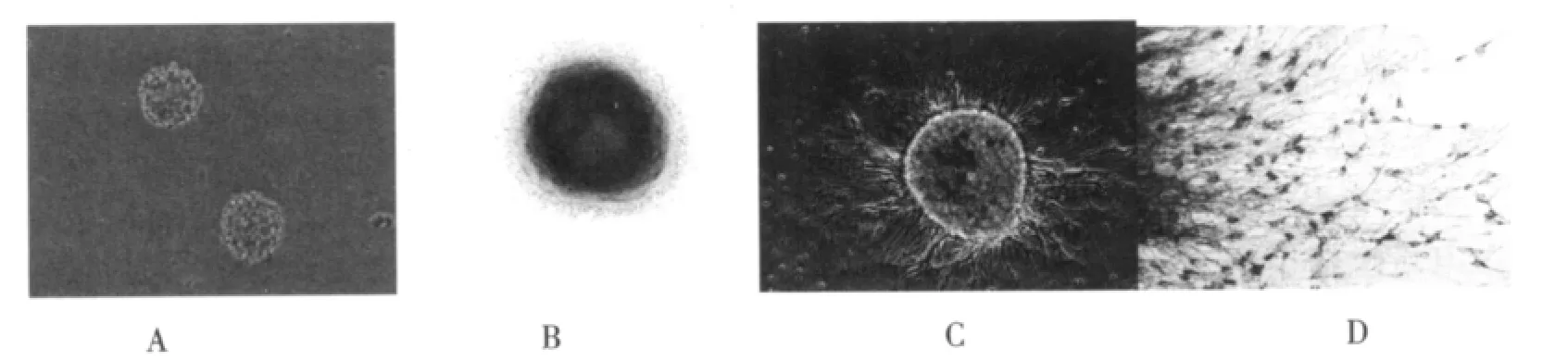
图3 神经干细胞的分化情况
2.3 嗅鞘细胞凋亡检测结果
7d、14d、21d对A组和B组tunnel细胞凋亡比例分别为 A组 0.9%、1.2%、1.4%,B组 1%、3.3%、8.6%,结果见图4。
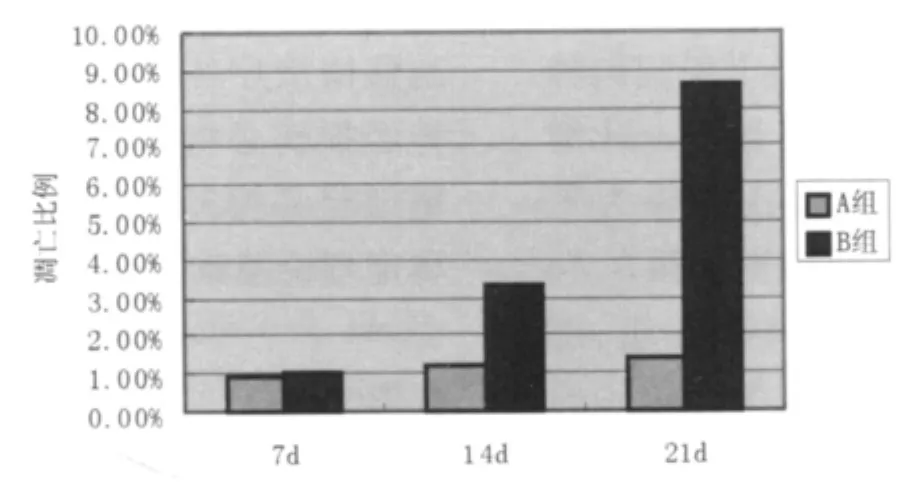
图4 嗅鞘细胞凋亡比例
2.4 二组细胞膜片钳检测结果
A组细胞于12d行膜片钳检测:钠电流在-30mV下被激活,-10mV左右达到最大,+40mV和+50mV之间 电流值翻转变为外向电流(图5)。钾电流激活电压为-20mV,其激活和失活都比较慢,应为延迟整流钾电流(图6)。
3 讨论

图5 膜片钳检测钠电流情况

图6 膜片钳检测钾电流情况
研究表明,嗅鞘细胞不但能直接参与神经轴突髓鞘的形成而且还分泌多种营养因子,被许多学者认为是治疗中枢神经损伤最好的移植细胞之一,OECs被植入损伤的中枢,可以形成细胞桥引导神经轴突生长,并向远距离延伸[1-2]。成熟中枢神经系统的胶质细胞在体外不能生长,而来源于成熟嗅觉系统的OECs却能生长。虽然其具体生长的分子及细胞基础还不清楚,但是嗅觉系统轴突延长和特定的靶向突触作用与嗅鞘细胞的促生长作用密不可分的。 嗅鞘细胞能分泌大量不同种类的神经营养和支持因子,如血小板源生长因子、神经肽、神经生长因子、脑源性神经营养因子和睫状神经生长因子等[3]。
RTRA是公认的能诱导NSC向神经元分化的较强的诱导剂,本研究显示嗅鞘细胞诱导神经干细胞分化成神经元比例稍高于RTRA组,虽无统计学差异,但表明嗅鞘细胞能强力诱导神经干细胞向神经元分化。7 d、14 d、21 d对A组和B组tunnel细胞凋亡比例检测显示A组细胞凋亡比例较为平稳,B组细胞凋亡比例7 d是与A组相当,而在14 d、21 d时凋亡比例大幅度升高明星高于A组,提示嗅鞘细胞上清液能在较长时间内减少分化后的细胞凋亡,研究表明神经生长因子、脑源性神经营养因子和睫状神经生长因子等能催进神经元细胞的存活。此外,本实验对A组细胞于12 d行膜片钳检测显示58%的细胞具有了电兴奋性,而电兴奋性是神经元细胞发挥功能的基础和外在表现,说明分化后的神经元细胞已经具备了神经元细胞的基本功能。
NSCs的分化受多种因素调节,与细胞起源和自身状态有密切关系[4]。体外培养的NSCs则与其所在微环境密切相关,其中主要因素就是培养基质中的各种因子,这些因子成分和浓度决定了NSCs的分化方向[5-7]。本实验研究表明嗅鞘细胞上清液诱导NSCs向神经元方向分化有明显作用,促进分化后的细胞存活,这可能与其能分泌多种细胞因子及抑制有害因子的作用相关,同时嗅鞘细胞上清能促使NSCs分化后的神经元成为有功能的神经元,具备了替代受损的神经元细胞的相关基础。
由于神经干细胞具有多向分化能力,体内移植后易于存活等特点,可作为细胞移植治疗神经系统疾病或修复损伤神经组织的理想材料[8],随着干细胞研究领域向深度和广度不断扩展,神经干细胞细胞移植治疗各种中枢神经退行性变,脑瘫以及中枢神经损伤必将得到广泛的应用[9],本实验研究为嗅鞘细胞和神经干细胞联合移植治疗神经系统损伤奠定理论基础。
[1]Imaizumi T,Lankford KL,Kocsis JD.Transplantation of olfactory ensheathing cells or Schwann cells restores rapid and secure conduction across the transected spinal cord[J].Brain Res,2000,854(1-2):70-78.
[2]Ramón-Cueto A,Cordero MI,Santos-Benito FF,et al.Functional recovery of paraplegic rats and motor axon regeneration in their spinal cords by olfactory ensheathing glia[J].Neuron,2000,25(2):425-435.
[3]Li Y,Field PM,Raisman G.Repair of adult rat corticospinal tract by transplants of olfactory ensheathing cells[J].Science,1997,277(5334):2000-2002.
[4]许汉鹏,苟琳,杨浩,等.中枢神经系统不同部位来源的神经干细胞在体外生长特性的比较[J].解剖学报,2004,35(4):358-362.
[5]Lu J,Féron F,Mackay-Sim A,et al.Olfactory ensheathing cells promote locomotor recovery after delayed transplantation into transected spinal cord[J].Brain,2002,125(Pt 1):14-21.
[6]Buchet D,Serguera C,Zennou V,et al.Long-term expression of beta-glucuronidase by genetically modified human neural progenitor cells grafted into the mouse central nervous system[J].Mo1 Cell Neurosci,2002,19(3):389-401.
[7]Ramón-Cueto A,Nieto-Sampedro M.Regeneration into thespinal cord of transected dorsal root axons is promoted by ensheathing glia transplants [J].Exp Neurol,1994,127(2):232-244.
[8]Thompson RJ,Roberts B,Alexander CL,et al.Comparison of neuregulin-1 expression in olfactory ensheathing cells,Schwann cells and astrocytes[J].J Neurosci Res,2000,61(2):172-185.
[9]Radtke C,Wewetzer K.Translating basic research into clinical practice or what else do we have to learn about olfactory ensheathing cells[J]?Neurosci Lett,2009,456(3):133-136.
