剩余污泥热碱解及其用于微生物油脂生产的探索
2011-09-29徐静阳大浦宏隆刘德华梶原将
徐静阳,大浦 宏隆,刘德华,梶原将
1 清华大学化学工程系应用化学研究所,北京 100084
2 日本东京工业大学生命理工学部,横滨 226-8501
剩余污泥热碱解及其用于微生物油脂生产的探索
徐静阳1,2,大浦 宏隆2,刘德华1,梶原将2
1 清华大学化学工程系应用化学研究所,北京 100084
2 日本东京工业大学生命理工学部,横滨 226-8501
为了将剩余污泥中的蛋白质成分进行资源化利用,采用热碱解法进行处理,并尝试将处理后得到的上清液作为氮源培养圆红冬孢酵母用于微生物油脂的合成。结果表明,pH 13下处理5 h的条件对于污泥减量以及含氮物质析出最为有效,而污泥在pH 10处理5 h时得到的上清液则相对更适于酵母培养。在剩余污泥中添加NaOH调节初始pH为10,在60 ℃下处理5 h后中和体系pH值至7,得到的上清液经微孔膜过滤后用于配制限氮培养基可以使菌体生长良好,并且细胞内油脂含量达35%。
剩余污泥,热碱解,氮,产油酵母,微生物油脂
Abstract:To recover and use protein resources in excess sludge and decrease the cost of microbial lipid production,heat-alkaline was used to treat the sludge, and the hydrolysate was preliminarily used as nitrogen source to cultivate Rhodosporidium toruloides AS 2.1389 for lipid accumulation. Firstly, we treated the excess sludge under different alkaline conditions (pH 10, pH 12, pH 13) within the reaction time of 5–10 h to investigate the effect of nitrogen source release.Secondly, we used the sludge hydolysate to culture R. toruloides AS, and test the effect on cell growth. Results showed that treatment of excess sludge at pH 13 for 5 h was the most effective for nitrogen release. However, the hydrolysate obtained at pH 10 (5 h) was the most suitable for culturing R. toruloides AS, and under this condition, the inner-cellular lipid content could reach 35% of the total biomass weight.
Keywords:excess sludge, heat-alkaline treatment, nitrogen, oleaginous yeast, microbial lipid
随着近年来能源紧缺与环境问题的日益突出,生物柴油作为一种新型能源得到广泛重视。产油微生物可将多种可再生资源转化为油脂,即微生物油脂,且以其生产过程不占用耕地资源,可以连续产出等诸多的特点与优越性而受到关注,有望为生物柴油产业提供油脂原料。
微生物发酵产油脂大体分为菌体增殖期和油脂积累期两个阶段,前期细胞增殖需要消耗丰富的碳、氮源,保持菌体旺盛的代谢从而增加生物量,后期限制氮源从而使其积累油脂[1]。相应的,在发酵工艺上常用一步法限氮发酵或两步发酵法。近年来,已经报道的文献资料更多的是关注开发廉价碳源用于微生物油脂生产,例如对于糖蜜、秸秆水解液、菊芋抽提物等工业有机副产物、农林废弃物或非粮能源作物的利用[2-4]。然而,无论是一步法限氮发酵还是两步发酵,都需要在发酵前期消耗一定氮源从而使菌体生物量达到较高水平,而对于廉价氮源开发利用的关注较少。有机氮源,例如酵母粉、蛋白胨、豆粉、玉米浆等是菌体生长所需的优良氮源,但这些氮源往往价格较高,因此有必要开发廉价的氮源用以微生物油脂的合成与积累。
另一方面,剩余污泥作为活性污泥污水处理法产生的副产物,随着城市化和经济发展大量产生,其无害化处理处置成为一个亟待解决的问题。目前的处理方法主要为焚烧或填埋,处理费用占污水处理总费用的 65%[5],而且消耗大量能量的同时仍然存在环境安全隐患。因而活性污泥法处理污水从某种程度上来看,将水污染控制问题转化为了固废处理难题[6]。事实上,剩余活性污泥的主要有机成分是脂肪、蛋白质和碳水化合物,其中蛋白质含量占到约60%,但尚未得到充分利用。因此,开发利用剩余污泥不仅可以减少固体污染物排放,而且可以获得更高附加值产品。
本文采用热碱法水解剩余污泥,并将其上清液作为氮源用于产油脂酵母一步法限氮培养,考察微生物耐受剩余污泥碱解液的情况,以及碱解液对于菌体生长和油脂积累的影响,对将剩余污泥碱解液用于微生物油脂生产的可行性进行分析,为进一步开发利用剩余污泥和开发微生物油脂廉价氮源提供一定参考。
1 材料与方法
1.1 菌株
圆红冬孢酵母Rhodosporidium toruloides AS 2.1389购自中国普通微生物菌种保藏管理中心。
1.2 剩余污泥
剩余污泥取自日本神奈川县横滨市町田污水处理厂。污泥样品的总悬浮颗粒物 (MLSS) 为5 000~6 000 mg/L,含水量为99.48%。真空冷冻干燥后得到的干物质占原污泥样品的0.52%。
1.3 污泥处理
180 mL含1 g干物质的污泥悬浮液用10 mol/L的NaOH调节pH到设定条件 (分别为pH 10, pH 12以及pH 13),在60 ℃进行批式热碱处理,之后取用98%的硫酸调节pH到中性,离心 (8 000 r/min,15 min) 分离上清液和沉淀物,上清液使用孔径为0.45 µm的滤膜过滤后于−20℃保存。
1.4 培养基及培养方法
活化菌种及种子液培养使用YPD培养基 (1%酵母抽提物,1%蛋白胨,2%葡萄糖)。一步法油脂积累使用限氮培养基 (2%~7%葡萄糖,0.01% (NH4)2SO4,0.075%酵母抽提物,0.15% MgSO4·7H2O,0.04%KH2PO4)。
使用剩余污泥水解液配制培养基时,先将水解后分离得到的上清液通过孔径为0.45 µm的滤膜过滤,再加入一定量100 g/L的葡萄糖液调节葡萄糖含量到设定浓度。
培养过程采用一步发酵模式。将新鲜斜面上的圆红冬孢酵母菌种接种于含YPD液体培养基的摇瓶中,于30 ℃、200 r/min摇床培养24 h;之后离心集菌并洗涤,用去离子水重悬后接种于限氮培养基。考察剩余污泥碱解液对菌体生长的影响时,接种使初始菌体密度为0.05 mg/mL (由菌体在620 nm下的吸光度值根据菌密度对应吸光度值的校正曲线计算得到)。考察剩余污泥碱解液对菌体油脂合成与积累的影响,接种使初始菌体密度为0.5 mg/mL。
1.5 分析方法
菌体生物量的计算通过测取 620 nm下菌液的吸光度,并根据菌液密度对应吸光度的标准曲线校正得到。油脂提取采用酸热法[7]。元素组成由 CHN元素分析仪 (YANACO MT-5) 分析。总氮分析由紫外分光光度法测定,具体方法为:剩余污泥碱热解后的样品稀释至2 mg N/L以下,取10 mL,与2 mL SP液 (由2 g NaOH和3 g K2S2O8溶于100 mL去离子水配制) 充分混合,在120 ℃下加热30 min,冷却到室温,取5 mL上清液,加入1 mL体积分数为6%的盐酸,然后于220 nm测定吸光度,并由氮浓度对应吸光度值的标准曲线校正得到最终的氮浓度测定值。氨基酸组成使用液相色谱仪 (LC-20A,SHIMADZU) 进行分析。所有数据均为2个平行样的均值。
2 结果与分析
2.1 剩余污泥元素组成
为考察剩余污泥的主要元素组成,对其进行元素分析,结果如表 1所示。所用剩余污泥具有较高的N含量。如按蛋白质中N元素含量为16%估算,可得出剩余污泥中蛋白质含量为50%左右。当然,依据活性污泥本身性质的差别,其组成会有所不同。Chen等的研究中采用的剩余污泥样品含有约 60%的蛋白质,是污泥中含量最高的有机质组分[8];在Tanaka等的研究中剩余污泥中的蛋白质含量也有41%[9]。因此,剩余污泥是获得微生物培养所需氮源的潜在原料。
2.2 热碱法处理剩余污泥
热碱法是一种用于污泥减量化有效而简便的方法。Rocher等研究表明氢氧化钠相比于硫酸、盐酸、氢氧化钾等常用酸或碱在热化学法处理剩余污泥中具有更显著的优势[10]。通常认为在 55 ℃以上细胞失活分解,高温更有利于细胞失活。为减少能耗和避免由于温度过高造成的产物复杂化,本文中热解的温度设定在60 ℃,选择了初始pH值分别为10、12和13的条件进行碱解实验。

表1 剩余污泥中干物质主要元素的含量Table 1 Basic composition of excess sludge sample
2.2.1 处理时间对碱热解处理效果的影响
热碱法降解剩余污泥或提取蛋白多采用 3~5 h及以上的处理时间,已有研究表明[11],5 h以内总悬浮颗粒物的减少是一个较快的过程,5 h之后减量的趋势减缓或无明显变化。并且,从氮元素析出来看,5 h之后析出基本停止。但是考虑到氮元素的析出包含 2个步骤,首先是剩余污泥中生物质细胞的破碎从而释放出蛋白质,接下来是蛋白质进一步分解成包含氨基酸在内的小分子物质。为了使大多数的氮元素析出,并水解成更容易被微生物利用的小分子物质,在处理时间的选择上,选择了5 h、8 h和10 h的处理时间以考察氮析出和体系pH值的变化情况 (表 2)。
可以发现强碱性条件更有利于氮元素的析出,而 5 h以后含氮物质析出变得不再明显。值得注意的是,在不继续投加碱的情况下,除了初始pH值为13的情况以外,其余条件均无法维持最初的pH值。这可能与生物质胞内有机物物质溶出并水解得到有机酸有关[12]。

表2 不同pH条件下氮的析出随时间的变化Table 2 Effect of pH and time on nitrogen source release
2.2.2 初始pH对剩余污泥水解及氮元素析出的影响
为了评价不同初始 pH条件对污泥减量以及氮元素析出的影响,经过 5 h碱热处理后高速离心分离上清液和沉淀物,并对两者分别分析得到活性污泥碱热解处理后的总悬浮颗粒物 (MLSS) 减少量以及氮元素析出百分比,如表3所示。

表3 不同初始pH值条件对总悬浮颗粒物的减量和氮的析出的影响Table 3 Hydrolysis effect under different alkaline conditions
初始pH值为13的处理条件相比于初始pH值为10和12的条件更有利于总悬浮颗粒物的减少以及氮元素析出,但是碱的投加量也明显增加,分别为pH 10和pH 12条件下碱投加量的33倍和4倍。此外,不同的处理条件所得到的碱解上清液中的氨基酸组成也有所不同 (表4)。
在碱热解后的上清液中,大约有14~16种天然氨基酸存在,包括赖氨酸 (Lys)、苯丙氨酸 (Phe)、亮氨酸 (Leu)、异亮氨酸 (Ile)、半胱氨酸 (Cys)、蛋氨酸 (Met)、缬氨酸 (Val)、络氨酸 (Tyr)、脯氨酸 (Pro)、丙氨酸 (Ala)、苏氨酸 (Thr)、精氨酸(Arg)、组氨酸 (His)、甘氨酸 (Gly)、丝氨酸 (Ser)、谷氨酸 (Glu) 和天冬氨酸 (Asp)。不同碱性处理条件得到的水解液中的氨基酸含量和组成亦有所不同,但这些氨基酸种类基本覆盖了通常被用于微生物培养的蛋白胨中的氨基酸组分,因而具有被微生物利用的潜力。
初始pH值为10的处理条件得到了占初始活性污泥干重7.9%的氨基酸。Liu等[13]曾使用热酸法处理剩余污泥得到含氨基酸的水解液并用来制备氨基酸氮肥,最优条件为在约120 ℃的高温下通过两步法先后处理共约 15 h,提取出了占初始污泥干重10%~13%的氨基酸。相比之下,本文的处理条件所用时间大大缩短,但氨基酸产率也已经接近于前面报道的最优结果,这证明了热碱解法的高效性。

表4 不同初始pH值条件处理剩余污泥对碱解液中氨基酸得率的影响Table 4 Effect of alkaline addition on the yields of amino acids
然而值得注意的是,在更高的碱性条件下 (初始pH值为12或13) 虽然可以得到更高的氮析出量,其氨基酸产量却低于处理前污泥干重的 1%。这可能与体系当中蛋白质组分的转化有关。在水热以及碱的作用下,碳水化合物与蛋白质 (氨基酸) 可能发生某些复杂的反应,从而将蛋白质 (氨基酸) 转化为其他物质。例如碳水化合物与蛋白之间的美拉德反应 (Maillard reaction) 会生成类黑色素和腐殖酸等难溶物,从而影响到污泥减量的效果,而且这类物质的存在可能对微生物的生长造成抑制性作用[14-16]。在本文的实验过程中也确实观察到了不同 pH值条件下处理后得到上清液的颜色的不同,除了 pH 10条件下处理得到的上清液接近无色 (略显浅黄色)以外,其余两种处理条件得到的上清液相比处理前颜色加深,特别是pH 13条件下得到的上清液棕褐色更明显,表明了色素物质的产生。
2.3 污泥碱解液作为产油微生物生长氮源的初步探索
由于碱解液中的成分比较复杂,因而首先对菌体耐受性情况作了初步考察。碱解液调节pH值至中性后与100 g/L葡萄糖液按4∶1的体积比混合,再添加无机盐营养物MgSO4·7H2O和 KH2PO4至浓度分别为1.5 g/L和0.4 g/L,然后接种圆红冬孢酵母种子液并培养50 h观察其生物量的变化。结果如图1所示。可看出pH 10碱解液中,酵母生长情况良好,说明其中的含氮物质可以为菌体所利用。在 pH 12与pH 13条件处理得到的碱解液中,菌体生长受到显著抑制,这说明高碱性条件处理得到的碱解液中存在抑制菌体生长的物质。并且在采用pH 13处理得到的碱解液作为氮源进行培养时发现菌体出现明显结团现象,后期不能正常生长。另外,由于在较高pH值下水解污泥后采用硫酸中和过量的碱,产生的盐离子可能造成较高的渗透压抑制菌体生长。在本文研究的处理强度下,碱解液中和后钠离子的浓度在0.03~1.22 g/L的范围。因此,我们设计对照实验,在普通限氮培养基中添加与3种碱解液中存在的钠离子等量的盐并考察酵母的生长,发现酵母的生长无明显的抑制现象,说明此浓度范围内的盐离子并不足以抑制菌体的生长。由此推测在较高 pH值下处理污泥后碱解液不能被菌体利用的原因应该是由于热碱处理过程中生物质溶胞,进而有机物之间发生复杂反应,生成了对菌体生长具有抑制作用的有毒物质。因此如将碱解液适当稀释以降低有毒物质的抑制作用,菌体有可能会利用氮源生长并进行油脂积累。于是,我们将 3种不同的碱解液稀释至同一氮源浓度 (96 mg/L) 后添加 2%葡萄糖以及无机盐 (0.15% MgSO4·7H2O,0.04% KH2PO4),考察其对菌体生长的影响,并采用以硫酸铵和酵母抽提物为氮源的限氮培养基 (96 mg/L) 作为对照 (培养基中其他成分与试验组一致,具体见“材料与方法”部分),结果如图2所示。实验结果表明,此时3种碱解液中菌体都可以生长,但是仅有pH 10条件下处理所得碱解液中的菌体生长与对照保持一致。此结果进一步证明在较高 pH值下水解污泥会生成对菌体生长具有抑制作用的有毒物质,且 pH值越高,有毒物质的浓度越大。通过稀释可以降低有毒物质的浓度,从而降低其对菌体生长的抑制作用,但简单稀释的同时也降低了氮源的浓度,不利于生物量的积累。因此,如要充分利用较高pH值水解液作为氮源,还需要进行脱毒处理。

图1 不同初始pH值处理污泥后碱解液用于圆红冬孢酵母菌生长Fig. 1 Cell growth of R. toruloides with sludge hydrolyzate as nitrogen sources.

图2 不同初始pH值处理污泥后碱解液经稀释用于圆红冬孢酵母菌生长Fig. 2 Cell growth of R. toruloides with diluted sludge hydrolyzate as nitrogen sources.
2.4 碱解液用于微生物油脂合成
由于以pH 10条件下处理得到的碱解液作为氮源时菌体生长没有出现明显抑制的迹象,因而进一步以此碱解液为氮源考察了其对微生物油脂合成与积累的影响。为了保证有足够的碳源与无机营养物用于菌体生长以及油脂合成,并使培养基维持较高的碳氮比以利于油脂合成与积累,试验组与对照组均添加 7%葡萄糖和少量无机营养物 (0.15%MgSO4·7H2O, 0.04% KH2PO4),使得培养基中的碳氮比达到300∶1。在此条件下以一步限氮培养的方式培养7 d后测定生物量浓度以及菌体中油脂含量,结果如表 5所示。在本实验条件下,试验组与对照组的碳源 (葡萄糖) 均过量,发酵结束后仍分别残余4.0%和 3.8%的葡萄糖。与对照样相比,碱解液中培养可得到更高的生物量、相当的油脂产量,且胞内油脂含量达到 34.6%,这就说明了菌体在碱解液中进行油脂积累的可行性。但胞内油脂含量相对对照较低,这可能是由于碱解液中存在某些利于菌体生长的微量元素或有机质,因而碳源更多地流向生物量积累,流向油脂合成代谢的碳源自然减少,因此油脂含量相对较低,生物量则相对更高。
结合近年来关于产油微生物利用非精制原料发酵生产微生物油脂的文献报道来看,在摇瓶培养的条件下,依据营养条件、培养方式、原料成分复杂性的不同,油脂产量高低不等,通常在3~10 g/L[3,17-18];而圆红冬孢酵母在利用葡萄糖为碳源时最优结果可以达到油脂产量 13.9 g/L[19]。因此,在本文所探讨的剩余污泥碱解液可以用于产油微生物培养及油脂合成的结论之上,如若对剩余污泥处理工艺、产油酵母培养方式和培养基营养组成进行优化,还应有进一步提升油脂产量的空间。
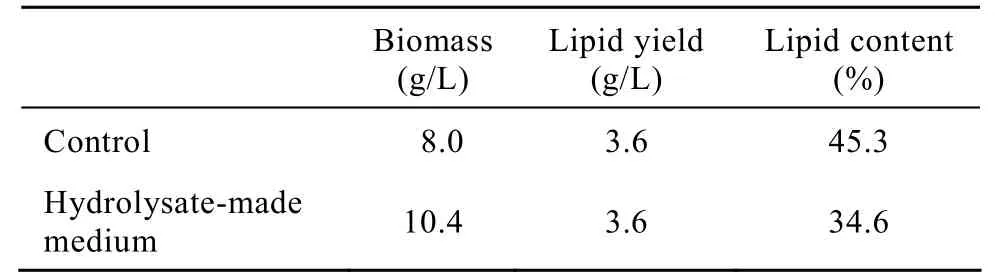
表5 在剩余污泥碱解液中培养菌体用于油脂积累Table 5 Lipid accumulation in media made from excess sludge hydrolysate
此外,值得一提的是,提取得到的微生物油脂的颜色相比对照更显深红色。圆红冬孢酵母本身可以合成以β-胡萝卜素、圆酵母素、红酵母红素为主的红色素[20],而某些包括化学物质和金属离子在内的环境压力因素会导致红色素合成量与红色素组成的变化[21],因此,在本文中积累得到的油脂的颜色可能暗示了在污泥碱解液中培养酵母,生长环境的变化对其代谢产生了一定的影响。
综上所述,本文的研究结果为剩余污泥的资源化利用提供了一种新的可能性,但同时也仍旧存在一些值得探究的问题。一方面,针对污泥蛋白质资源化应用的处理条件非常关键,以本文所应用的热碱法为例,虽然可以高效地实现污泥减量和溶胞析出有机质,但是处理体系中复杂的物质组成使得一些复杂的物理化学变化不可避免,而这些变化所带来的产物可能会对进一步利用热碱解产物带来困难。因此对于污泥处理条件以及其中有机质变化的机理的研究非常重要,如果有必要甚至需要进行后续的脱毒处理。另一方面,原本污泥资源化应用的一个限制因素就是其中含有的有毒物质、重金属成分、以及可能存在的病原性物质,因此在应用污泥中的蛋白成分的同时,有必要深入考察这些有毒物质的流向,以消除不利因素,从而真正实现污泥无害化处置和资源化利用。
3 结论
本文采用热碱法处理剩余污泥,初步考察了不同初始 pH条件以及处理时间对于污泥减量和氮的析出的影响,并且尝试了利用碱解液培养圆红冬孢酵母,发现其中的氮源可以被酵母所利用。当调节剩余污泥初始pH值至10,在60 ℃下处理5 h后,总悬浮颗粒物的减少量为47%,上清液中氮含量达到240 mg /L,其中和后能够作为氮源培养圆红冬孢酵母生产油脂。酵母在添加了 7%葡萄糖及少量无机盐 (0.15% MgSO4·7H2O, 0.04% KH2PO4) 的剩余污泥碱解液中培养7 d,生物量达到10.4 g/L,而油脂含量占到菌体干重的约 35%。本研究结果表明,剩余污泥通过热碱解后可作为氮源用于微生物培养合成油脂进而用于生物柴油生产。这种新的污泥利用方式不仅可以实现剩余污泥的减量化,而且可以变废为宝,实现其高附加值化利用。
REFERENCES
[1] Wynn JP, Hamid AA, Li YH, et al. Biochemical events leading to the diversion of carbon into storage lipids in the oleaginous fungi Mucor circinelloides and Mortierella alpine. Microbiology, 2001, 147(10): 2857−2864.
[2] Zhu LY, Zong MH, Wu H. Efficient lipid production with Trichosporon fermentans and its use for biodiesel preparation. Bioresour Technol, 2008, 99(16): 7881−7885.
[3] Huang C, Zong MH, Wu H, et al. Microbial oil production from rice straw hydrolysate by Trichosporon fermentans.Bioresour Technol, 2009, 100(19): 4535−4538.
[4] Zhao X, Wu SG, Hu CM, et al. Lipid production from Jerusalem artichoke by Rhodosporidium toruloides Y4. J Ind Microbiol Biotechnol, 2010, 37(6): 581−585.
[5] Liu Y. Chemically reduced excess sludge production in the activated sludge process. Chemosphere, 2003, 50(1): 1−7.
[6] Weemaes MPJ, Verstraete WH. Evaluation of current wet sludge disintegration techniques. J Chem Technol Biotechnol, 1998, 73(2): 83−92.
[7] Li ZF, Zhang L, Shen XJ, et al. A comparative study on four method of fungi lipid extraction. Microbiol China,2001, 28(6): 72−75.
李植峰, 张玲, 沈晓京, 等. 四种真菌油脂提取方法的比较研究. 微生物学通报, 2001, 28(6): 72−75.
[8] Chen YG, Jiang S, Yuan HY, et al. Hydrolysis and acidification of waste activated sludge at different pHs.Water Research, 2007, 41(3): 683−689.
[9] Tanaka S, Kobayashi T, Kamiyama KI, et al. Effects of thermnchemical pretreatment on the anaerobic digestion of waste activated sludge. Water Sci Technol, 1997, 35(8):209−215.
[10] Rocher M, Goma G, Pilas Begue A, et al. Towards a reduction in excess sludge production in activated sludge processes: biomass physicochemical treatment and biodegradation. Appl Microbiol Biotechnol, 1999, 51(6):883−890.
[11] Miyanaga K. Biomass transformation in the process of excess sludge reduction. The 3rd conference of the chemical society of Japan, Kanto Branch, 2009.
[12] Wang ZJ, Wang W, Li FF. Development and application of thermal hydrolysis technology for sludge treatment. China Water and Wastewater, 2003, 19(10): 25−27.
王治军, 王伟, 李芬芳. 污泥热水解技术的发展及应用.中国给水排水, 2003, 19(10): 25−27.
[13] Liu YS, Kong SF, Li YQ, et al. Novel technology for sewage sludge utilization: preparation of amino acids chelated trace elements (AACTE) fertilizer. J Hazard Mater, 2009, 171(1/3): 1159−1167.
[14] Penaud V, Delgenes JP, Moletta R. Characterization of soluble molecules from thermochemically pretreated sludge. J Envioron Eng-ASCE, 2000, 126(5): 397−402.
[15] Einarsson H, Snygg BG, and Eriksson C. Inhibition of bacterial growth by Maillard reaction products. J Agric Food Chem, 1983, 31(5): 1043−1047.
[16] Tauer A, Elss S, Frischmann M, et al. Influence of thermally processed carbohydrate/amino acid mixtures on the fermentation by Saccharomyces cerevisiae. J Agric Food Chem, 2004, 52(7): 2042−2046.
[17] Angerbauer C, Siebenhofer M, Mittelbach M, et al.Conversion of sewage sludge into lipids by Lipomyces starkeyi for biodiesel production. Bioresour Technol,2008, 99(8): 3051−3056.
[18] Fakas S, Papanikolaou S, Batsos A, et al. Evaluating renewable carbon sources as substrates for single cell oil production by Cunninghamella echinulata and Mortierella isabellina. Biomass Bioenerg, 2009, 33(4): 573−580.
[19] Li YH, Liu B, Zhao ZB, et al. Optimization of culture conditions for lipid production by Rhodosporidium toruloides. Chin J Biotech, 2006, 22(4): 650−656.
李永红, 刘波, 赵宗保, 等. 圆红冬孢酵母菌发酵产油脂培养基及发酵条件的优化研究. 生物工程学报, 2006,22(4): 650−656.
[20] Buzzini P, Innocenti M, Turchetti B, et al. Carotenoid profiles of yeasts belonging to the genera Rhodotorula,Rhodosporidium, Sporobolomyces, and Sporidiobolus.Can J Microbiol, 2007, 53(8): 1024−1031.
[21] Bhosale P. Environmental and cultural stimulants in the production of carotenoids from microorganisms. Appl Microbiol Biotechnol, 2004, 63(4): 351−361.
Heat-alkaline treatment of excess sludge and the potential use of hydrolysate as nitrogen source for microbial lipid production
Jingyang Xu1,2, Takahiro Oura2, Dehua Liu1, and Susumu Kajiwara2
1 Institute of Applied Chemistry, Department of Chemical Engineering, Tsinghua University, Beijing 100084, China
2 Department of Life Science, Graduate School of Bioscience and Biotechnology, Tokyo Institute of Technology, Yokohama 226-8501, Japan
Received: November 24, 2010; Accepted: January 6, 2011
Supported by: Tsinghua Research Funding (No. 2009THZ0223).
Corresponding author: Dehua Liu. Tel/Fax: +86-10-62772130; E-mail: dhliu@tsinghua.edu.cn
清华自主研发项目 (No. 2009THZ0223) 资助。
