无机碳源对小球藻自养产油脂的影响
2011-09-29郑洪立高振张齐黄和纪晓俊孙洪磊窦畅
郑洪立,高振,张齐,黄和,3,纪晓俊,孙洪磊,窦畅
1 南京工业大学生物与制药工程学院,南京 210009
2 南京工业大学食品与轻工学院,南京 210009
3 材料化学工程国家重点实验室,南京 210009
4 中国石油天然气股份有限公司石油化工研究院,北京 100029
无机碳源对小球藻自养产油脂的影响
郑洪立1,高振2,张齐1,黄和1,3,纪晓俊1,孙洪磊4,窦畅1
1 南京工业大学生物与制药工程学院,南京 210009
2 南京工业大学食品与轻工学院,南京 210009
3 材料化学工程国家重点实验室,南京 210009
4 中国石油天然气股份有限公司石油化工研究院,北京 100029
旨在研究小球藻利用无机碳自养产油脂,考察了3种无机碳源 (Na2CO3、NaHCO3和CO2) 及其初始浓度对小球藻产油特性的影响。结果表明,小球藻能利用Na2CO3、NaHCO3和CO2产油;经Na2CO3、NaHCO3和CO2培养10 d后,随着每种无机碳源浓度的增加,小球藻产量均先增加后减少。小球藻经3种无机碳源培养后,其培养液pH值上升。最适宜的Na2CO3和NaHCO3添加量均为40 mmol/L,其生物量分别达到0.52 g/L和0.67 g/L,产油量分别达到0.19 g/L和0.22 g/L。在3种无机碳源中,CO2是最佳无机碳源,当CO2浓度为6%时,小球藻生长最快,生物量达2.42 g/L,产油量最高达0.72 g/L;当CO2浓度过低时,无机碳供应不足,油脂产量低;当CO2浓度过高时,培养液pH偏低,小球藻油脂积累受到抑制。Na2CO3和NaHCO3较CO2更有利于小球藻积累不饱和脂肪酸。
小球藻,自养,无机碳,生物柴油
Abstract:We studied the effects of three inorganic carbon sources, Na2CO3, NaHCO3and CO2, and their initial concentrationson lipid production of Chlorella vulgaris. Chlorella vulgaris could utilize Na2CO3, NaHCO3and CO2to produce lipids. After 10-day cultivation with each of the three inorganic carbon sources, lipid yield of Chlorella vulgaris reached its peak with the concentration increase of the inorganic carbon source, but dropped again by further increase of the concentration. The pH value of the culture medium for Chlorella vulgaris increased after the cultivation on inorganic carbon source. The optimal concentration of both Na2CO3and NaHCO3was 40 mmol/L, and their corresponding biomass dry weight was 0.52 g/L and 0.67 g/L with their corresponding lipid yield 0.19 g/L and 0.22 g/L. When the concentration of CO2was 6%, Chlorella vulgaris grew the fastest and its biomass dry weight was 2.42 g/L with the highest lipid yield of 0.72 g/L. When the concentration of CO2was too low, the supply of inorganic carbon was insufficient and lipid yield was low. A too high concentration of CO2caused a low pH and lipid accumulation was inhibited. Na2CO3and NaHCO3were more favorable for Chlorella vulgaris to accumulate unsaturated fatty acids than that of CO2.
Keywords:Chlorella vulgaris, autotrophy, inorganic carbon, biodiesel
目前人类使用的能源主要是化石能源,而化石能源存在不可再生、其使用后造成环境污染、危害人类健康、CO2排放等严重的问题,开发化石能源的替代能源已经成为科技工作者的当务之急[1-2]。生物柴油以其可再生、环境友好、安全的特性,被视为本世纪最具发展潜力的新能源之一。生物柴油的原料有很多,但是相比之下,微藻油脂作为生物柴油原料有其独特的优势,因微藻光合作用效率高、生长周期短、单位面积产量大、易于培养、油脂含量高、减排 CO2,而且能将产油脂与太阳能利用、废水净化相结合;微藻生物柴油已成为国内外科学家的研究热点[3]。
小球藻是一种富含油脂的微藻[4],其油脂是以CO2为光合作用反应物经一系列代谢而合成。研究报道表明[5],小球藻还能利用细胞表面的碳酸酐酶将转化成CO2供RUBPase固定,因此小球藻只能固定水中 CO2和两种形式的溶解无机碳。目前,小球藻生物柴油研究过程中采用的碳源一般为无机碳源,所用无机碳源多为 CO2,研究多集中于 CO2浓度优化[6]、通 CO2速率对小球藻产油的影响[7],在小球藻利用 CO2产油研究方面已取得了较大进展。和形式的无机碳源对小球藻产油的影响未见报道。海水中存在 Ca2+、Mg2+等离子,会对Na2CO3、NaHCO3和CO2三种无机碳源在培养液中所形成的溶解无机碳形式及其比例产生影响。培养液中溶解无机碳形式及其比例影响小球藻对其中和 CO2的利用,因而 Na2CO3、NaHCO3和 CO2三种无机碳源会影响小球藻生长及其油脂合成代谢。而目前尚未见有关不同无机碳源(Na2CO3、NaHCO3和 CO2) 及其初始浓度对海洋小球藻光合作用及其油脂合成代谢、脂肪酸分布影响的报道。
本文以海洋小球藻为实验对象,研究 3种无机碳源 (Na2CO3、NaHCO3和CO2) 及其各初始浓度下小球藻的产油特性,并分析脂肪酸组成的差异,旨在提高小球藻对无机碳源的利用效率及其产油效率,为自养小球藻工业化高产油脂和减排 CO2提供理论基础和实验依据,推动微藻生物柴油的发展。
1 材料与方法
1.1 试验材料
藻种:试验所用的小球藻 Chlorella vulgaris LICME001 (中国典型培养物保藏中心编号:CCTCC No: M 209256) 由南京工业大学工业催化与代谢工程实验室保藏。
保种培养基:采用f/2液体培养基。
试验培养基 (g/L):海盐 34,Na2EDTA 0.1,FeSO4·7H2O 0.05,KH2PO40.1 和 KNO30.3。分别加入初始浓度为 0、20、40、60和 80 mmol/L的Na2CO3或NaHCO3,或通入浓度为0、3%、6%、9%和 12%的 CO2(供气采用高纯 CO2钢瓶与高纯N2钢瓶,CO2和N2气体混合用气体混合器来实现,通气量为 0.3 vvm),以研究不同无机碳源下小球藻产油特性。以0.5 mol/L NaOH或HCl调节培养基的初始pH值。
1.2 试验方法
摇瓶培养:根据试验设计的要求,将对数期藻种细胞接种到250 mL三角瓶,接种量 (V/V) 为10%,在恒温光照摇床中培养,条件为150 r/min,25 ℃,光照强度2 000 lx。
光生物反应器培养:将摇瓶中培养到对数期的藻种接种到反应器中,反应器为本实验室自主设计的鼓泡式光生物反应器,反应器规格:体积为2 L (工作体积为1.5 L);外置光源 (日光灯),接种量 (V/V)为10%,整个培养过程光照强度为5 000 lx,光暗周期=12∶12,温度为 (25±2) ℃,培养周期为 10 d。
1.3 分析检测方法
叶绿素含量的测定:取5 mL藻液,低速离心收集藻细胞,用双蒸水洗3 次,加入5 mL的100%甲醇溶液,用移液器吹吸均匀,室温避光静置1 h后,8 000 r/min、4 ℃下离心10 min,取上清,测定OD652及OD665值。根据下列公式分别计算出叶绿素a和b含量 (单位:mg/L)[8]:
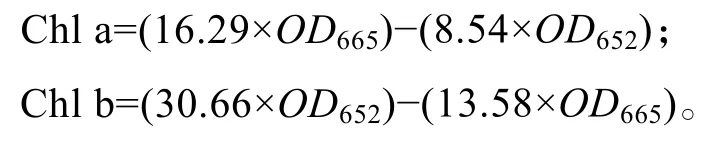
pH值测定:取30 mL藻液于离心管中,用pH计 (雷磁 pHS-3D,上海精密科学仪器有限公司)测定。
生物量的测定:用UV-1200型紫外可见分光光度计 (上海美谱达仪器有限公司) 在680 nm处测定藻液光密度 (OD),每天测定1次,根据标准曲线回归方程 C (生物量干重)=0.560×OD680(R2=0.986) 换算成藻生物质干重。
产油量测定:待测定藻液经离心收集藻体后,藻体用蒸馏水洗涤3 次,经溶菌酶破碎 (破碎条件:50 ℃,10 h,酶用量:50 mg/L),提取油脂,油脂提取采用Bligh和Dyer法[9],油脂重量测定采用称重法[10]。试验重复3 次,取平均值。
油脂组成 GC-MS检测:分别取经 Na2CO3(浓度:40 mmol/L)、NaHCO3(浓度:40 mmol/L) 和 CO2(浓度:6%) 培养10 d的藻粉0.5 g,经提取油脂,采用 KOH-CH3OH甲酯化[11],脂肪酸的气相色谱-质谱定性定量分析参考文献[12]。
2 结果与分析
2.1 三种无机碳源对小球藻生长的影响
2.1.1 三种无机碳源对小球藻光合色素的影响
叶绿素是小球藻的光合色素,其含量的高低直接影响光合作用效率[13]。图 1为不同初始浓度Na2CO3、NaHCO3和CO2对小球藻叶绿素 a和 b含量的影响。由图1可见,经过10 d培养,当Na2CO3初始浓度从0 mmol/L增加到80 mmol/L时,叶绿素a含量从1.18 mg/L增加到6.16 mg/L,叶绿素b含量从0.15 mg/L增加到1.96 mg/L;当Na2CO3初始浓度为40 mmol/L时,其叶绿素a含量为6.16 mg/L和叶绿素b含量为1.96 mg/L,均达到各自的最高。培养10 d后,当NaHCO3初始浓度从0 mmol/L增加到80 mmol/L时,叶绿素a含量从1.14 mg/L增加到8.71 mg/L,叶绿素b含量从0.28 mg/L增加到3.08 mg/L;当NaHCO3初始浓度为40 mmol/L时,其叶绿素a和b含量均达到各自的最大值,分别为8.71和3.08 mg/L。随着CO2浓度的增加,其对应的叶绿素a和b含量均分别呈先增加后下降的趋势;当CO2浓度为6%时,其叶绿素a含量为18.14 mg/L,叶绿素b含量为6.02 mg/L,均达到各自的最大值。三种无机碳源培养后,叶绿素 a与 b的比例为2∶1~4∶1。
三种无机碳源中,直接通 CO2时叶绿素含量最高,说明最有利于小球藻光合作用;实验过程发现:添加Na2CO3和NaHCO3时,培养液变浑浊,这可能与培养液添加了海盐,所使用的海盐中含有Mg2+、Ca2+等离子有关;试验中添加的Na2CO3和NaHCO3与海盐中的Mg2+、Ca2+等离子形成了MgCO3、CaCO3等沉淀,从而影响了小球藻光合作用过程中无机碳的供给和光合色素合成。而通入 CO2培养液没有变浑浊,说明没有形成沉淀,因此小球藻无机碳源的供给不受影响,其光合色素合成不受影响,光合作用效率高。在藻培养过程中 NaHCO3有两个作用:一是作为无机碳源,二是调节培养液pH值,保持碱性环境,可抑制污染生物繁殖,保证藻养殖质量。Yoo等的研究也表明无机碳源的供给影响小球藻的生长[6]。
2.1.2 三种无机碳源对小球藻培养结束时pH值的影响
将培养液的初始pH调至7.2,接种海洋小球藻藻种,培养10 d后,测定其培养液pH,各小球藻培养液的pH值见图2。经过10 d培养,当Na2CO3初始浓度从0 mmol/L增加到80 mmol/L时,pH值从7.6上升到9.2;当Na2CO3初始浓度为40 mmol/L时,其pH值达到最高为9.2。培养10 d后,当NaHCO3初始浓度从0 mmol/L增加到80 mmol/L时,pH值从7.7上升到9.8;当NaHCO3初始浓度为40 mmol/L时,其pH值达到最高为9.8。随着CO2浓度的增加,其对应的 pH值呈先增加后下降的趋势;当 CO2浓度为6%时,其pH值达到最大为9.5。较初始pH值,小球藻经不同初始浓度Na2CO3、NaHCO3和CO2培养10 d后,其培养液pH值均上升,即出现pH漂移现象,但漂移程度不同。研究结果表明,在不同初始浓度Na2CO3、NaHCO3和CO2培养下,小球藻生长越快,其 pH漂移越明显 (图2、3)。随着 pH的升高,小球藻生长变缓,说明改变后的pH可能已经偏离该藻的最佳生长范围。
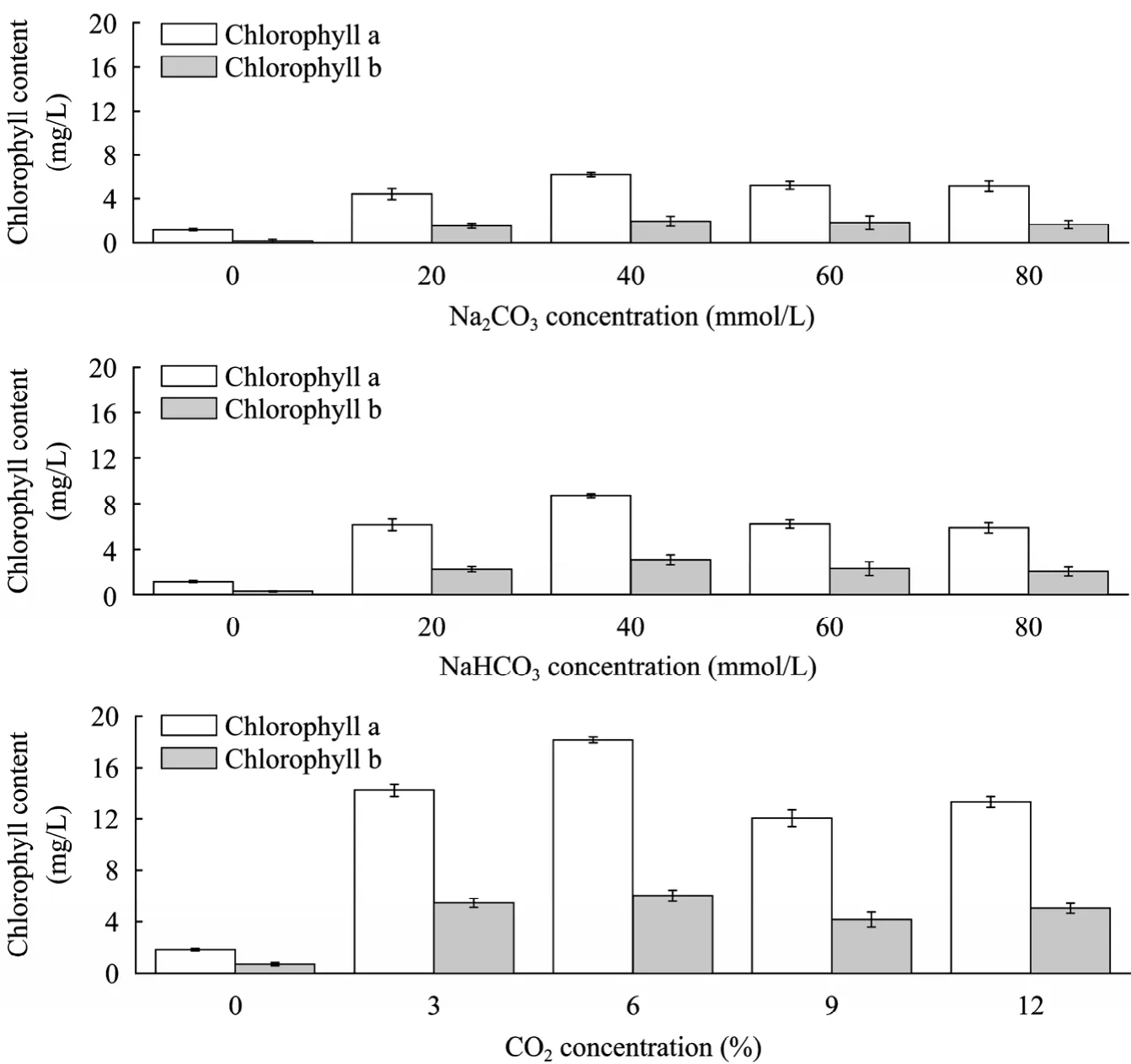
图1 三种无机碳源对叶绿素含量的影响Fig. 1 Effect of three kinds of inorganic carbon source on chlorophyll content of Chlorella vulgaris.

图2 三种无机碳源对小球藻培养液pH的影响Fig. 2 Effect of three kinds of inorganic carbon source on the pH of Chlorella vulgaris culture medium.
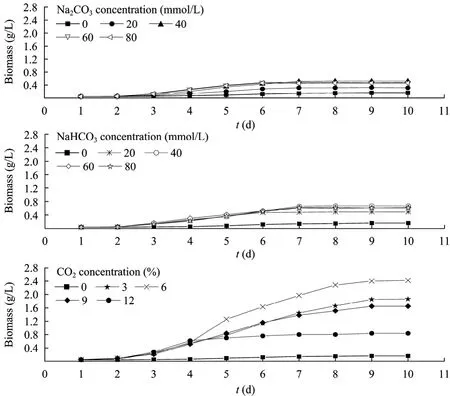
图3 三种无机碳源对小球藻生物量的影响Fig. 3 Effect of three kinds of inorganic carbon source on biomass of Chlorella vulgaris.
本研究结果表明三种无机碳源培养小球藻,出现pH漂移现象。这是由于小球藻在密闭光生物反应器中一定pH值的添加海盐培养液及适宜温度、光照等条件下连续照光,随小球藻光合作用对无机碳的利用,水中无机碳不断减少,导致pH值不断升高,故出现pH漂移的现象[14]。pH影响培养液中HCO3−、CO2和的存在形式和比例,为消除培养液初始pH值差异的影响,本实验3种无机碳培养液初始pH均调为7.2,此时培养液中HCO3−、CO2和存在形式和比例是一样的[15]。实验结果 (图3) 表明通 CO2最有利于小球藻对溶解无机碳的利用,NaHCO3次之,Na2CO3利用效果最差。这是由于在配培养液时 (调初始pH前),NaHCO3和Na2CO3与培养液所添加海盐中的 Mg2+、Ca2+等形成了沉淀,添加Na2CO3所形成的沉淀比NaHCO3多 (根据培养液的浑浊程度判断),而通CO2没有形成沉淀;故添加 NaHCO3、添加 Na2CO3和通 CO2培养液中所含HCO3−、CO2和的摩尔数不一样,通 CO2培养液所含、CO2和的摩尔数>添加NaHCO3培养液>添加 Na2CO3培养液。培养液 pH影响溶解无机碳形式及其比例,当海水pH值小于6时,溶解无机碳以和CO2两种形式存在,其中以CO2形式为主;当海水pH值介于6和9之间时,溶解无机碳以、CO2和CO32−三种形式存在,其中以形式为主;当海水 pH值大于 9时,溶解无机碳以和CO32−两种形式存在,其中以形式为主[15]。而小球藻只能固定 CO2和两种形式的溶解无机碳[5],本实验pH漂移影响小球藻对溶解无机碳的利用,故pH漂移影响小球藻的生长和产油。因此,对小球藻利用无机碳源产油的后续研究应进一步调控培养液pH,以期得到更理想的单位产油量。
2.1.3 三种无机碳源对小球藻生物量的影响
图3为不同初始浓度Na2CO3、NaHCO3和CO2对小球藻生物量的影响。从图 3中可以看出,当Na2CO3初始浓度为0~80 mmol/L时,各初始浓度对小球藻生物量的影响趋势相近,接种后 2 d内,各浓度的生物量没有差异;2 d后,随着培养天数的增加,各浓度的生物量均呈先增加后达到稳定,生物量在培养 7 d左右达到稳定,各浓度的最大生物量介于 0.16~0.52 g/L之间。当 NaHCO3初始浓度为0~80 mmol/L时,各初始浓度下小球藻生物量增长趋势相近,接种后 2 d内,各浓度的生物量没有差异;2 d后,随着培养天数的增加,各浓度的生物量均呈先增加后达到稳定,生物量在培养 7 d左右达到稳定,各浓度的最大生物量介于0.16~0.67 g/L之间。当CO2初始浓度为0~12%时,各初始浓度下小球藻生物量增长趋势相近,接种后2 d内,各浓度的生物量没有差异;2 d后,随着培养天数的增加,各浓度的生物量均呈先增加后达到稳定,生物量在培养 9 d左右达到稳定,各浓度的最大生物量介于0.16~2.42 g/L之间。当Na2CO3、NaHCO3和CO2初始浓度分别为40 mmol/L、40 mmol/L和6%时,其生物量 (分别为:0.52、0.67和2.42 g/L) 均达到各自的最大值,分别是未添加无机碳的3.3、4.2和15.1倍;Na2CO3、NaHCO3和 CO2初始浓度过高或过低生物量均减少。
直接通 CO2生物量最高,说明最有利于小球藻生长;而Na2CO3作为无机碳源时生物量最低,说明最不利于小球藻生长。这可能与Na2CO3和NaHCO3作为碳源会与海盐中 Mg2+、Ca2+等相关离子产生沉淀有关。在配培养液时,NaHCO3和Na2CO3与培养液所添加海盐中的 Mg2+、Ca2+等形成了沉淀,添加Na2CO3所形成的沉淀比 NaHCO3多 (根据培养液的浑浊程度判断),从而添加 Na2CO3比添加 NaHCO3对小球藻利用无机碳源的影响更大;而通 CO2没有形成沉淀,不影响小球藻对无机碳源的利用。本试验研究表明适宜浓度的无机碳源有利于小球藻的生长;这与刘然等的研究结果一致[16]。
2.2 三种无机碳源对小球藻油脂的影响
2.2.1 三种无机碳源对小球藻油脂产量的影响
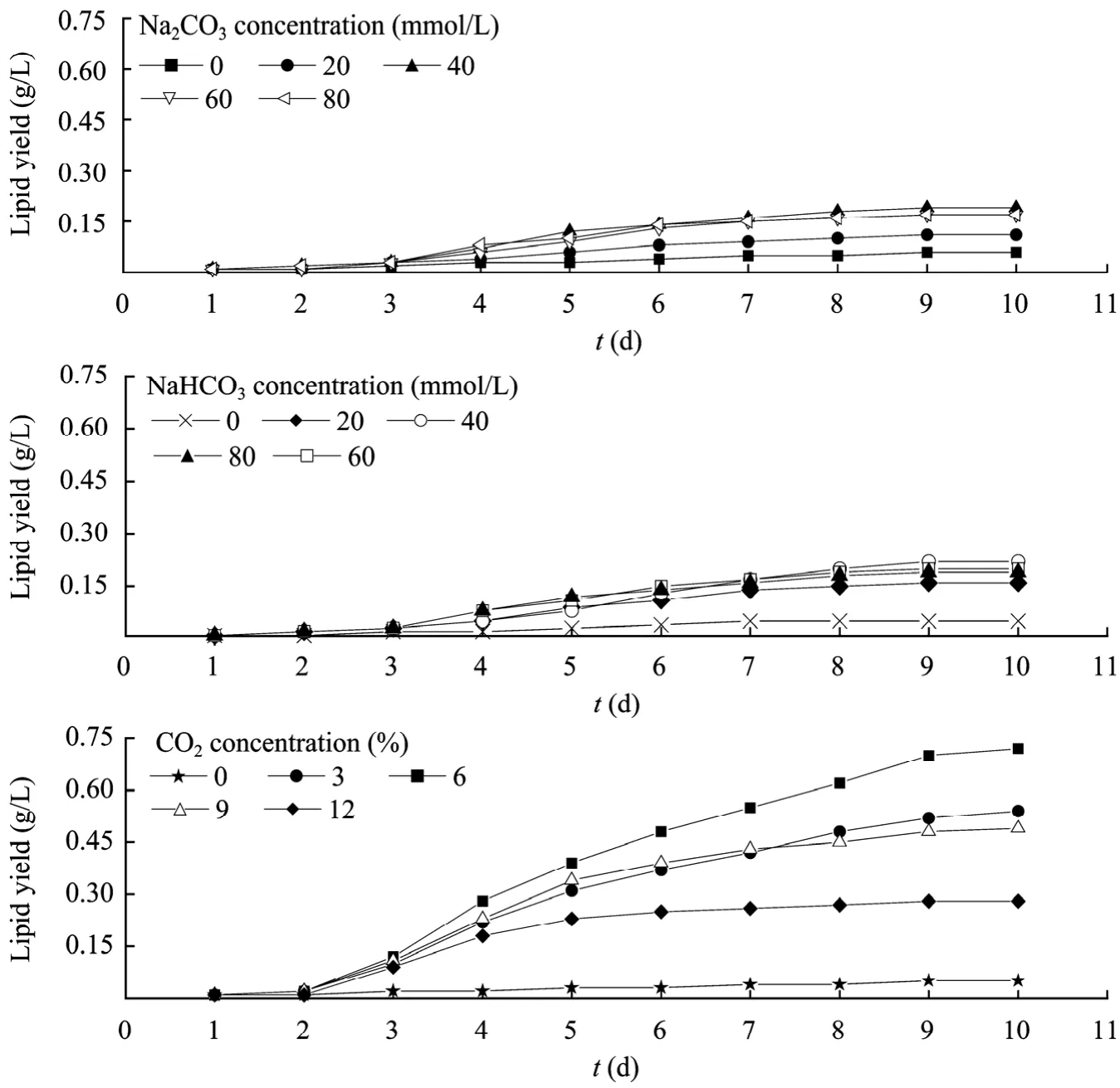
图4 三种无机碳源对小球藻油脂产量的影响Fig. 4 Effect of three kinds of inorganic carbon source on lipid yield of Chlorella vulgaris.
不同初始浓度Na2CO3、NaHCO3和CO2对小球藻油脂产量的影响见图4。由图4可知,接种后前2天,各浓度油脂产量均不增加,此后随着培养天数增加,对应的油脂产量均分别呈先快速增加后稳定增加;当Na2CO3、NaHCO3和CO2初始浓度分别为40 mmol/L、40 mmol/L和6%时,其对应油脂产量(分别为:0.19、0.22和0.72 g/L) 均达到各自的最大值;通CO2的最大油脂产量是添加Na2CO3、NaHCO3和未添加无机碳的 3.8、3.3和 12倍;Na2CO3、NaHCO3和 CO2初始浓度过高或过低均不利于油脂的合成。添加无机碳源较未添加的油脂产量高。
在三种无机碳源中,直接通CO2油脂产量最高,说明最有利于小球藻油脂积累;而Na2CO3作为无机碳源时油脂产量最低,说明最不利于小球藻油脂积累。在通入CO2过程中会形成对培养液的搅拌作用,搅拌作用一方面有利于藻细胞与培养液中营养物质等之间的充分接触,同时可避免藻细胞在培养过程中下沉。另一方面有利于藻在反应器中暗、光照区的交换,提高其光合效率,因此促进小球藻的生长和油脂积累[17]。低或高浓度CO2均不利于油脂积累,这可能是由于 CO2是光合作用和油脂合成的底物,CO2浓度低则光合作用和油脂合成的底物供应不足。而CO2浓度过高则会引起培养液的pH过低[7]。pH下降势必影响小球藻油脂合成过程中核酮糖1,5-二磷酸羧化酶、乙酰辅酶A羧化酶等关键酶活性。本研究还发现:通过驯化,可以显著提高小球藻对CO2浓度的耐受能力;经过 5个驯化周期,小球藻耐CO2浓度可达10%以上,这有待进一步研究。
2.2.2 三种无机碳源对小球藻脂肪酸组成的影响
为考察三种无机碳源对小球藻脂肪酸组成的影响,利用 GC-MS检测了最佳初始浓度 Na2CO3(40 mmol/L)、NaHCO3(40 mmol/L) 和 CO2(6%)对应小球藻主要脂肪酸的组成。由表1可得,培养10 d后,三种无机碳源 (Na2CO3、NaHCO3和CO2)培养的小球藻所含主要脂肪酸种类相同,且其碳链长度均介于C14到C20之间,其中95%以上脂肪酸是C16和C18系列脂肪酸;三种无机碳源培养的小球藻不饱和脂肪酸含量均在 70%以上,而添加Na2CO3和NaHCO3其不饱和脂肪酸比例较通入CO2高。这可能与不利条件下生长的微藻其不饱和脂肪酸含量会增加有关[18]。研究表明生物柴油含有的脂肪酸主要是棕榈酸 (C16∶0)、十六碳烯酸 (16∶1)、硬 脂 酸 (C18∶0)、 油 酸 (C18∶1) 和 亚 麻 酸(C18∶3)[19],而以上 5种脂肪酸在本实验小球藻脂肪酸中所占比例在90%以上,因此小球藻油脂是良好的生物柴油原料。
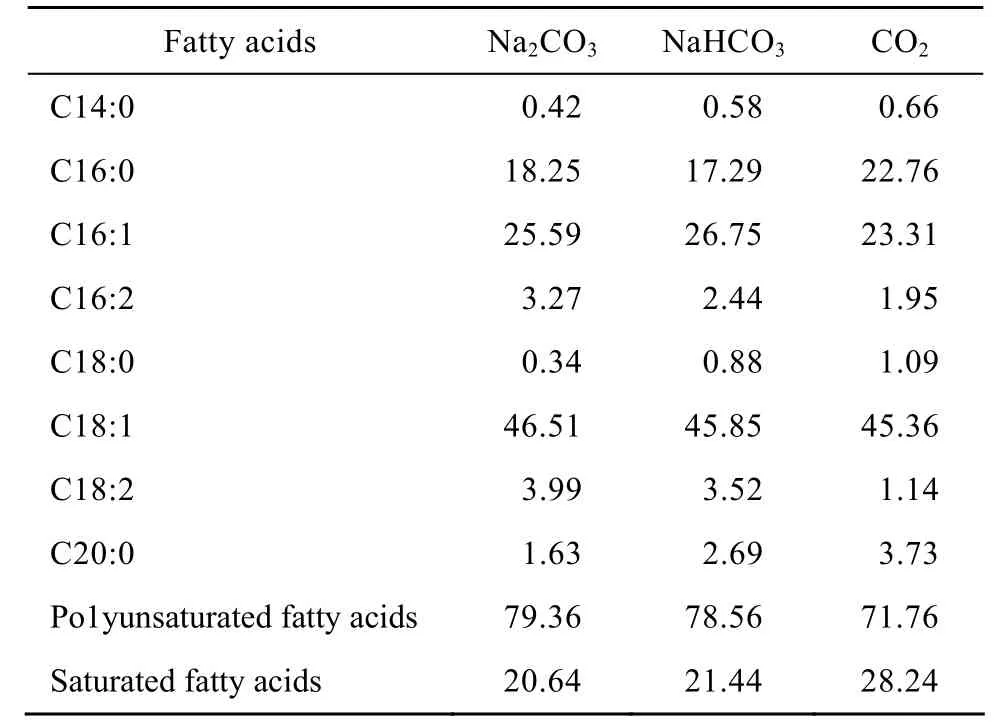
表1 三种无机碳源对小球藻脂肪酸组成 (占总脂肪酸含量的百分比) 的影响Table 1 Effect of three kinds of inorganic carbon source on fatty acids composition of Chlorella vulgaris (percent of total fatty acids)
3 结论
三种无机碳源及其初始浓度对小球藻生长及产油均具有显著影响。Na2CO3、NaHCO3和 CO2均可作为小球藻自养产油脂的碳源,Na2CO3、NaHCO3和CO2最佳初始浓度分别为40 mmol/L、40 mmol/L和 6%,Na2CO3、NaHCO3和 CO2初始浓度过高或过低均不利于小球藻生长及产油。由于本实验小球藻是海洋小球藻,所用海盐中存在 Ca2+、Mg2+等离子,Na2CO3和NaHCO3作为无机碳源的效果较差。CO2是最佳无机碳源;CO2作为无机碳源不会与海盐中的 Ca2+、Mg2+等离子形成沉淀,而向藻液中通入 CO2所形成的搅拌有利于小球藻受光、营养物质的吸收和防止小球藻细胞下沉。小球藻只能固定水中CO2和HCO3−两种形式的溶解无机碳,但Na2CO3也可作为小球藻自养产油脂的碳源,说明其在水中溶解后可能含有 CO2和HCO3−两种形式或其中某一种形式。小球藻叶绿素a与b的比例为2∶1~4∶1。小球藻经三种无机碳源培养后,其培养液 pH值上升。三种无机碳源 (Na2CO3、NaHCO3和CO2) 培养的小球藻所含主要脂肪酸种类相同,添加 Na2CO3和NaHCO3其不饱和脂肪酸比例较通入CO2高;三种无机碳源的脂肪酸95%以上是C16和C18系列脂肪酸,其不饱和脂肪酸含量均在70%以上,因此小球藻油脂是制备生物柴油的良好原料。
致谢:感谢中国石油天然气股份有限公司资助!
REFERENCES
[1] Sun T, Du W, Liu DH, et al. Stability of whole cell biocatalyst for biodiesel production from renewable oils.Chin J Biotech, 2009, 25(9): 1379−1385.孙婷, 杜伟, 刘德华, 等. 固定化全细胞催化可再生油脂合成生物柴油的稳定性. 生物工程学报, 2009, 25(9):1379−1385.
[2] Zheng HL, Zhang Q, Ma XC, et al. Research progress on bio-diesel producing microalgae cultivation. China Biotechnol, 2009, 29(3): 110−116.郑洪立, 张齐, 马小琛, 等. 产生物柴油微藻培养研究进展. 中国生物工程杂志, 2009, 29(3): 110−116.
[3] Chisti Y. Biodiesel from microalgae. Biotechnol Adv,2007, 25(3): 294−306.
[4] Schenk PM, Thomas-Hall SR, Stephens E, et al. Second generation biofuels: high-efficiency microalgae for biodiesel production. Bioenerg Res, 2008, 1(1): 20−43.
[5] Cheng LH, Zhang L, Chen HL, et al. Advances on CO2fixation by microalgae. Chin J Biotech, 2005, 21(2):177−181.程丽华, 张林, 陈欢林, 等. 微藻固定 CO2研究进展.生物工程学报, 2005, 21(2): 177−181.
[6] Yoo C, Jun SY, Lee JY, et al. Selection of microalgae for lipid production under high levels carbon dioxide.Bioresource Technol, 2010, 101(1): S71−S74.
[7] Chiu SY, Kao CY, Tsai MT, et al. Lipid accumulation andCO2utilization of Nannochloropsis oculata in response to CO2aeration. Bioresource Technol, 2009, 100(2): 833−838.
[8] Porra RJ, Thompson WA, Kriedemann PE. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy.Biochimica et Biophysica Acta, 1989, 975(3): 384−394.
[9] Elince GB, William MD. A rapid method of lipid extraction and purification. Can J Biochem and Physiol,1959, 37: 911−917.
[10] Converti A, Casazza AA, Ortiz EY, et al. Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production. Chem Eng Proc, 2009,48(6): 1146−1151.
[11] Volkman JK, Jeffrey SW, Nichols PD, et al. Fatty acid and lipid composition of 10 species of microalgae used in mariculture. J Exp Mar Biol Ecol, l989, 128(3): 2l9−240.
[12] Jin MJ, Huang H, Xiao AH, et al. A novel two-step fermentation process for improved arachidonic acid production by Mortierella alpina. Biotechnol Lett, 2008,30(6): 1087−1091.
[13] Liu ZY, Wang GC. Dynamics of lipid accumulation in marine microalga Chlorella vulgaris promoted by iron.Mar Sci, 2008, 32(11): 56−59.
刘志媛, 王广策. 铁促进海水小球藻油脂积累的动态过程. 海洋科学, 2008, 32(11): 56−59.
[14] Yue GF, Wang JX, Zhu MY, et al. Progress of inorganic carbon acquisition by algae (I): origin and methods of the studies. Mar Sci, 2003, 27(5): 15−18.
岳国峰, 王金霞, 朱明远, 等. 藻类无机碳营养的研究进展(I)——研究起源及研究方法. 海洋科学, 2003,27(5): 15−18.
[15] Beer S, Eshel A, Waisel Y. Carbon metabolism of seagrasses(I). The utilization of exogenous inorganic carbon species in photosynthesis. J Exp Bot, 1977, 28(5): 1180−1187.
[16] Liu R, Liu XJ, Wang M, et al. Effects of inorganic carbon sources on growth of Pinguiococcus pyrenoidosus CCMP 2078. Ecol Sci, 2007, 26(3): 227−231.
刘然, 刘晓娟, 王铭, 等. 不同无机碳源对粉核油球藻生长的影响. 生态科学, 2007, 26(3): 227−231.
[17] Michels MHA, van der Goot AJ, Norsker NH, et al.Effects of shear stress on the microalgae Chaetoceros muelleri. Bioproc Biosyst Eng, 2010, 33(8): 921−927.
[18] Renaud SM, Thinh LV, Lambrinidis G, et al. Effect of temperature on growth, chemical composition and fatty acid composition of tropical Australian microalgae grown in batch cultures. Aquaculture, 2002, 211(1/4): 195−214.
[19] Knothe G. ‘‘Designer” biodiesel: optimizing fatty ester composition to improve fuel properties. Energ Fuel, 2008,22(2): 1358−1364.
Effect of inorganic carbon source on lipid production with autotrophic Chlorella vulgaris
Hongli Zheng1, Zhen Gao2, Qi Zhang1, He Huang1,3, Xiaojun Ji1, Honglei Sun4, and Chang Dou1
1 College of Biotechnology and Pharmaceutical Engineering, Nanjing University of Technology, Nanjing 210009, China
2 College of Food Science and Light Industry, Nanjing University of Technology, Nanjing 210009, China
3 State Key Laboratory of Materials-Oriented Chemical Engineering, Nanjing 210009, China
4 Petroleum Research Institute, China National Petroleum Corporation, Beijing 100029, China
Received: September 6, 2010; Accepted: February 21, 2011
Supported by: National Natural Science Foundation of China (No. 20936002), National Basic Rsearch Program of China (973 Program) (Nos.2007CB707805, 2009CB724700, 2011CB200906), the Fifth of Six Projects Sponsoring Talent Summits of Jiangsu Province, College Industrialization Project of Jiangsu Province, Program for Century Excellent Talents in University from the Ministry of Education of China (No. NCET-09-0157), Fok Ying Tung Education Foundation, Ministry of Education of China (No. 123014).
Corresponding author: Zhen Gao. Tel/Fax: +86-25-83172094; E-mail: gaozhen@njut.edu.cn
国家自然科学基金 (No. 20936002),国家重点基础研究发展计划 (973计划) (Nos. 2007CB707805, 2009CB724700, 2011CB200906),江苏省六大人才高峰项目,江苏省高校科研成果产业化推进项目,教育部新世纪优秀人才支持计划 (No. NCET-09-0157),教育部霍英东教育基金资助(No. 123014) 资助。
