氧化钛催化羟基磷灰石分解制备可降解磷酸钙陶瓷
2011-09-29仇文敏胡晓娜王倩倩杨帮成
仇文敏 胡晓娜 王倩倩 李 伟 杨帮成*,,
(1四川大学国家生物医学材料工程技术研究中心,成都 610064)(2四川大学口腔疾病研究国家重点实验室,成都 610064)
氧化钛催化羟基磷灰石分解制备可降解磷酸钙陶瓷
仇文敏1胡晓娜1王倩倩1李 伟2杨帮成*,1,2
(1四川大学国家生物医学材料工程技术研究中心,成都 610064)(2四川大学口腔疾病研究国家重点实验室,成都 610064)
本文将纳米锐钛矿型氧化钛(TiO2)作为催化剂添加到羟基磷灰石(HA)中,经烧结制成可降解的磷酸钙陶瓷,采用X射线衍射(XRD),扫描电镜(SEM),体外模拟实验等手段对不同制作工艺的陶瓷进行表征,考察TiO2的添加量和保温时间对磷酸钙陶瓷性能的影响。实验表明,在较低的温度下,TiO2可以降低HA的高温稳定性,使HA分解成磷酸四钙(TTCP)和磷酸三钙(TCP)。由于TCP具有良好的降解性,TiO2的加入极大的提高了HA的降解速率,且随着TiO2添加量的增加降解速率逐渐增大,保温时间越长,降解速率愈小;浸泡SBF结果显示,TiO2的加入可以提高陶瓷沉积活性磷灰石层的能力,但沉积能力与TiO2添加比例不成正比,添加7wt%的材料沉积最快;细胞实验表明,TiO2的加入不影响HA促进细胞增殖分化的能力。使用氧化钛催化分解HA,可能是制备具有良好生物学性能的可降解磷酸钙陶瓷的有效手段。
氧化钛;羟基磷灰石;催化;降解
羟基磷灰石(HA)是自然骨和牙齿的主要组成成分之一,人工合成的羟基磷灰石陶瓷具有与自然骨相似的结构、形态和成分,表现出良好的生物相容性,是一种优良的骨修复材料[1-5]。但是,纯HA在体液中的溶解度很低,是所有磷酸钙盐在体液中溶解度最小的,这导致纯HA在体内很难被降解和吸收[6]。理想的骨修复材料应该是在体内可以降解,并且随着骨组织的修复,逐渐被吸收和取代,最终成为自然骨组织的一部分[7-8]。低降解性能成为制约HA进一步在临床中应用的瓶颈。
通过调整磷酸钙陶瓷的组分,改变其降解性能是提高其生物学性能的有效手段。例如,把降解性能好的材料和降解性能差但是生物相容性好的HA复合,制备同时具有可降解性和生物相容性的材料[9-11]。
有文献报道,将二氧化钛(TiO2)粉末加入到HA粉末中,可以显著的提高HA陶瓷的生物活性[12];同时,有研究发现TiO2/HA复合材料在加热至960℃以上时会发生反应产生易降解的磷酸三钙 (TCP)和钛酸钙(CaTiO3)[13]。这表明,TiO2的引入不但可以提高HA的生物活性还可以提高其降解性能。因此,TiO2/HA复合材料引起了很多研究者的兴趣。TiO2的含量、合成方法和烧结工艺都将影响复合材料的相组分和微结构,进而影响其降解性能。本文着重研究材料制备工艺中TiO2的含量和保温时间这两个关键因素,并且探讨TiO2和HA的反应机理。
1 实验部分
1.1 材料的制备
HA粉末由四川大学国家生物材料中心提供,纳米锐钛矿型TiO2粉末购于浙江弘晟公司。不同TiO2添加比例(5wt%、7wt%、9wt%)的 TiO2/HA 混合粉末用机械搅拌法混合均匀,取均匀混合的TiO2/HA粉末0.5 g置于模具中,在4 MPa的压力下成型,脱模后呈圆片状(直径13 mm)。成型后的材料在马弗炉中程序控温升至1 100℃保温不同的时间(1 h和4 h),随炉冷却后得不同组分的磷酸钙陶瓷。根据不同的TiO2添加量和保温时间对材料依次命名为 HA-1 h,5%-1 h,7%-1 h,9%-1 h,HA-4 h,5%-4 h,7%-4 h,9%-4 h。表1给出了相关材料样品制备参数。
制得的陶瓷用X射线衍射分析仪(XRD,Y-2000,China)分析相组分,采用 MDI Jade5.0.0.37 分析软件对XRD数据进行分析并定量计算各相百分含量。用扫描电子显微镜(SEM,HITACHI-S4800,Japan)表征表面形貌。

表1 所制备的材料样品参数Table 1 Preparation parameters of specimens
1.2 快速冷却实验
为考察材料烧结中的反应过程,将成型后的材料置入马弗炉中,按5℃·min-1的速度升至1 000℃,然后直接取出,使其在大气中迅速冷却,冷却后的试样用X射线衍射分析仪分析相组分。
1.3 体外降解实验
将1100℃烧结的样品按一定的固液比 (样品质量∶溶液体积=1 g∶100 mL)浸泡在磷酸盐缓冲溶液(PBS,pH=7.4)中,放在37℃恒温箱中分别保持4、10、24、72和120 h,然后把样品取出,将剩下的溶液稀释一倍后用等离子耦合激光光谱(ICPS-7500,Shimadzu,Kyoto,Japan)检测 Ca2+离子的含量。
1.4 体外生物活性检测
用模拟体液浸泡测试材料的生物活性。SBF的配制按Kokubo介绍的方法进行[14]。 将1100℃烧结的试样浸泡于37℃的SBF溶液中,每2 d换一次液。使试样表面积与浸泡液体积之比为0.1 cm-1[14]。浸泡6 d后取出 (在去离子水中轻轻清洗,然后烘干),再使用扫描电镜观察其表面形貌。
1.5 细胞实验
将辐照灭菌后的1 100℃烧结的试样放入24孔板中,加入1 mL MG-63细胞的悬液(1×104mL-1),在5%CO2、饱和湿度、37℃恒温箱内分别培养2、4和6 d,培养基每2 d换1次。本实验中,采用纯羟基磷灰石生物陶瓷作为对照材料。
试样和细胞共培养2、4、6 d后,加入MTT溶液继续孵育4 h,弃上清,加入DMSO,振荡,490 nm酶联免疫检测仪测定吸光度值[15]。
培养至4 d的材料用FDA染色,然后用激光共聚焦显微镜观察(Leica.SP5,Germany)。
培养至4 d的材料用戊二醛水溶液 (体积分数2.5vol%)在4℃固定24 h,再依次用乙醇梯度水溶液和醋酸异戊酯的梯度乙醇溶液脱水和脱醇,其体积分数梯度依次为50vol%,70vol%,90vol%,100vol%(100vol%洗脱2次),每次10 min于临界点干燥后喷金,在扫描电镜下观察[16]。
2 结果与讨论
2.1 材料的相表征
图1a、b为不同添加比例的样品加热至1 100℃分别保温1 h(a)和4 h(b)的XRD衍射图。

图1 不同TiO2添加比例的样品烧结到1100℃保温1 h(a)和 4 h(b)后的 XRD 图Fig.1 XRD patterns of HA/TiO2composite ceramics with different nanocrystalline TiO2and sintered at 1100℃for 1 h(a)and 4 h(b)
由图可见,没有添加TiO2的纯HA材料经过1100℃的烧结后,除了HA的特征峰之外没有其他的杂峰出现,说明烧结过程中HA并没有发生分解。但是,添加了TiO2的材料烧结后,出现了一些新相的衍射峰,如TCP,CaTiO3。从图1(a)中可以看出,5%-1 h,7%-1 h和9%-1 h的衍射图中都产生了α-TCP、β-TCP和CaTiO3这3种物质的特征峰,而没有TiO2的特征峰出现,并且随着TiO2的添加量从5wt%增加到9wt%,新产生的这3种相的特征峰强度逐渐增加,而HA的特征峰强度减小,9%-1 h的样品中HA的衍射峰已完全消失。由图1(b)可见,经过4 h的保温,5%-4 h,7%-4 h和9%-4 h的衍射图谱中产生了β-TCP和CaTiO3这2种物质的特征峰,也没有TiO2的特征峰出现,和保温1 h所表现出来的规律一样,随着TiO2的添加量从5wt%增加到9wt%,新产生2种相:β-TCP和CaTiO3的特征峰强度逐渐增加,而HA的特征峰强度减小,9%-4 h的样品中HA的衍射峰已完全消失,不同的是保温4 h的样品中没有α-TCP的特征峰出现。
表2给出了材料烧结后各相的百分含量。
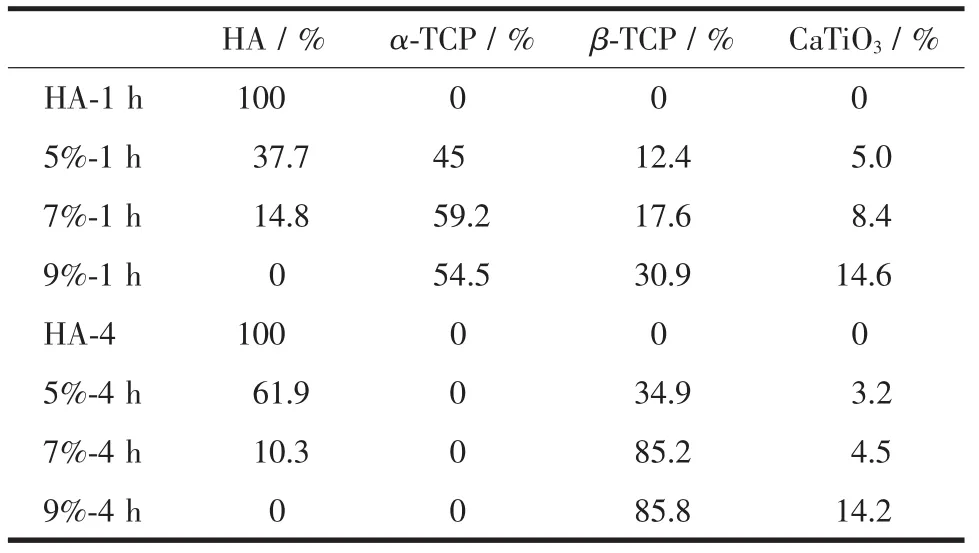
表2 烧结后陶瓷材料各相百分含量分析表Table 2 Phase contents of the ceramics after sintered
2.2 快速冷却实验
图2给出了5%,7%和9%升温到1 000℃经快速降温后的XRD图。

图2 材料升温到1000℃经快速降温后的XRD图Fig.2 XRD patterns of the HA/TiO2composite sintered to 1000℃and cooled down rapidly
由图可见,快速冷却后,除了HA峰之外试样的衍射图中出现了磷酸四钙(TTCP,Ca4P2O9)、α-TCP和金红石型TiO2的特征峰。根据前面的结果(2.1)经过1100℃的烧结样品中TiO2消失HA逐渐减少,随之产生TCP和CaTiO3,因此有文献推测烧结过程中的反应为HA和TiO2发生反应产生 β-TCP和CaTiO3[17]反应式如下:

但是,根据我们的实验结果,快速降温后的样品中有TTCP产生,而正常烧结的前后都没有发现此物质,可知TTCP是烧结过程中所发生反应的中间产物,而且产生的TCP为α相,因此反应式(1)并不能准确的表达该反应过程。
有文献报道[18-19],HA在加热分解的过程中会发生下面的反应:

即HA加热至高温时发生分解,产物为α-TCP和TTCP。一般情况下此反应在1 360℃以上才会发生[16]。根据本文快速降温后的产物来看,该反应在1 000℃已经发生了,同时快速降温后TiO2没有消失,因此我们认为TiO2以其较高的反应活性降低了HA的高温稳定性,充当了反应(2)的催化剂。有报道称SiO2也具有类似的性质,可以催化HA在较低的温度下分解[20]。
HA分解成α-TCP和TTCP后,由于TTCP化学性质不稳定,与TiO2发生了反应产生TCP和CaTiO3,反应如下:
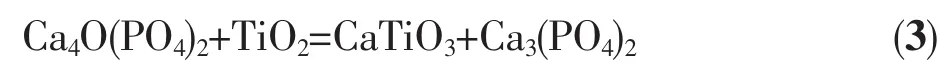
2.3 体外降解实验
图3(a)(b)分别为在1100℃保温1 h(a)和4 h(b)的试样浸泡PBS缓冲溶液后溶出的Ca2+浓度曲线。

从图3(a)(b)中可以看出,HA-1 h和HA-4 h材料浸泡PBS缓冲溶液120 h后Ca2+的溶出仅为0.41 mg·L-1和 0.395 mg·L-1, 这反映了纯 HA 陶瓷的低降解性能。对于保温1 h的样品如图3(a),添加了TiO2的试样浸泡PBS后的Ca2+溶出开始时随着时间的延长而逐渐增加,到24 h时达到最大值,之后缓慢降低并趋于平衡。这符合磷酸钙陶瓷材料在缓冲溶液中浸泡后Ca2+溶出的一般规律,开始时Ca2+溶出的速率较大,Ca2+浓度逐渐增加直至达到饱和甚至过饱和,高离子浓度导致溶液处于亚稳态,在此状态下Ca2+溶出的速率可能小于再沉积速率,表现为Ca2+浓度的缓慢下降,最后二者的速率趋于一致,Ca2+的浓度达到平衡[10]。相同浸泡时间下,添加了TiO2的材料溶出的Ca2+浓度要远高于纯的HA材料,且随着TiO2含量的增加溶出的Ca2+浓度逐渐升高,特别是9%-1 h浸泡24 h后Ca2+的浓度为2.21 mg·L-1,是HA-1 h的5倍。其原因是,TiO2催化HA分解产生了α-TCP和β-TCP,这两相的降解性能优异,特别是α-TCP。随着TiO2含量的增加,易降解的TCP相含量增加,降解能力增强,这就形成了图3(a)所示的降解曲线。从图3(b)可以看出,保温4 h各材料的降解曲线与图3(a)所示保温1 h各材料的相似但略有不同,相似的地方是,随着 TiO2含量的增加,5%-4 h,7%-4 h和 9%-4 h的降解速率逐渐增加,而且都高于HA-4 h;不同之处是,5%-4 h,7%-4 h和9%-4 h经过120 h的浸泡都没有达到保温1 h的材料在浸泡24 h后就达到的Ca2+溶出的饱和值,还处于上面所说的第一个阶段,更没有表现出来趋于平衡的趋势,这反映了保温4 h各材料降解能力相比保温1 h各材料较差,9%-4 h经过120 h的浸泡Ca2+的释放为0.95 mg·L-1。这可能是由以下两个原因造成的,其一,根据表2可以看出,经过4 h的保温,材料中的α-TCP全部消失,应该是在保温过程中逐渐转化成了β-TCP相,而β-TCP的降解性能小于α-TCP,这是造成保温4 h材料比保温1 h材料降解性能降低的主要因素;第二,保温时间延长,结晶度高,晶粒变大,晶格缺陷减少,影响降解性能。
2.4 体外生物活性检测
图4给出了各材料在SBF中浸泡6 d后的SEM图。

图4 材料在SBF中浸泡6 d后的SEM图Fig.4 SEM images of the ceramics after soaking in SBF for 6 d
从图中可以看出,在SBF中浸泡6 d后,5%-1 h、7%-1 h和9%-1 h表面都沉积了一层呈鳞片状的小晶体,这是被广泛报道的类骨磷灰石的典型形貌[5,21-22],特别是7%-1 h,其表面已被鳞片状的类骨磷灰石层铺满,且有些地方已经出现类骨磷灰石层的堆积,而HA-1h的表面基本没有发现类骨磷灰石的沉积。5%-4 h、7%-4 h和9%-4 h的表面可以看到一些排列紧凑的针状晶体,这应该是类骨磷灰石沉积的初级形态。
类骨磷灰石的沉积需要材料与SBF之间进行Ca2+和PO43-的交换,从2.3中的分析可知5%-1 h、7%-1 h和9%-1 h具有良好的降解性能,在浸入SBF之后,Ca2+和PO43-被迅速的释放到SBF中,促使SBF中的Ca2+和PO43-达到超饱和状态,为类骨磷灰石的沉积提供了条件,又因为其保温时间较短仅为1 h,结晶性差,晶格缺陷较多,为磷灰石的沉积提供了形核位点。另外,据文献报道,TiO2的引入也可以提高材料在SBF中沉积类骨磷灰石的能力,材料中释放出来的Ca2+与PO43-导致SBF中的Ca2+与PO43-离子达到过饱和,同时CaTiO3中的Ca2+与H3O+交换,可以在表面形成Ti-OH基团,Ti-OH基团也可以为类骨磷灰石的沉积提供形核位点,一旦形核成功,再加上周围环境中饱和的Ca2+和PO43-,类骨磷灰石就会迅速沉积[23-24]。这就是5%-1 h、7%-1 h和9%-1 h比其他几种材料沉积速度快的原因。对于9%-1 h,可能是因为其降解的太快,反而影响类骨磷灰石的沉积,造成了它的沉积速度比7%-4 h稍慢。对于5%-4 h、7%-4 h和9%-4 h,首先经过4 h的保温,结晶度变高,晶格缺陷减少,减少了可供磷灰石形核的活性位点;其次它们的降解性能较差,溶出Ca2+和PO43-的能力低。这些原因使它们沉积磷灰石的能力不如5%-1 h、7%-1 h和9%-1 h,表现为浸泡SBF6d之后仅在表面沉积了针状初级形态的磷灰石。
2.5 细胞实验
2.5.1 MTT 结果
图5为材料与MG-63细胞共培养2、4和6 d后,细胞增殖的结果。

图5 材料与MG-63细胞共培养2、4和6 d后MTT结果Fig.5 OD values of osteoblasts cultured on different ceramics for vary time
从图中可以看出,各材料与细胞共培养后的OD值随时间的推移而增加,其中添加了TiO2的各材料OD值随时间的推移均明显增长。相同TiO2添加量不同保温时间的各材料间均不存在显著差异(P>0.05),说明材料的保温时间对细胞的增值没有产生影响。第2 d,相同保温时间的材料,9%的OD值要大于 HA,但没有显著差异(P>0.05),5%与 7%的 OD 均显著小于 HA 和 9%(P<0.05)。 4 d时,HA良好的生物活性显现出来,表现为OD值较2 d时明显的增加,且大于添加了TiO2的各材料,与5%和7%之间差异显著(P<0.05),与 9%差异不显著。 6 d时,添加了TiO2的各材料与HA的OD值处于同一个水平,差异不显著(P>0.05)。
2.5.2 荧光染色观察结果
图6材料与细胞共培养4 d后荧光染色的图片。

图6 材料与细胞共培养4 d后荧光染色的图片Fig.6 Fluorescence coloration results of osteoblast cultured on ceramics for 4 d
荧光素乙酰乙酸盐(FDA)为一种荧光染料,有很好的脂溶性,很容易穿过细胞膜的双脂层。其本身不发荧光,进入细胞后,细胞中的酯酶将其中的荧光素分解出来,用激光共聚焦显微技术(CLSM)在蓝色光激发下(495 nm)可产生黄绿色荧光。荧光强度可以说明细胞酯酶活力,从而可以反映材料是否有细胞毒性,可将其作为评价生物相容性的标准之一[25]。对于生长在具有细胞毒性材料上的细胞,由于酯酶活力低下,用CLSM对染色结果进行测定时,荧光强度很弱几乎没有,而对于活力大的细胞则表现为经FDA染色后,能发出很强的荧光。
在8种材料上生长的细胞都能发出很强的荧光。说明在这几种材料上生长的细胞的酯酶都具有较高的活力,从而说明细胞都具有较高的活力,显示这些种材料均无明显的细胞毒性。
2.5.3 SEM 观察结果
图7为培养4 d时,材料表面细胞的SEM图。可见,各材料表面的细胞均呈现平铺状态,细胞表面出现许多细丝状的细胞伪足,大量伪足粘附于材料上且细胞间略有相连,细胞在材料上的生长情况良好,繁殖旺盛。

图7 材料与细胞共培养4 d后的SEM照片Fig.7 SEM images of osteoblasts cultured on pure HA and HA/TiO2composite ceramics for 4 d
3 结 论
TiO2的加入降低了HA的高温稳定性,使HA在较低的温度下分解成TTCP和TCP,TTCP化学性质不稳定与TiO2反应生成TCP和CaTiO3。TiO2的添加量与保温时间可以影响烧结后陶瓷各相组分的含量,进而影响陶瓷的降解性能和生物学性能。TiO2含量增加,烧结后易降解的α-TCP和β-TCP相含量增加,降解速率增加;保温时间延长α-TCP逐渐转化为β-TCP,降解速率减小。适量添加TiO2可以增加形成活性磷灰石层的能力;加入过量则降解太快,加入太少则Ca2+溶出慢,都会影响活性磷灰石层的形成速度。引入TiO2的陶瓷促进成骨细胞增值的能力与HA处于同一水平。进一步优化制备条件,将会得到降解速率可控的生物活性陶瓷。因此,有TiO2添加的HA陶瓷将成为一种有前景的骨组织修复材料。
[1]Hench L L.J.Am.Ceram.Soc.,1991,74:1487-1510
[2]Ishizawa H,Ogino M.J.Mater.Sci.,1999,34:5893-5898
[3]Kim D Y,Kim M,Kim H E,et al.Acta.Biomater.,2009,5(6):2196-2205
[4]Montenero A,Gnappi G,Ferrari F,et al.J.Mater.Sci.,2000,35(11):2791-2797
[5]Yu S C,Hariram K P,Kumar R,et al.Biomaterials,2005,26(15):2343-2352
[6]Ducheyne P,Radin S.ASTM,1994,1196:140-148
[7]Dorcmus R H.J.Mater.Sci.,1992,27(3):285-290
[8]Bauer T W,Muschler G F.Clin.Orthop.,2000,371:10-27
[9]Bigi A,Bracci B,Cuisinier F,et al.Biomaterials,2005,26(15):2381-2389
[10]Hahn B D,Park D S,Choi J J,et al.J.Am.Ceram.Soc.,2009,92(4):793-799
[11]Liu D M,Troczynski T,Tseng W J.Biomaterials,2001,22(13):1721-1730
[12]Peltola T,Patsi M,Rahiala H,et al.J.Biomed.Mater.Res.,1998,41(3):504-510
[13]Weng J,Liu X,Zhang X D.J.Mater.Sci.Lett.,1994,14:159-161
[14]Kokubo T,Takadama H.Biomaterials,2006,27(15):2907-2915
[15]Mosmann T.J.Immunol.Methods.,1983,65:55-63
[16]QU Yang(屈阳),LI Zhen-Sheng(李振声),YANG Bang-Cheng(杨帮成),et al.Chem.J.Chinese Universities(Gaodeng Huaxue Xuebao),2007,28(7):1288-1291
[17]Que W X,Khor K A,Xu J L et al.J.Eur.Ceram.Soc.,2008,28(16):3083-3090
[18]Chu C L,Xue X Y,Zhu J C et al.J.Mater.Sci.-Mater.Med.,2004,15(6):665-670
[19]Liao C J,Lin F H,Chen K S,et al.Biomaterials,1999,20(19):1807-1813
[20]JIANG Ping(姜萍).Thesis for the Master′s Degree of Southwest Jiaotong University(西南交通大学硕士论文).2006.
[21]Gu Y W,Khor K A,Pan D et al.Biomaterials,2004,25(16):3177-3185
[22]Li Z S,Qu Y,Zhang X D et al.Acta Biomater.,2009,5(6):2189-2195
[23]Wen H B,de Wijn J R,Cui F Z et al.J.Biomed.Mater.Res.,1998,41(2):227-236
[24]Zheng X B,Huang M H,Ding C X.Biomaterials,2000,21(8):841-849
[25]SHEN Li-Bin(谌丽斌),LIANG Wen-Yan(梁文艳),QU Jiu-Hui(屈久辉),et al.Environ.Chem.(Huanjing Huaxue),2005,24(5):554-557
Degradable Calcium Phosphate Ceramics Prepared by Sintering Hydroxyapatite with TiO2Catalyst
QIU Wen-Min1HU Xiao-Na1WANG Qian-Qian1LI Wei2YANG Bang-Cheng*,1,2
(1National Engineering Research Center for Biomaterials,Sichuan University,Chengdu 610064,China)(2State Key Laboratory of Oral Diseases,Sichuan University,Chengdu 610064,China)
Titania was employed as a catalyst additive for the preparation of biodegradable hydroxyapatite/titania(HA/TiO2)composite ceramics in this work.The ceramics were characterized with X-ray diffraction(XRD),scanning electro-microscopy(SEM),and simulated body fluid(SBF)soaking experiments to investigate the effect of TiO2.The experiment showed that TiO2could decrease the thermal stability of HA and make HA decompose into TCP and TTCP at a low temperature.Due to the good degradable ability of TCP,the biodegradable property of HA was improved significantly by addition of TiO2and the degradation speed increased with the increase of TiO2content.The longer the sintering time,the lower the degradable speed was.The simulated body fluid test showed that the addition of TiO2could improve the apatite formation ability.But the deposition property is not increased in proportion to the TiO2content,while 7wt%TiO2content ceramic exhibited an optimal ratio for inducing apatite nucleation.Cell proliferation results indicated that the biocompatibility of HA were not affected by the addition of TiO2.It might be a potential method to prepare biodegradable calcium phosphate ceramics with excellent bioactivity by using TiO2as catalyst to decompose HA.
titanium dioxide;hydroxyapatite;catalytic;degradable
TQ174.758;R318.08
:A
:1001-4861(2011)03-0497-07
2010-10-08。收修改稿日期:2010-11-05。
国家自然科学基金(No.50672062,30870615,31070848);四川省科技支撑计划(No.2008SZ0104);四川省杰出青年基金(No.09ZQ026-033);口腔疾病研究国家重点实验室开放基金资助项目。
*通讯联系人。 E-mail:yangbchengc@126.com,Tel:028-85416391
猜你喜欢
杂志排行
无机化学学报的其它文章
- Synthesis,Crystal Structure and Cytotoxicity of Palladium(Ⅱ)Complexes with N-(4-methylbenzoyl)-L-valine Dianion and Aromatic Diimine
- Synthesis,Crystal Structure of Uranium-Potassium Heteronuclear Coordination Polymer
- Synthesis,Crystal Structure and Antibacterial Activity of Magnesium(Ⅱ)Complex with N-Benzenesulphonyl-L-phenylalanine and 1,10-Phenanthroline
- 盐湖卤水萃取提锂及其机理研究
- 菱镁矿风化石与叶腊石合成堇青石的结构表征
- 微波水热时间对C/C复合材料结构和抗氧化性能的影响
