3,4-二甲氧基苯乙酸邻菲咯啉锌配合物的合成及与DNA作用
2011-09-29郭航鸣赵国良吴小勇沈金杯
郭航鸣 赵国良 吴小勇 沈金杯
(1金华职业技术学院,金华 321017)(2浙江师范大学化学与生命科学学院,金华 321004)
3,4-二甲氧基苯乙酸邻菲咯啉锌配合物的合成及与DNA作用
郭航鸣*,1赵国良2吴小勇2沈金杯2
(1金华职业技术学院,金华 321017)(2浙江师范大学化学与生命科学学院,金华 321004)
以 3,4-二甲氧基苯乙酸(HDMPA,C10H12O4)为第一配体,邻菲咯啉(phen)为第二配体,Zn(OH)2为金属源合成了配合物[Zn(DMPA)2(phen)]·6H2O,并通过元素分析、红外光谱、摩尔电导对其进行表征及研究,用单晶X-射线衍射方法测定了配合物的晶体结构。 配合物属于单斜晶系,空间群 C2/c,晶胞参数:a=2.04729(4)nm,b=1.00619(2)nm,c=1.81294(4)nm,β=112.9860(10)°,晶胞体积:V=3.43806(12)nm3,晶胞内结构基元数Z=4,式量Mr=744.05。在配合物中,中心金属锌(Ⅱ)离子与2个二甲氧基苯乙酸根离子中的2个氧原子和1个邻菲咯啉中的2个氮原子配位,配位数为4。用溴化乙锭荧光探针法测试了配合物与DNA的作用,结果表明标题配合物具有较强的插入作用。
锌(Ⅱ)配合物;3,4-二甲氧基苯乙酸;晶体结构;DNA
锌是重要的生命元素,锌几乎对人体的每个组织都是至关重要的,锌具有特殊的生理功能,它是生物体中最好的强路易斯酸或电子接受体,体内约95%的锌存在于细胞内,锌与配体的结合是构成调节此微量元素细胞内水平的重要机制;锌也是组成水解金属酶的主要金属离子,具有快速的配体交换作用,锌提供的高度局部化的电荷中心成为很好的攻击基团,特别是在那些受约束的与底物结合得很弱的部位,这些在金属酶的催化作用中有重要意义;锌不存在氧化还原作用,但具有与蛋白质构成稳定复合物的能力[1-2]。近年来,有关锌与核酸的作用、锌配合物与核酸的作用方式和识别机理以及相关的生物活性的研究一直很活跃[3-14],这对于进一步深入了解核酸结构、功能及某些抗肿瘤药物机理、锌及其相关配合物的生物效应和配位化学的发展都有重要的意义。
本文以3,4-二甲氧基苯乙酸,邻菲咯啉和氢氧化锌为原料,合成了锌(Ⅱ)配合物[Zn(DMPA)2(phen)]·6H2O,并测得单晶结构;用溴化乙锭荧光探针法测试了配合物与DNA的作用。
1 实验部分
1.1 试剂与仪器
3,4-二甲氧基苯乙酸,邻菲咯啉,无水乙醇,氢氧化钠,硫酸锌,氯化钠,溴化乙锭(EB),三羟甲基氨基甲烷,均为分析纯试剂且直接使用;氢氧化锌由硫酸锌和氢氧化钠制备。
小牛胸腺DNA(北京华美公司),将其用0.1 mol·L-1的 NaCl溶液配成 200 μg·mL-1(DNA 起始浓度3.72×10-4mol·L-1),经纯度测定 A260/A280=1.8~2.0,置4℃保存,在4 d之内使用;Tris-HCl缓冲溶液的pH为 7.40,其中 cTris为 0.01 mol·L-1。
德国Bruker Smart ApexⅡCCD单晶衍射仪,杭州梵隆仪器有限公司DDS-12型数字电导率仪,德国Elementar公司Vario ELⅢ型元素分析仪,美国Nicolet NEXUS-670红外光谱仪。
1.2 配合物的合成
分别称取 0.20 g(1 mmol)3,4-二甲氧基苯乙酸(HDMPA)和 0.09 g(0.5 mmol) 邻菲咯啉(phen),0.05 g(0.5 mmol)Zn(OH)2置于锥形瓶中,加入20 mL的蒸馏水,在磁力搅拌器上持续加热搅拌反应4 h后,滤去少许不溶物,收集滤液放置。2个月后,滤液中得到无色单晶,产率 75%(以 Zn(OH)2计),IR(KBr,cm-1):3 424,1 603,1 568,1 516,1 429,1 378,856,733。元素分析实验值(%):C,48.99;H,5.63;N,4.13,按 C32H42N2O14Zn 计 算 值 (%):C 49.20,H 5.68,N 4.06,实验值与理论值非常吻合。 25 ℃时,1.0×10-3mol·L-1DMF 溶液的摩尔电导为 1.1 S·cm2·mol-1。故可知其在DMF中为非电解质,说明生成的产物为配合物且为分子型配合物[15]。
1.3 配合物与DNA作用
10 mL 比色管中加入 2.0 mL EB 溶液(100 μg·mL-1),1.0 mL DNA 溶液 (200 μg·mL-1),2.0 mL Tris缓冲溶液 (pH为7.40),放置2 h,加入不同量的配合物溶液(1.0×10-4mol·L-1),稀释至刻度,反应 12 h,以251 nm为激发波长,扫描EB-DNA复合体系在520~700 nm波段的荧光光谱。
1.4 配合物的晶体结构
选用大小为 0.215 mm×0.174 mm×0.134 mm 的配合物单晶,在德国Bruker Smart ApexⅡCCD单晶衍射仪上进行衍射实验。用辐射Mo Kα射线(λ=0.071 073 nm),在设定的角度内(2.16°≤θ≤27.55°)范围内收集衍射点。衍射数据用程序SADABS[16]进行经验吸收校正。晶体结构用SHELXS-97[17]软件由直接法解出,精修采用SHELXL-97[18],所有非氢原子的坐标及各向异性温度因子用全矩阵最小二乘法修正,除水上的氢原子外所有氢原子均为理论加氢,水上的氢原子通过差值Fourier合成得到,并对键长和键角加以限制(d(O-H)=0.085 nm,d(H-H)=0.138 nm),配合物最后的残差因子 R1=0.0381,wR2=0.0918。配合物的主要晶体学参数及主要键长、键角分别列于表1、表2。
CCDC:793918。

表1 配合物的晶体学数据Table 1 Crystal data of the complex
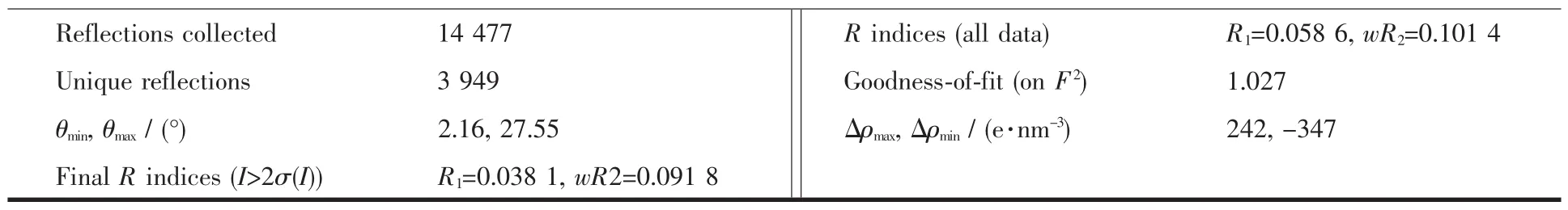
续表1
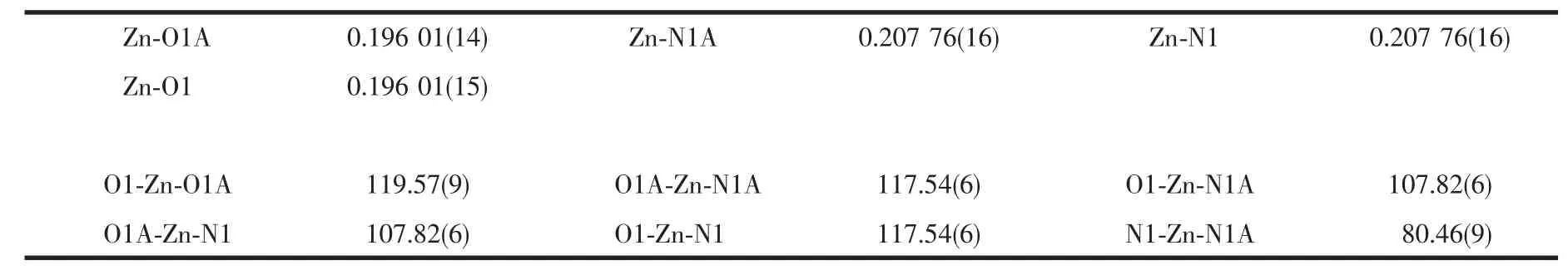
表2配合物的主要键长和键角Table 2 Selected bond distances(nm)and bond angles(°)of the complex
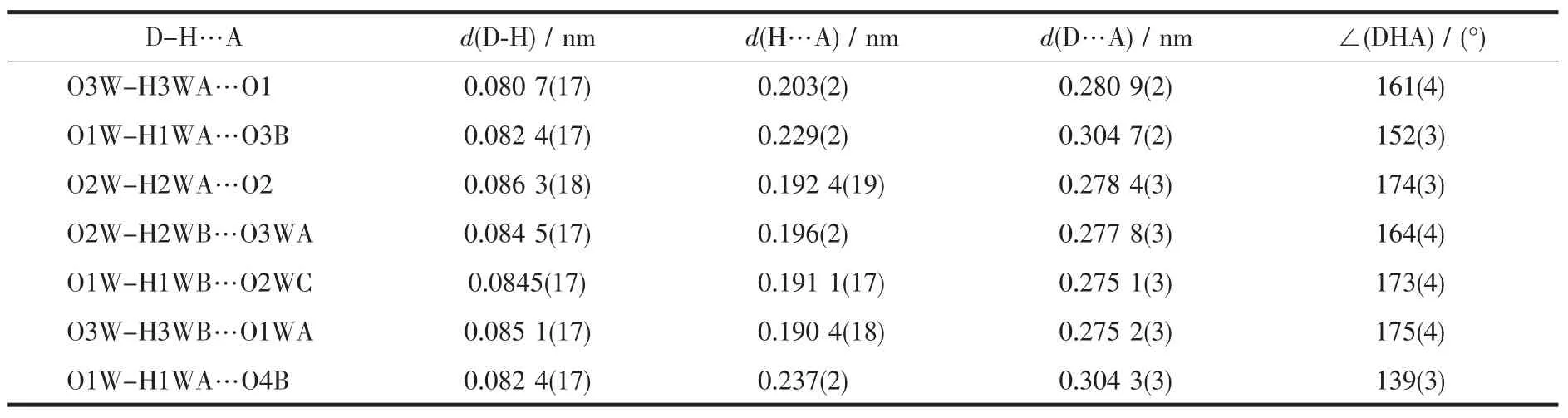
表3 氢键列表Table 3 Hydrogen bonds for complex
2 结果与讨论
2.1 配合物的红外光谱
配合物的红外光谱图中在3424 cm-1处出现的宽的吸收带可归因于分子中水的O-H伸缩振动。自由配体HDMPA于1 718 cm-1处的特征吸收峰νC=O(-COOH)在形成配合物后消失,而出现了羧酸根-COO-式的反对称和对称伸缩振动吸收峰νas(COO-)1603cm-1和 νa(COO-)1378 cm-1,Δν(νas-νs)=225 cm-1,两者的差值大,表明羧基中的氧原子以单齿型式参与了配位[19]。邻菲咯啉在形成三元配合物后,C=N特征伸缩振动峰从1568 cm-1红移至1516 cm-1处,面外变角振动 δC-H从 742 cm-1移至为 733 cm-1,δC-C也从876 cm-1向低波数方向856 cm-1移动,表明邻菲咯啉中的2个氮原子同时参与配位。这也与晶体结构的分析结果一致。
2.2 配合物的晶体结构
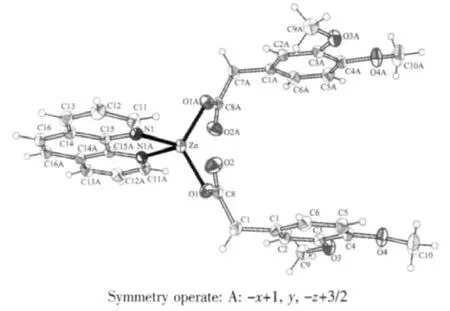
图1 [Zn(DMPA)2(phen)]配合物的分子结构图(椭球率30%)Fig.1 Molecular structure of[Zn(DMPA)2(phen)],ellipsoids are shown at the 30%probability level
配合物的分子结构如图1所示,其分子结构中有一条二重对称轴,最小不对称单元只包含半个分子。整个配合物包括1个Zn(Ⅱ)离子、2个3,4-二甲氧基苯乙酸根离子、1个邻菲咯啉分子以及6个水分子。Zn(Ⅱ)离子为四配位,呈畸变的四面体构型,O1,Zn,O1A 所在的平面与 N1,Zn,N1A 所在平面几乎垂直,夹角为81.599°。邻菲咯啉与Zn(Ⅱ)双齿螯合,d(Zn-N)=0.207 76(16)nm,与文献报道的四配位Zn(Ⅱ)配合物接近[20],螯合角为 80.455°。 2 个 3,4-二甲氧基苯乙酸根与Zn(Ⅱ)离子单齿配位,Zn-O键长分别为0.196 01(14)和0.196 01(15)nm,与类似的四配位的 Zn(Ⅱ)羧酸配合物接近[21],O1A-Zn-O1=119.57(9)°。2个3,4-二甲氧基苯乙酸根的苯环平面几乎平行,夹角为0.166°,邻菲咯啉所在的最小二乘平面与2个3,4-二甲氧基苯乙酸根的苯环所确定的最小二乘平面也近似平行,夹角都为2.020°。
由分子堆积图2可以看出,配合物分子以Y字形整齐排列,沿b轴方向相邻配合物分子之间交错排列,3,4-二甲氧基苯乙酸根苯环平面与邻菲咯啉平面间的六元环平面质心距最短为0.36146(1)nm,存在明显的π-π堆积作用力;沿a方向,相邻配合物分子间通过3,4-二甲氧基苯乙酸根苯环平面间的疏水作用力堆积在一起。
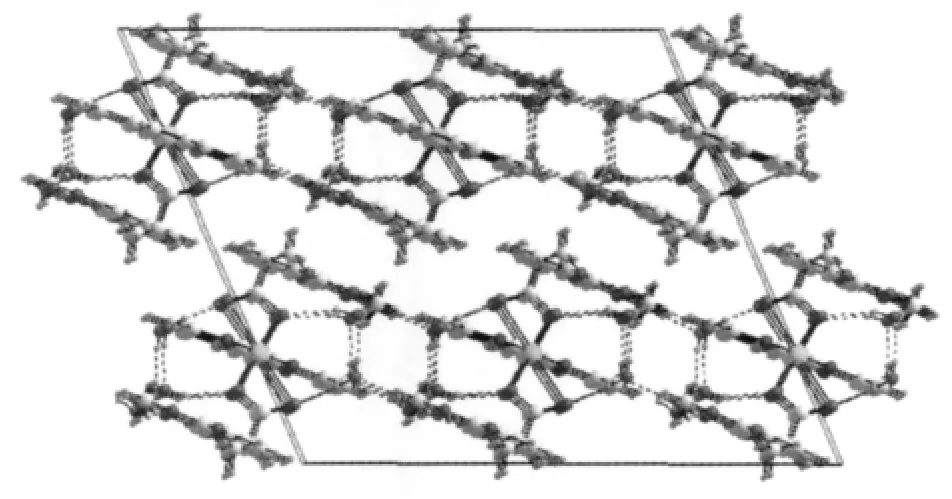
图2 配合物的晶胞堆积图Fig.2 Packing diagram of the complex
有趣的是配合物分子堆积过程中形成了许多一维的螺旋形孔洞,晶格水就存在于这些孔洞中形成了一维的螺旋形氢键链,如图3所示。每个水分子都用自己的一个氢与相邻的水分子首尾相接形成一个氢键,同时以另外一个氢与周围的羧基氧形成氢键。H键、π-π堆积及疏水相互作用是晶体形成及稳定的主要动力。

图3 一维螺旋形氢键链Fig.3 View of the 1D helical chain of hydrogen-bonding
2.3 配合物与DNA作用
以溴化乙锭为荧光探针,测试了配合物对EBDNA复合体系的荧光猝灭曲线。图4为不同浓度的配合物对EB-DNA复合体系的荧光猝灭图。图中配合物与DNA浓度之比从上往下依次增大(浓度比:r1=0;r2=0.13;r3=0.27;r4=0.40;r5=0.54;r6=0.67)。 配合物在592 nm处没有荧光,DNA-EB体系在592 nm处发出强烈的荧光,随着配合物浓度的增加,EBDNA复合体系荧光发生了不同程度的猝灭,由此推测配合物与DNA发生了插入作用。根据Sternvolmer[22]方程:F0/F=1+Ksqr,我们可以计算出这配合物与DNA的结合常数Ksq为8.89,插入作用较强[23],其原因可能是配合物中邻菲咯啉具有较大的刚性芳香环而且它与2个3,4-二甲氧基苯乙酸根离子平面又几乎平行之故。
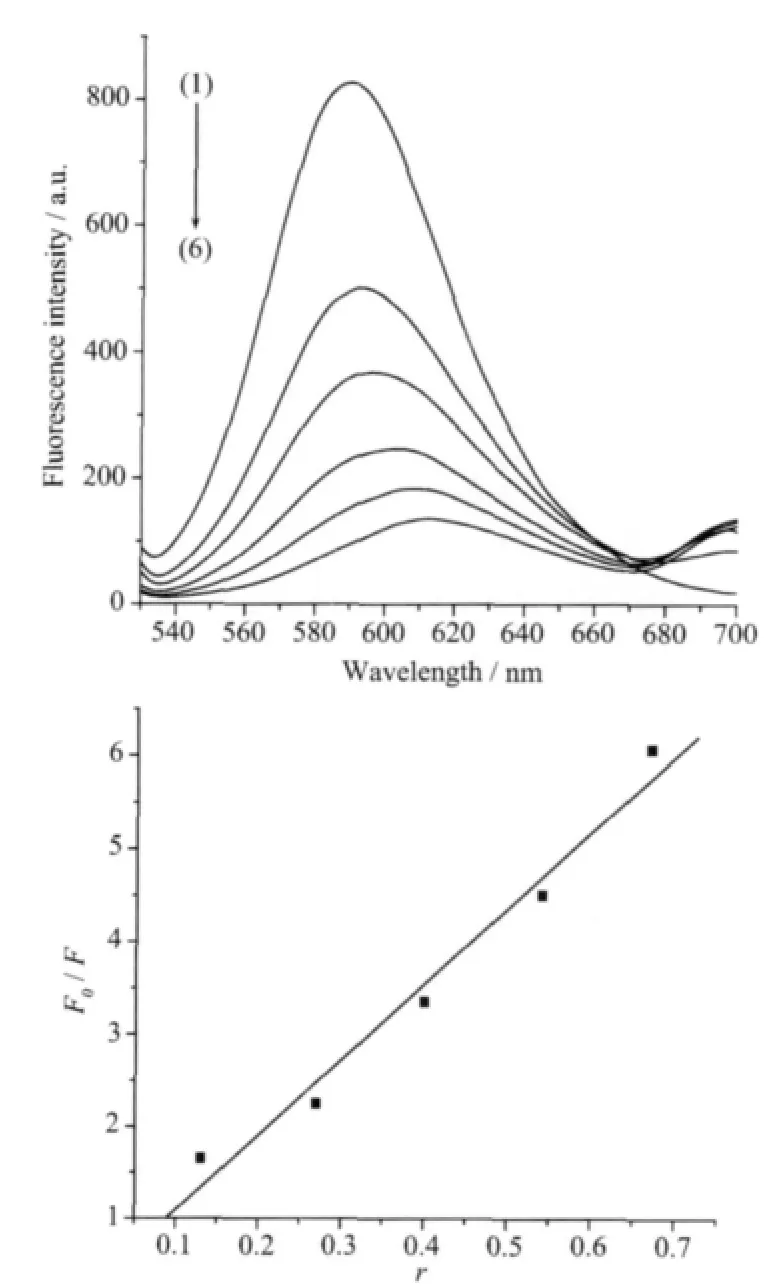
图4 配合物对EB-DNA复合物体系的荧光猝灭图Fig.4 Fluorescence spectra of EB-DNA system in the absence and presence of increasing amount of complex
[1]YANG Ke-Di(杨克敌).Microelement and Health(微量元素与健康).Beijing:Science Press,2003:113-126
[2]Zhen M,Faith E J,David P G.Chem.Rev.,2009,109(10):4644-4681
[3]LUO Qin-Hui(罗勤慧),ZHENG Li-Min(郑丽敏),LU Qin(陆勤),et al.Chinese Science,Series B:Chemistry(Zhongguo Kexue),1992,22(9):897-903
[4]William N L,Norbert S.Chem.Rev.,1996,96(7):2375-2432
[5]Emiko K,Mariko M,Naomi K,et al.J.Am.Chem.Soc.,1999,121(23):5426-5436
[6]SHI Wei-Liang(史卫良),CHEN De-Yu(陈德余),CHEN Shi-Ming(陈士明),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2001,17(2):239-243
[7]Liu C L,Wang M,Zhang T,et al.Coord.Chem.Rev.,2004,248(1/2):147-168
[8]Liu B,Bard A J,Li C Z,et al.J.Phys.Chem.B,2005,109(11):5193-5198
[9]TANG Ding-Xing(唐定兴),FENG Li-Xia(冯丽霞),ZHANG Xiao-Quan(张小全).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22(10):1891-1894
[10]Wang Y,Okabe N.Inorg.Chim.Acta,2005,358(12):3407-3416
[11]Sharma R K,Chopra S,Sharma S D,et al.J.Med.Chem.,2006,49(12):3595-3601
[12]Nicholas E G,David P G.J.Am.Chem.Soc.,2009,131(49):17860-17870
[13]Jennifer G,Erin F,Andrea Y,et al.Biochemistry,2010,49(4):679-686
[14]Hong J,Jiao Y,Yan J B,et al.Inorg.Chim.Acta,2010,363(4):793-798
[15]Geary W J.Coord.Chem.Rev.,1971,7:81-122
[16]Sheldrick G M.SADABS,Program for Empirical Absorption Correction of Area Detector Data,University of Göttingen,Germany,1997.
[17]Sheldrick G M.SHELXS97,Program for Crystal Structure Solution,University of Göttingen,Germany,1997.
[18]Sheldrick G M.SHELXL97,Program for Crystal Structure Refinemenf,University of Göttingen,Germany,1997.
[19]Nakamoto K(中本一雄),Translated by HUANG De-Ru(黄德如),WANG Ren-Qing(汪仁庆).Infrared and Raman Spectra of Inorganic and Coordination Compounds.3rd Ed.(无机和配位化合物的红外和拉曼光谱.3版).Beijing:Chemical Industrial Press,1986:236-238
[20]Poyra M,Sari M,Guney A,et al.J.Coord.Chem.,2008,61(20):3276-3283
[21]Miodragovic D U,Mitic D M,Miodragovic Z M,et al.Inorg.Chim.Acta,2008,361(1):86-94
[22]Lakowicz J R,Weber G.Biochmistry,1973,12(21):4161-4170
[23]Liu J,Zhang T X,Lu T B,et al.J.Inorg.Biochem.,2002,91(3/4):269-276
Synthesis and DNA-Binding of Zinc(Ⅱ)Complex with 3,4-Dimethoxyphenylacetic Acid and 1,10-Phenanthroline
GUO Hang-Ming*,1ZHAO Guo-Liang2WU Xiao-Yong2SHEN Jin-Bei2
(1College of Vocation and Technology,Jinhua,Zhejiang 321017,China)(2College of Chemistry and Life Sciences,Zhejiang Normal University,Jinhua,Zhejiang 321004,China)
A zinc(Ⅱ) complex[Zn(DMPA)2(phen)]·6H2O was synthesized from 3,4-dimethoxyphenylacetic acid(HDMPA=C10H12O4),1,10-phenanthroline(phen)and Zn(OH)2,and characterized by elemental analysis,infrared radiation,molar conductance.Its crystal structure was determined by single crystal X-ray diffraction method.The complex,C32H42N2O14Zn,crystallizes in the monoclinic system,space group C2/c,with cell parameters:a=2.047 29(4)nm,b=1.006 19(2)nm,c=1.812 94(4)nm, β=112.986 0(10)°,cell volume:V=3.438 06(12)nm3,number of molecules inside the cell:Z=4,relative molecular mass:Mr=744.05.The crystal structure shows the zinc(Ⅱ)atom is four-coordinated by two oxygen atoms from two DMPA-anions and two nitrogen atoms of 1,10-phenanthroline molecule.The interaction between complex and DNA was studied by EtBr fluoescent probe,and the results show that the complex interact with DNA by intercalative mode.CCDC:793918.
zinc(Ⅱ)complex;3,4-dimethoxyphenylacetic acid;crystal structure;DNA
O614.24+1
:A
:1001-4861(2011)05-0855-05
2010-10-08。收修改稿日期:2010-11-23。
浙江省自然科学基金资助项目(No.Y4080532)。
*通讯联系人。 E-mail:guohm8282@sina.com
