胶原-壳聚糖复合支架体外三维培养神经干细胞
2011-09-27关水,刘天庆*,葛丹,陆瑞欣,马学虎,崔占峰
关 水, 刘 天 庆*, 葛 丹, 陆 瑞 欣, 马 学 虎, 崔 占 峰
(1.大连理工大学 大连市干细胞与组织工程研发中心,辽宁 大连 116024;2.牛津大学 工程科学系,英国 牛津 DX1 3PJ)
0 引 言
神经干细胞(neural stem cells,NSCs)体外分离培养的成功及神经生物学发育机制的深入研究,为脑损伤后中枢神经系统功能重建、神经再生和神经系统疾病的治疗提供了新的思路和途径,因此在细胞移植、药物筛选、转基因治疗及组织工程等方面有着巨大的应用价值[1~4].但是目前对于NSCs的体外培养主要还是采用传统的二维培养方式:一种是以神经球(neurosphere)在培养器皿中悬浮(suspension)培养,另一种是在经过处理的培养器皿的表面单层贴壁(monolayer)培养[5、6].细胞由于脱离体内真实环境而影响生物学行为,因而直接影响了NSCs的数量和活性.体内细胞都是在三维空间中生长、繁殖、分化并发挥其特定的生物学功能的.体外细胞培养的一个重要原则是要最大程度地模拟体内细胞生长环境.不同于传统的二维培养方式,三维培养(three-dimensional culture)是将细胞种植在一定的细胞外基质(extracellular matrix,ECM)中,ECM蛋白充当生长支架,为细胞提供三维的结构支承,使细胞间形成适宜的空间分布和细胞连接,而且为细胞提供特异性的生长和分化信号,形成与体内组织相似的细胞生长微环境,从而引导组织形成[7、8].
三维培养是组织工程中最典型的培养方式,在细胞扩增、组织构建等方面具有重要作用.近几年来,采用具有三维结构的支架材料进行NSCs的培养已取得了成功[9~11].2000年,O′connor等将NSCs接种到Ⅰ型胶原凝胶中实现三维培养,发现NSCs能够在胶原凝胶中增殖并分化为神经元和胶质细胞[10];2004年,Ma等进一步研究证明,在三维胶原凝胶中,NSCs可以分化为有功能的神经环路,产生的神经元具有神经元极性、神经递质、离子通道感受器及兴奋性的功能[11].目前国内外对于NSCs三维培养的研究仍处于初级阶段,且大多采用胶原作为支架材料,但是纯胶原延展性较低,易干裂,抗水性差,遇水易溶胀降解,因此需要通过一定的改性提高胶原的拉伸强度及抗降解能力,从而改善胶原的力学性能与抗水性,以更适合NSCs生长的微环境.壳聚糖作为一种天然多糖衍生物,具有优良的生物亲合性,其分子链上丰富的羟基和氨基,可发生多种化学反应[12].壳聚糖与胶原结合能够形成大分子聚电解质复合材料,可以提高胶原的力学强度,并且可以延迟胶原的降解时间.因此本文针对胶原支架本身存在的不足,采用冷冻干燥法制备胶原-壳聚糖复合支架,建立体外NSCs的三维培养,同时考察NSCs与胶原-壳聚糖复合支架的生物相容性.
1 实验材料与方法
1.1 材 料
1.1.1 试剂 实验所用试剂如下:鼠尾Ⅰ型胶原(CultrexTM,Trevigen Inc.);壳聚糖(上海伯奥生物科技有限公司);DMEM 培养液 (Gibco);RPMI-1640培养液(Sigma);F12(Gibco);胎牛血清(华美生物工程公司);D-葡萄糖 (Gibco);胰蛋 白 酶 (Gibco);N2 添 加 剂 (Gibco);EGF(Gibco);bFGF (Gibco);HEPES(Roche);GlutaMax-1(Gibco);Heparin(Gibco);Lipid(Gibco);B27(Gibco);BSA(Gibco);AccutaseTM酶 (Sigma);Live/Dead Viability-Cytotoxicity Kit(Invitery,USA).其他所有常规试剂均为分析纯.
1.1.2 仪器 实验所用仪器如下:超净工作台(CA-920-3,上海净化设备厂);血球计数板(XB-K-25,上海求精生化试剂仪器有限公司);离心机(Z323,Hermle,Germany);CO2培养箱(HERA cell,Kendro Laboratory Products,Germany);超纯水机(Millipore-Q-Synthesis,France);水浴振荡器(SHA-C,江苏安普电子工程有限公司);高压 灭 菌 器 (SS-325,Tomy Kogyo Co.Ltd.,Japan);冷冻干燥机(Labconco,USA);扫描电子显微镜(S2520,Hitachi,Japan);荧光倒置显微镜(IX70-131,Olympus Optical Co.Ltd.,Japan);FV1000激光共聚焦扫描显微镜(Olympus Optical Co.Ltd.,Japan).
1.1.3 细胞 实验取孕14d的昆明小鼠(购自大连医科大学),按照实验室以前文献报道的方法[13、14]获取神经干细胞、进行原代及传代培养.培养基由 DMEM/F12(1∶1)和 RPMI-1640按比例混合作为基础培养基,添加生长因子及其他成分构成(其中 EGF,20ng·mL-1;bFGF,10 ng·mL-1;Heparin,4mg· mL-1;HEPES,5 mmol/L;D-葡萄糖,9.151g·L-1;GlutaMax-1,4.5mmol/L;BSA,2mg·mL-1;加适量NaHCO3调节pH至7.2).本实验采用第三代细胞.
1.2 方 法
1.2.1 支架制备、交联及修饰
(1)制备
称取一定质量的壳聚糖粉末,完全溶解于2%的乙酸,配制成20mg/mL壳聚糖溶液,离心除渣脱泡待用;胶原(CultrexTM,溶解于20 mmol/L乙酸中)储存于2~8℃待用,储备液的浓度为5mg/mL.分别将胶原与壳聚糖溶液按体积比9∶1、7∶3、5∶5充分混匀,离心除泡后加入预冷的96孔板中(每孔100μL),置于-84℃超低温冰箱内预冻2h后迅速转移至低温冷冻干燥机中12h,再浸入0.1mol/L Na2HPO4(pH 7.4)中数小时以中和残留的乙酸,然后用蒸馏水反复冲洗至中性,再冷冻干燥8h,即得壳聚糖-胶原复合支架.
(2)交联
将冻干后的支架小心取出,转移至24孔板内,加入2mL含50mmol/L 2-吗啉乙烷磺酸、50 mmol/L碳化二亚胺及50mmol/L N-羟基琥珀酰亚胺的体积分数为0.4的乙醇交联剂中室温交联6h,移去交联剂,加入0.1mol/L Na2HPO4(pH 7.4)室温孵育2h,再用体积分数为0.4的乙醇清洗4次,30min/次,双蒸水反复洗至中性,最后将24孔板置于超低温冰箱内预冻2h,再次冷冻干燥,即得交联后的支架.
(3)修饰
将经环氧乙烷灭菌过的交联的胶原-壳聚糖复合支架置于24孔板内,将100μL(10μg/mL)的层粘连蛋白(LN)小心悬滴于支架中,并将孔板置于37℃、饱和湿度、5%CO2培养箱中过夜,无菌干燥后保存备用.
1.2.2 支架孔径、孔隙率、吸水率及降解率测 定
(1)孔径(aperture)
取以上制备的不同比例的复合支架,真空喷金导电处理后黏贴在金属模块上,在扫描电子显微镜下观察支架材料内部的微观结构.选择合适的放大倍数拍摄扫描照片,并在材料内部选取3个视野,每个视野测量10个孔径值,计算支架的平均孔径.
(2)孔隙率(porosity)[15]
测量支架的质量,记为m0,体积记为V0,将支架浸入无水乙醇(密度为ρ0)中24h,使乙醇溶液充分进入到支架材料中,然后小心地将支架取出,表面擦干,称其质量,记为m,则支架内孔的体积Vp=(m-m0)/ρ0,每个样本测3 次,取平均值.支架孔隙率ε(%)按下式计算:
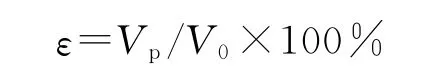
(3)吸水率(water absorption)
测量支架的质量,记为m0,浸泡到三蒸水中24h后再次称重,记为m1,每个样本测3次,取平均值.支架吸水率A(%)按下式计算:
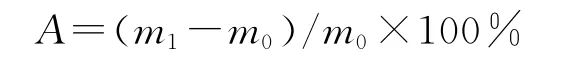
(4)降解率(degradation rate)
取12支20mL试管分成4组,每组3支,分别加入制备好的不同比例的干燥复合支架(质量记为m0),再加入10mL含溶菌酶1×105U 的0.1mol/L磷酸缓冲液(pH 7.4),置于37℃水浴中振荡消化.分别于1、2、3、4、5和6周取出各组样本,蒸馏水洗后冷冻干燥,称重,记为mt.支架降解率D(%)按下式计算:
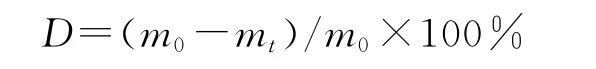
1.2.3 支架内细胞接种率的测定及分布观察根据孔隙率选取体积比为7∶3的胶原-壳聚糖复合支架,将NSCs小心接种在支架上,细胞接种的初始浓度为5×106个/mL,体积为20μL;未经LN处理的支架作为对照组.接种率(%)按下式计算:

培养4d后,加入10μg/mL Hoechst33342,置于37℃、饱和湿度、5%CO2培养箱中孵育10 min,然后加入预冷的4%多聚甲醛磷酸缓冲液固定细胞(与培养液按1∶3混合),10min后取出支架,用PBS荡洗3次,用刀片切成薄片(平均厚度50~100μm),于荧光显微镜下观察.
1.2.4 细胞死活检测 细胞以5×106个/mL的初始浓度分别接种于不同体积比的胶原-壳聚糖复合支架中,体积为20μL,置于24孔板内在37℃、饱和湿度、5%CO2培养箱中培养.采用Live/Dead Viability-Cytotoxicity Kit检测细胞在支架内的存活.Live/Dead Viability-Cytotoxicity Kit含有测量细胞活力的两种荧光探针.活细胞能够与钙黄绿素(calcein AM,4mmol/L)结合,在激发光的作用下发出强烈的绿色荧光;而死细胞由于细胞膜的破损,细胞内的核酸能够与乙啡啶同型二聚体(EthD-1,2mmol/L)结合,在激发光的作用下产生强烈的红色荧光.具体操作方法按照说明书进行,采用激光共聚焦扫描显微镜进行观察.
1.2.5 统计学分析 各组实验分别重复3次,所得数据以“平均数±标准误差”表示,学生t检验进行显著性分析,以P<0.05认为有显著性差异.
2 结果与讨论
2.1 胶原-壳聚糖复合支架的微观结构
本研究通过冷冻干燥法制备的胶原-壳聚糖复合支架为白色、不透明、表面粗糙,具有一定弹性的规则圆柱体(底面直径约为6mm,高约为3 mm),有的呈纤维状排列并有大小不等的隆起,用手触摸感觉有弹性.图1所示为胶原-壳聚糖复合支架(7∶3)在扫描电镜下的超微结构,可以非常清楚地看到支架上较大范围内的孔结构,孔与孔之间相互连通形成孔道.但从图1(a)中也可以看到,支架多孔结构的某些区域仍然不是很均匀,这可能是由于在胶原和壳聚糖溶液混合过程中搅拌不匀产生了气泡,经预冻后形成了较大的结冰区,导致支架在冻干时局部冰晶直接升华,从而产生了所谓的“无孔区”.

图1 胶原-壳聚糖复合支架的微观结构Fig.1 The microstructure of collagen-chitosan composite scaffolds
2.2 胶原-壳聚糖复合支架的性能特征
支架的孔隙形态,包括孔隙率、孔径大小和孔径分布等对细胞增殖速度、支架降解动力学特性和组织的力学特性等有着重要的影响.因此,组织工程中使用的支架不仅要求其材料具有生物相容性、生物可降解性,还要求具有高孔隙率、高比表面积、孔隙内部连通性好等特性,以便于组织液扩散和组织的形成.本实验所制备的不同体积比的胶原-壳聚糖复合支架的孔径、孔隙率、吸水率、降解率等参数如表1及图2所示.
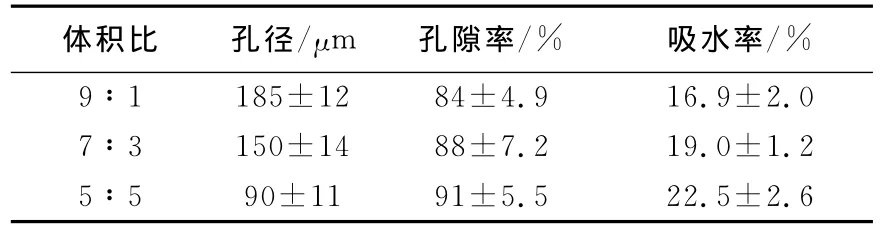
表1 胶原-壳聚糖复合支架的孔径、孔隙率、吸水率Tab.1 The aperture,porosity and water absorption of collagen-chitosan composite scaffolds

图2 胶原-壳聚糖复合支架的体外降解率Fig.2 The degradation rate of collagen-chitosan composite scaffolds in vitro
由表1可以得出,随着壳聚糖比例的增加,复合支架的孔径逐渐减小,吸水率逐渐增大,而孔隙率没有明显的变化.这些结果说明通过冷冻干燥法制备的不同比例的胶原-壳聚糖复合支架,都具有较高的孔隙率(90%左右),具备孔与孔之间的连通,但是连通孔径之间存在一定的差别.胶原比例太大,使得复合支架更加致密,孔壁变厚,孔径变大,孔的数量减少,且分布不均.而且随着胶原蛋白含量的增加,吸水率逐渐降低,导致降解速度加快.
胶原在体内由胶原酶迅速降解,而壳聚糖则主要由体液中的溶菌酶降解.这两种酶在体内的含量不同,当溶菌酶分解了包裹在胶原纤维外的壳聚糖后,胶原酶才能对胶原纤维进行降解[16],因此实验中仅采用溶菌酶考察胶原-壳聚糖复合支架的降解速率.由图2可见,随着时间的延长,不同体积比的胶原-壳聚糖复合支架的降解率同趋势增加,且随着壳聚糖比例的增加,支架的降解率呈依赖性提高,即5∶5支架的降解率明显高于7∶3和9∶1实验组的.需要指出的是,生物材料的体内降解受多种酶的联合作用,不完全同于体外降解情况,所以胶原-壳聚糖在溶菌酶中的模拟降解只能宏观上评价不同体积比支架的体外降解趋势的快慢.
以上结果表明,体积比为5∶5、7∶3、9∶1的胶原-壳聚糖复合支架的孔径、孔隙率、吸水率、降解率等实验参数都符合体外细胞培养的要求.考虑到孔径及其均匀性的差别,在以后的实验中,主要采用体积比为7∶3的胶原-壳聚糖复合支架来进行NSCs的三维培养.
2.3 胶原-壳聚糖复合支架与NSCs的生物相容性
要实现NSCs在支架材料内的三维培养,首先要求细胞很好地接种在支架材料上.细胞与支架材料的黏附是组织工程研究细胞与材料间相互作用的基础.影响黏附的因素主要有生物学和材料学两个方面.就材料学方面来说,材料表面的亲疏水性、表面自由能、荷电特性等对材料的黏附性都存在较大的影响.细胞和胶原-壳聚糖支架的结合在很大程度上依靠糖蛋白的连接.层粘连蛋白(LN)能够为细胞在支架上的黏附提供良好的基质膜环境,提高细胞与支架的黏附率.NSCs能够连结LN的第11位氨基酸,再由LN短臂上的球形结构与Ⅰ型胶原结合,从而使细胞与支架黏附得更牢固.
因此本文首先考察了NSCs在经过LN修饰的胶原-壳聚糖支架(7∶3)内的接种率.由表2可以看出:最初接种的细胞密度较高,但补加新鲜培养基之后,有一部分细胞重新从支架上脱离,悬浮于培养基中.在孵育12h后,置换培养器皿时计数得到30%~40%的细胞因为黏附不牢而脱落.所以,要保证支架内的细胞总数,开始的接种密度一定不能太低(一般高于1×106个/mL).对比2个实验组可以看出,LN处理能够明显提高NSCs的接种率.

表2 NSCs在胶原-壳聚糖支架(7∶3)内的接种率Tab.2 The inoculation rate of NSCs in collagen-chitosan(7∶3)scaffolds
通过Hoechst荧光染色,本文进一步考察了NSCs在经过LN修饰的胶原-壳聚糖复合支架(7∶3)中的生长和分布情况.如图3所示,在经LN修饰的支架上,细胞黏附的数量明显多于未经过修饰的.因此,经过LN修饰后的支架材料大大改善了细胞在支架上的黏附能力,显著提高了胶原-壳聚糖支架材料的生物相容性及对细胞的亲合力,对细胞的黏附行为产生了不可忽视的影响.
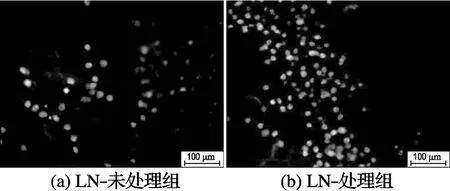
图3 胶原-壳聚糖(7∶3)支架中NSCs的Hoechst荧光染色观察Fig.3 Hoechst fluorescence staining of NSCs in collagen-chitosan(7∶3)scaffolds
激光共聚焦扫描显微镜(laser scanning confocal microscope,LSCM)是20世纪80年代发展起来的一种高精度分子细胞生物学分析仪器,辅以各类免疫荧光探针或荧光染料与被测物质特异性结合,不仅可观察固定的细胞组织切片,还可以对活细胞的结构、分子、离子进行实时动态观察和检测.因此通过Live/Dead Viability-Cytotoxicity Kit染色,应用LSCM技术,实时检测了NSCs在经过LN修饰的胶原-壳聚糖(7∶3)支架内细胞的死活情况.如图4所示,培养6d后,活细胞的比例(图4(a),69.2%)明显大于死细胞的(图4(b),30.8%).但由图4(c)可以看出,单位细胞数量多的区域死细胞的数量也相应增加(如图中方框所示,即图4(a)与图4(b)叠加后区域),这可能是由于在一定空间内的细胞数量过多,造成营养物质缺乏而导致细胞凋亡.图4(d)为 NSCs在Z轴(1.50mm×1.50mm×0.24 mm)上叠加的三维成像照片,表明支架内的NSCs培养至第6d时状态良好,细胞仍然保持着旺盛的增殖能力.

图4 NSCs在经过LN修饰的胶原-壳聚糖(7∶3)支架内 Live/Dead Viability-Cytotoxicity Kit染色Fig.4 Staining of NSCs in LN-treated collagen-chitosan(7∶3)scaffolds by using the Live/Dead Viability-Cytotoxicity Kit
图5为NSCs在经过LN修饰的胶原-壳聚糖(7∶3)支架内增殖和分化的扫描电镜照片.图5(a)显示了NSCs以球状或团簇状黏附于支架的孔壁或孔隙内;而图5(b)则显示NSCs附着在孔道壁上,分化的神经突触向外伸展,并相互交织呈网状.这个结果进一步证明了胶原-壳聚糖复合支架具有良好的生物相容性并提供适合NSCs生长的微环境,NSCs能够在支架内良好地生长、增殖及分化.

图5 NSCs在经过LN修饰的胶原-壳聚糖(7∶3)支架内生长情况的扫描电镜观察Fig.5 The growth state of NSCs in LN-treated collagen-chitosan(7∶3)scaffolds via SEM
3 结 语
三维培养作为体外二维细胞系统的研究与组织器官及整体研究的桥梁,既能保留体内细胞微环境的物质及结构基础,又能展现细胞培养的直观性及条件可控性优势.近几年来,随着干细胞与组织工程技术的新兴发展,三维培养在组织形成、血管发育和器官再造等发育生物学的分支领域得到了广泛的应用;同时在筛选新药的疗效分析和毒理实验方面,利用三维培养获得了和二维培养方式完全不同的结果,也引起了药理学家的极大兴趣[17].本文采用冷冻干燥法制备了胶原-壳聚糖复合支架,通过层粘连蛋白进行结构修饰,并测定了其物理性能特征,建立了胎鼠海马神经干细胞(NSCs)的三维培养体系.通过孔径、孔隙率、吸水率、降解率等参数的比较得出,体积比为7∶3的复合支架更适合于体外细胞培养的要求;激光共聚焦显微镜及扫描电镜观察表明,NSCs能够在胶原-壳聚糖复合支架内良好地生长、增殖及分化.这些结果对于NSCs的进一步临床移植应用,以及治疗神经系统疾病的新药筛选和机理研究等有明确的理论和工程实用意义.然而由于技术条件的原因,目前体外三维培养所创建的培养条件仅处于亚最佳状态,培养的细胞仅具备有限的生存能力和有限的分化程度,仍然有待于进一步发展和完善.
[1]KULBATSKI I,MOTHE A J,NOMURA H,etal.Endogenous and exogenous CNS derived stem/progenitor cell approaches for neurotrauma [J].Current Drug Targets,2005,6(1):111-126
[2]MARTINO G,PLUCHINO S.The therapeutic potential of neural stem cells [J].Nature Reviews Neuroscience,2006,7(5):395-406
[3]MCLEOD M, HONG M, SEN A,etal.Transplantation of bioreactor-produced neural stem cells into the rodent brain [J].Cell Transplantation,2006,15(8-9):689-697
[4]RUBIN L L.Stem cells and drug discovery:the beginning of a new era[J].Cell,2008,132(4):549-552
[5]REYNOLDS B A, WEISS S.Clonal population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell[J].Developmental Biology,1996,175(1):1-13
[6]GAGE F H.Mammalian neural stem cells [J].Science,2000,287(5457):1433-1438
[7]NAKAJIMA M,ISHIMURO T,KATO K,etal.Combinatorial protein display for the cell-based screening of biomaterials that direct neural stem cell differentiation[J].Biomaterials,2007,28(6):1048-1060
[8]ALAVI A,STUPACK D G.Cell survival in a threedimensional matrix [J].Methods in Enzymology,2007,426:85-101
[9]YANG F, XU C Y, KOTAKI M,etal.Characterization of neural stem cells on electrospunpoly(L-lactic acid)nanofibrous scaffold[J].Journal of Biomaterials Science-Polymer Edition, 2004,15(12):1483-1497
[10]O′CONNOR S M,STENGER D A,SHAFFER K M,etal.Primary neural precursor cell expansion,differentiation and cytosolic Ca2+response in threedimensional collagen gel[J].Journal of Neuroscience Methods,2000,102(2):187-195
[11]MA W,FITZGERALD W,LIU Q Y,etal.CNS stem and progenitor cell differentiation into functional neuronal circuits in three-dimensional collagen gels [J].Experimental Neurology,2004,190(2):276-288
[12]FREIER T,KOH H S,KAZAZIAN K,etal.Controlling cell adhesion and degradation of chitosan films by N-acetylation [J].Biomaterials,2005,26(29):5782-5878
[13]刘天庆,戴明舒,葛 丹,等.神经球内神经干/祖细胞活性与代谢研究[J].大连理工大学学报,2008,48(6):811-818(LIU Tian-qing,DAI Ming-shu,GE Dan,etal.Study of viability and metabolism parameters of NSPCs [J].Journal of Dalian University of Technology,2008,48(6):811-818)
[14]关 水,刘天庆,葛 丹,等.原儿茶酸对体外培养的神经干/祖细胞增殖及凋亡的影响[J].中国药理学通报,2009,25(4):448-452
[15]WANG Y C,LIN M C,WANG D M,etal.Fabrication of a novel porous PGA-chitosan hydrid matrix for tissue engineering [J].Biomaterials,2003,24(6):1047-1057
[16]HIRANO S,ZHANG M,NAKAGAWA M,etal.Wet spun chitosan-collagen fibers,their chemical N-modifications, and blood compatibility [J].Biomaterials,2000,21(10):997-1003
[17]PAMPALONI F,REYNAUD E G,STELZER E H.The third dimension bridges the gap between cell culture and live tissue[J].Nature Reviews Molecular Cell Biology,2007,8(10):839-845
