中药企业如何有效开拓美国市场
2011-09-26周恩宇
周恩宇
(西藏奇正藏药股份有限公司,西藏 林芝 86000 0)
中药企业如何有效开拓美国市场
周恩宇
(西藏奇正藏药股份有限公司,西藏 林芝 86000 0)
介绍了美国FDA对中药的最新管理规定,并通过分析中药出口美国所遇到的主要问题,结合作者10余年的中药出口经验,提出了中药产品进入美国的准入策略、产品策略以及分销策略,对中药企业有效开拓美国市场具有积极的指导作用。
中药企业;开拓;美国市场
美国食品药品管理局(Food and Drug Administration),简称FDA,负责中药的进口管理和市场销售监管。FDA约有9000余名工作人员,在美国一百多个大城市均有分支机构,总部设在华盛顿。FDA主要依据《联邦食品、药品与化妆品法》来行使其监督管理职能。FDA的根本任务是管制人用药品、人用生物制品、兽用药品、食品、化妆品、医疗器械以及放射性产品的上市以及安全性检测,确保美国国民的健康安全。
中药作为药品进入美国市场,其质量标准及药品安全性、有效性必须符合FDA要求,如果不符合则必须进行临床试验申请,临床试验结束后方可提出上市申请。中药按照药品进入美国市场难度很大,中国目前还没有一家企业的中药产品获得FDA批准按照新药进行上市销售的。2004年6月1日FDA发布了《植物药工业指导》(Gui dance for Industry Botanical Drug Product),对植物药新药的质量标准提出了有别于化学药品的特殊规定,并对复方产品提出了相关规定,为中药按照新药申请进入美国提供了可能。
与中药关系最为密切的法律是1994年美国通过的《膳食补充剂健康与教育法》(Dietary Supple ment Health and Education Actof 1994),该法为中药按照膳食补充剂进入美国市场提供了法律依据。根据《膳食补充剂健康与教育法》的规定,膳食补充剂作为食品是不准在其标签上声明疗效,即预防、治疗、诊断疾病的作用,无需美国FDA批准即可上市销售。如果标签中标有预防、治疗、诊断疾病的作用,则按药品对待,需要FDA审批。如果膳食补充剂中含有新成分,即1994年10月15日以前没有在美国市场上销售过,则生产商或经销商需提前75天向FDA提交有关该产品的新成分被认为是安全的预售通知,同时须附上相关资料附件。FDA收到预售通知后,会回信告知归档日期,从归档日期开始的75天内该产品不能进行销售。
2001年9月11日恐怖袭击事件后,美国加强了进口商品的监管。2002年FDA颁布了《公共卫生安全与反恐准备与反应法案》,要求所有的膳食补充剂在启运前向FDA预申报,提前进行企业FDA反恐注册。2007年10月24日FDA又颁布了《膳食补充剂产业实施Gm P的指南》,要求所有的膳食补充剂生产企业必须达到Gm P的生产标准:30人以下的小企业需要在2008年9月1日前提供达到GmP认证的相关文件,30~500人的中等规模的企业需要在2009年9月1日前提供Gm P认证的相关文件,500人以上的大型企业需要在2010年9月1日前提供GmP认证的相关文件。2008年FDA又颁布了与中药密切相关的对含有 “马兜铃酸”的植物制品的管理规定。2009年1月29日开始,美国根据2006年港口安全法开始要求所有进口到美国的货物必须进行ISF申报即进口安全申报(Im porter Security Filing)和运送人附加要求,要求美国进口商必须在货物装船前二十四小时向美国海关进行10项申报和2项船公司的申报,即10+2申报,否则将处以重罚。
1 中药产品进入美国市场的主要问题
从20世纪90年代初,中药开始进入美国市场,但20年后中药在美国草药类膳食补充剂的市场份额还不到2%。据美国知名市场分析公司Nutrition Business Journal统计,2009年美国草药类膳食补充剂的总销售额为50.30亿美元,而中药只有1.4亿美金,约占1.98%。中药出口美国数量较小的主要原因是企业缺乏对美国FDA法规的了解,产品质量不过关,中药产品准入定位模糊以及分销模式单一等。
1.1 产品准入定位模糊
多数企业在开拓美国市场前,对FDA法规缺乏详尽的了解,对自身产品的准入定位模糊,仅仅是按照客户的订购盲目发运,导致货物进关时被查扣或销售时被抽检不符合FDA规定的情况屡屡皆是。中药企业一般有以下几种错误的准入定位。
一种是不了解FDA对中药产品的管理,仅仅是将原内销产品包装的成分、功能主治以及用法用量翻译成英语,结果在产品外包装上显示了预防、治疗、诊断疾病的文字,进关时被FDA查扣,导致产品被强制退运或全部销毁,使企业遭受了巨大损失。另一种是按膳食补充剂的身份进行准入申报,但不了解膳食补充剂标准以及标签的相关规定,在准入时,被FDA抽检不合格,导致销毁或退运,其中60%的情况属于未按膳食补充剂的标签规定设计标签,40%属于产品成分、重金属指标等不符合FDA的规定。
1.2 产品质量不过关
绝大多数出口中药剂型多以丸、散、膏、丹、汤、酒类等传统制剂为主,不能满足西方人普遍追求药物高效、速效、长效的 “三效”要求以及追求储存方便、服用方便和携带方便的 “三便”的要求。
另外一些中药产品含有西药成分,有些中药产品还含有濒危动植物成分,大部分中药产品重金属以及农药残留均大大超出美国的进口规定。2000年欧洲与美国所掀起的 “马兜铃酸”事件,2001年美国加州法院宣判中药有毒的事件,2002年日本媒体借口 “御芝堂减肥茶”掀起怀疑我国中药的浪潮,以及2003年新西兰政府查禁部分中成药销售等事件,均是由于少数中药产品质量不过关造成的。
1.3 分销模式单一
中药产品在海外的销售模式,基本上是实行独家经销制。独家经销制具有投入小、产出稳定的优点,在企业开拓海外市场初期易于吸引客户和建立客户关系。但独家经销全部依赖于独家经销商的实力,如果独家经销商销售不力,则不利于企业的发展。如兰州佛慈制药集团在海外的营销渠道就是以独家经销为唯一的销售模式。1993年佛慈集团与美国美威行全面合作成立兰州佛慈制药有限公司,美威行获得佛慈产品欧洲、美洲的长达50年的独家销售经销权,但截止2005年,欧洲、美洲的年销售增长率均不到10%,甚至在2003年后产品才开始在欧洲销售,这期间虽然想更换经销商,但由于单方面撤销协议需要付出高额的赔偿,故均未实现销售模式的改变,这在很大程度上限制了业务的发展。
2 中药产品开拓美国市场的有效策略
在当前美国FDA对中药产品监管逐渐加强的情况下,中药产品要想尽快开拓美国市场,必须对FDA有关中药的管理法规有一个完整清晰的了解,中药企业必须从源头着手,提高产品质量,采取有效的准入策略,改变传统的独家经销模式为扁平化分销模式等。
2.1 准入策略
美国FDA对进入美国的商品监管较严,中药出口前必须向FDA进行预申报,按照预先申报的类型,FDA经过核查抽检后,方可进口。根据FDA相关法规,中药产品可以按照保健食品、膳食补充剂、化妆品、外用草药制剂、医疗器械、植物药新药的身份准入美国市场销售,可采取以下准入定位:
2.1.1 按照膳食补充剂(DIETARYSUPPLEmENT)和保健食品(HEALTH FOOD)的身份准入 膳食补充剂包括氨基酸、微量元素、维生素、矿物质及中草药类,按照膳食补充剂身份准入,产品需要符合卫生标准,符合重金属限量标准,不含濒危物种成分,同时FDA对于标签及外包装有严格的要求,而且生产企业必须达到Gm P标准。保健食品,又叫功能食品,除需达到普通食品的有关微生物、有毒物质以及农药残留的进口标准外,还需具有改善人体机能的功效,而且需要做营养标签。这两类产品不须经过FDA批准即可准入上市。
2.1.2 按照医疗器械(MEDICAL DEVICE)、化妆品(COSmETIC)以及外用草药(EXTERNAL HERBALPRODUCTS)制剂来准入申报 医疗器械指用于预防、诊断和治疗疾病,或以保健为目的的各种装置,用具、器械和设备。化妆品指以擦、倒、洒、喷、导入或其他方式用于人体及其任何部位,以达到清洁、保健、美化、治疗或改变容貌作用的物品。外用草药制剂是由纯天然植物或提取物组成,以外用类剂型如贴剂、洗剂、栓剂等形式作用于人体,起到保健治疗作用的产品。此类产品均需要提交相关资料以及产品样本交FDA审批获准后方可进口,审批一般需要3~6个月时间。如奇正消痛贴膏就以医疗器械的身份获准FDA注册成功进入了美国市场,而恩威集团的洁尔阴洗液就以外用洗剂的形式获得了注册许可,均取得了较好的销售。
2.1.3 按照植物药(BotanicalDrug)新药申报 植物药申报除产品必需符合植物药的质量标准外,还需进行早期临床实验(IND),使其安全性和有效性达到上市许可标准。如2006年10月31日FDA批准了来自德国的V eregen的上市申请(NDA),该药属于FDA批准的第一个植物药新药,仅Ⅲ期临床试验就在美国进行了1000例左右,从研制到FDA批准在美国上市花费了将近20年时间。2006年,天津天士力集团生产的复方丹参滴丸在美国获准进行新药Ⅱ期临床试验,2010已完成了Ⅱ期临床试验,目前已被FDA获准进入Ⅲ期临床试验,有望成为我国第一个被FDA批准的新药。
中药企业要想快速有效的开拓美国市场,应采取由易到难、循序渐进的准入策略。市场开拓初期,企业无法确定产品的销售预期,不宜投入太大,可以采用第1种方式或第2种方式定位准入,在产品已经得到市场和消费者的认可后,如果产品在美国的销售潜力巨大,产品资料也比较完整,则可以考虑按照第3种方式进行FDA申报,获得上市许可。
2.2 提高产品质量
要研制具有市场潜力、疗效显著、科技含量高并符合FDA相关规定的产品作为拓展市场的拳头产品。首先要建立中药材无公害种植基地,从源头上确保中药材重金属、农残等指标达到美国进口标准,还可以保证合格药源的持续供应。对药材的前处理以及中成药的加工一定要严格遵守Gm P操作规范,加强与美国当地药品检测实验室的合作,确保产品达到FDA的监测要求。其次要改善产品原有的丸、散、膏、丹、汤、酒类等传统剂型,研制储存方便、服用方便和携带方便的高效、速效、长效的产品。最后产品的包装设计不但要有利于塑造品牌形象,而且还要符合美国FDA对药品、保健品的有关规定,图案、色彩等均要符合当地人的消费习惯。如兰州佛慈集团生产的浓缩丸系列产品就以其过硬的质量屡次通过FDA的重金属检测,在经销商和消费者心中赢得了较好的信誉,目前在美国年销售额已达100万美金。
2.3 采用扁平化的分销模式
目前许多中药企业进入美国市场,均是寻找一家中药经销商签订独家代理协议,尤其全面负责销售。但由于美国地区幅员辽阔,销售跨度大,中药经销商均具有自己优势的销售地区,但均不能覆盖所有的销售区域。中药经销商均希望经营上百个品种,并垄断经销代理权。在这种模式下,产品短期开拓市场效果较快,但从中长期战略来看,经销商在此模式下销售某一品牌产品的主动性较差,一般不会花费更多精力来对自己代理的某一个产品进行大力投入,故中药企业必须改变传统的独家代理销售模式,采用扁平化的分销模式,增加更多的经销商将产品通过销售到顾客手中。
2.3.1 建立区域分销模式 改变中药企业在海外的传统的独家代理经销模式,通过建立企业的海外分公司或事业部,将销售区域按地理区域进行市场细分,如按美国中药主要消费城市进行细分为夏威夷销售区域、旧金山销售区域以及纽约销售区域等,在每个区域授权特定的经销商进行产品的销售,但由中药企业的海外公司进行统一的渠道管理和货物配送,如图1所示。
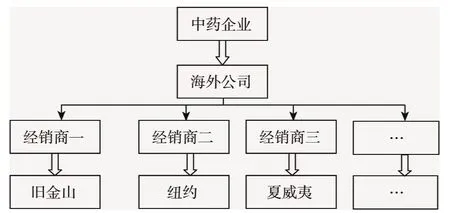
图1 分销模式一
2.3.2 建立渠道分销模式 改变中药企业在海外的传统的独家代理经销模式,通过建立企业的海外分公司或事业部,将市场按照中药的不同销售渠道进行市场细分,根据中药的销售渠道划分经销区域,如将草药健康品店、连锁超市以及食品杂货店此类渠道作为第一经销渠道,将按摩师、针灸师、传统治疗师等所在的中医诊所、针灸诊所以及替代医学门诊所在的渠道,作为第二销售渠道,同时选择在每个渠道内具有影响力的公司作为产品的经销商,授权其对产品进行销售。由海外公司对这几种渠道进行统一管理和统一货物配送,如图2所示。
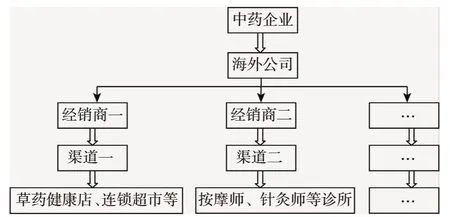
图2 分销模式二
2.3.3 实现网络分销 通过网络进行直接销售。建立适合美国本土顾客消费习惯的专业销售网站,通过在线网络进行网上订购销售,同时寻找美国本土的专业药品配送商,负责产品的进口、储存以及物流配送。
[1]闫国庆.国际市场营销学[M].北京:清华大学出版社,2007:7.
[2]傅俊英,贾谦.加强中医药知识产权保护实现中医药可持续发展[J].世界科学技术-中医药现代化,2004,6(4):13.
[3]赵杭丽,凤进.实施产学研资源整合提升中医药产业综合竞争力[J].研究与发展管理,2004,12(6):.105-109.
[4]么历.国内外中药市场分析[M].北京:中国医药科技出版社,2003.
周恩宇,E-mail:zhenyu@qzh.cn
2010-07-21)
