外源添加剂水杨酸对菊花江蓠抗寒性的影响
2011-09-24范皖苏黄鹤忠徐汗福何华敏贾一何
范皖苏, 黄鹤忠, 徐汗福, 何华敏, 贾一何
(苏州大学 基础医学与生物科学学院, 苏州大学 水产研究所, 江苏 苏州 215123)
外源添加剂水杨酸对菊花江蓠抗寒性的影响
范皖苏, 黄鹤忠, 徐汗福, 何华敏, 贾一何
(苏州大学 基础医学与生物科学学院, 苏州大学 水产研究所, 江苏 苏州 215123)
通过室内实验生理生态学的方法研究了外源添加剂水杨酸(SA)对菊花江蓠(Gracilaria lichevoides)抗寒性的影响。研究表明, 通过添加0.5 mmol/L的SA, 可以明显降低(实验组)江蓠的丙二醛(MDA)积累量、电解质渗透率; 其脯氨酸含量、特定生长率(RSG)、超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的活性均明显高于未用SA处理组。在低温(6~8℃)条件下, 0.5 mmol/L SA处理组与未处理组及其他SA处理组相比存活时间明显延长, 特定生长率(RSG)未出现负增长。表明添加0.5 mmol/L的SA可以明显提高江蓠耐低温胁迫能力。
菊花江蓠(Gracilaria lichevoides); 低温; 水杨酸; 抗性
菊花江蓠(Gracilaria lichevoides)隶属于红藻门、真红藻纲、杉藻目、江蓠科、江蓠属, 分布在中国的台湾省和菲律宾等温带和亚热带潮间带或低潮线附近的天然海域, 为中国台湾、海南和福建等海水池塘或浅海水域的主要栽培种类[1]。菊花江蓠适宜生长的海水温度为 l5~36℃, 是目前国内外报道的江蓠种类中最耐高温的大型经济海藻, 它不但是养鲍的主要饵料、琼胶工业和保健食品的原料,更重要的是近海和海水养殖池塘春、夏、秋季均可适用的水质环境修复的工具藻, 已被浙江、江苏和山东等地少量引进[2]。尽管该藻的营养体在中国福建以南地区能比较顺利地过冬, 但是在浙江及以北的地区无法安全越冬, 严重影响了它在中国沿海大面积推广的区域。因此, 解决菊花江蓠的越冬保种问题显得十分必要。
水杨酸(SA)是普遍存在于高等植物体内的内源生长调节物质, 已有大量的实验证实水杨酸可以提高植物对低温、高温、盐害等胁迫的抗性。研究表明, 喷施SA能显著提高低温下黄瓜叶片[3]和黄瓜幼苗[4]的抗氧化酶活性, 提高水稻幼苗[5]抗低温胁迫能力, 降低低温对细胞膜损害, 提高植株抗氧化酶活性。但是, 有关SA对江蓠等海藻的耐低温效果研究至今未见报道。作者在实验室条件下通过生理生态学方法, 研究提高江蓠抗低温胁迫能力的SA适宜添加量, 从而为生产上江蓠北移越冬保种提供理论依据和技术支持。
1 材料与方法
1.1 材料来源与预培养
试验用菊花江蓠(Gracilaria lichevoides)(本文均简称江蓠)采自福建沿海, 经空运带回实验室后的鲜活藻体除去表面附着杂藻, 用过滤海水冲洗干净,移植到盛有15 L水体的人工海水f/2培养液中扩大培养, 培养条件为(22±1)℃, 光照强度 80 µmol/(m2·s), 光周期 12 L : 12 D, 盐度 23, pH 为 7.8。期间每隔3 d添加N、P营养盐1次, 每天定时搅水3次,以保持藻体健康和生长。
1.2 实验设计与方法
根据预先进行的试验结果, 将 SA按高(1 mmol/L)、中(0.5 mmol/L)、低(0.25 mmol/L )和未添加SA共4个浓度处理组分别培养于(25、12、10、8、6 ℃)5个温度水平中, 其中25℃作为常温对照, 各低温组均从25℃开始, 每隔2 d降低5℃, 直至达到各设计温度后开始实验。每个SA与温度梯度设3个平行, 实验在 500 mL的三角烧瓶中进行, 均采用 f/2培养基, 在光照培养箱内按设定的温度培养, 其他培养条件同扩大培养, 培养过程中不充气, 每日摇动2~3次, 培养时间为10 d。实验结果采用F值方差分析法进行显著性差异分析。
1.3 测定指标及其方法
1.3.1 藻体生长的测定
在培养7 d后分别测定各组藻体的质量, 计算藻体的特定生长率(RSG)。藻体的特定生长率(RSG,%/d)=[(Wt/W0)1/t-1] ×100%, 其中:W0为开始时的鲜质量,Wt为t时间的鲜质量,t为实验天数。
1.3.2 细胞膜透性测定
采用电导法[6]测定, 用 DDS-320型电导率仪测定江蓠初电导率S初和终电导率S终。计算出相对电导率S相对,S相对=S初/S终, 用于评估细胞膜透性的大小[7]。
1.3.3 丙二醛(MDA)含量的测定
采用硫代巴比妥酸比色法[8]测定丙二醛含量(MDA), MDA含量(湿质量)的单位以µmol/g计。
1.3.4 脯氨酸含量的测定
采用茚三酮显色法测定[8]脯氨酸含量, 脯氨酸质量比(湿质量)的单位以μg/g计。
1.3.5 超氧化物酶歧化酶(SOD)活性的测定
采用氮蓝四唑(NBT)光化学还原法测定[8]SOD活性, SOD以1 g鲜藻体(湿质量)中抑制NBT光化还原50%的酶量为一个酶活力单位, 用U表示。
1.3.6 过氧化物酶(POD)活性的测定
用愈创木酚法进行测定[8]POD活性, POD的酶活力单位为1 g鲜质量藻体(湿质量)1 min内A470的变化, 用U表示。
1.3.7 过氧化氢酶(CAT)活性的测定
采用比色法[8]测定CAT活性, 取粗酶液0.2 mL,加入3 mL CAT反应混合液, 迅速倒入比色杯中, 紫外分光光度计测量240 nm处吸光度值。每1 min读数1次, 共读2次。以1 min内吸光度值的变化值表示酶活性, 用U表示。
2 结果与分析
2.1 不同温度条件下的 SA处理对江蓠生长率的影响
图 1反映了江蓠在低温胁迫下, 在实验培养的10 d期间内其特定生长率(RSG)的变化情况。在低温胁迫下, 各实验组江蓠RSG均较低, 随着温度的下降,江蓠的RSG也呈下降趋势。特别是在低温8 ℃时, 未处理实验组江蓠的RSG出现了负值; 在低温 6 ℃时,0.25 mmol/L和1 mmol/L SA处理的实验组也出现负增长; 而0.5 mmol/L SA处理的实验组在低温处理下未出现负增长。方差分析表明, 0.5 mmol/L SA处理的实验组与其他各实验组及未处理组的RSG水平差异明显(P<0.05)。由此可见, 低温影响了江蓠的生长和物质合成, 更低的温度还会引起江蓠的负生长甚至死亡, 但添加适宜剂量的SA可显著改善江蓠在低温环境下的生存和生长。
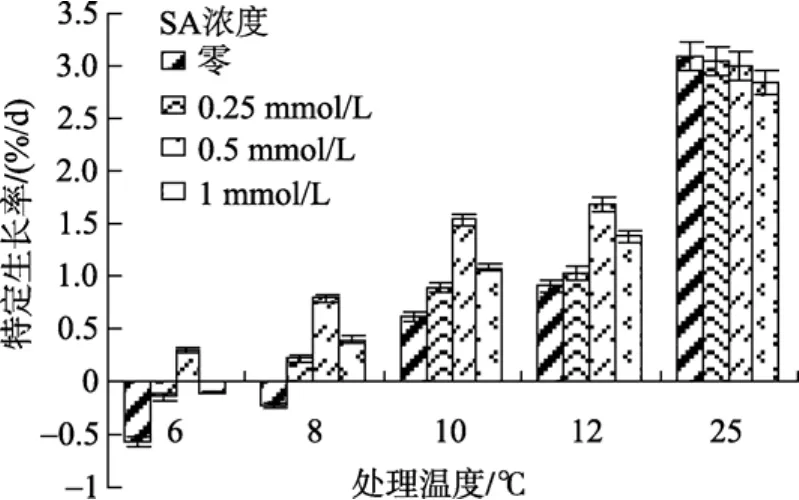
图1 不同浓度水杨酸和温度处理对江蓠特定生长率的影响(以下各图浓度处理及标识均相同)Fig. 1 Effects of different concentrations of SA on special growth rate ofG.lichevoidesto chilling stress (The following chart dealed with the same concentrations)
2.2 不同温度条件下的 SA处理对江蓠细胞膜透性的影响
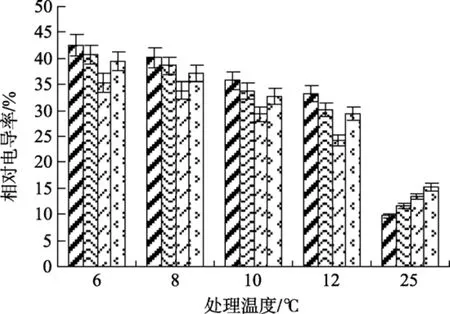
图2 不同浓度水杨酸和温度处理对江蓠细胞膜透性的影响Fig. 2 Effects of different concentrations of SA on electrolytes leakage ofG.lichevoidesto chilling stress
图 2显示, 不同浓度 SA以及不同的低温处理,江蓠细胞膜电解质渗透率不同, 随着温度的下降,江蓠电解质渗透率也逐渐增高。未添加SA处理的实验组在低温 12、10、8、6℃下, 相对电导率分别为33.31 %、35.78 %、40.11 %、42.55 %; 而添加0.5 mmol/L SA的实验组的相对电导率依次分别为24.25 %、29.37%、33.86 %、35.31 %, 与相同低温梯度下0.25、1 mmol/L和未添加SA的实验组相比, 相对电导率较低, 且差异明显(P<0.05)。在25℃常温下,随着SA处理浓度的提高, 江蓠细胞的相对电导率呈上升趋势, 但差异不显著(P>0.05)。由以上结果可以看出, 在低温条件下, SA对细胞质膜具有良好的保护作用, 其中0.5 mmol/L 的SA处理效果较好。
2.3 不同温度条件下的 SA处理对江蓠MDA含量的影响
MDA是膜脂过氧化的主要产物, 是植物器官衰老或在逆境条件下发生膜脂过氧化的产物之一, 其含量高低表示细胞膜脂过氧化程度和植物对逆境条件耐受的强弱[9], 其含量的变化是质膜损伤程度的重要标志之一。从图3中可以看出, 在低温处理下未经 SA处理的实验组植物体内 MDA含量上升很快,而经SA处理实验组的MDA含量上升缓慢, 且MDA的含量低于未处理组水平。方差分析表明, 在低温条件下, 经过0.5 mmol/L SA处理的实验组的MDA含量显著低于其他各组的水平(P<0.05)。
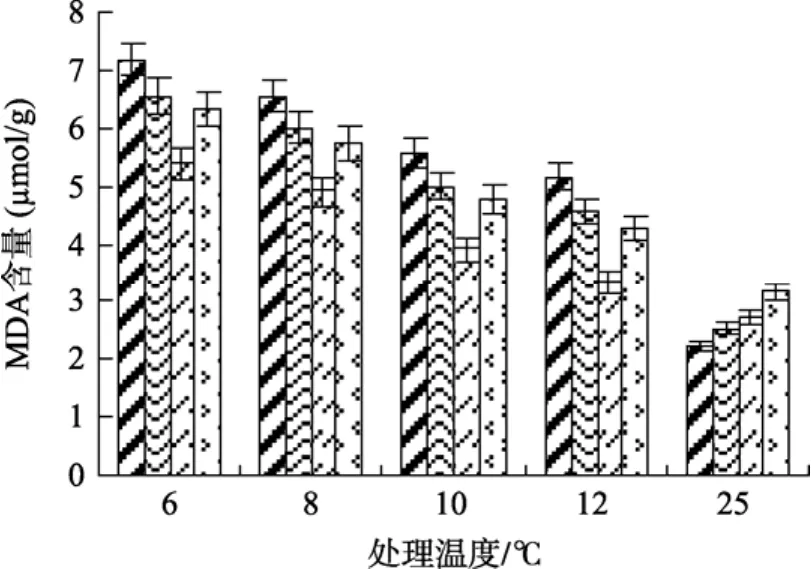
图3 不同浓度水杨酸和温度处理对江蓠MDA含量的影响Fig. 3 Effects of different concentrations of SA on MDA content ofG.lichevoidesto chilling stress
2.4 不同温度条件下的 SA处理对江蓠脯氨酸含量的影响
目前大多数研究认为脯氨酸与植物抵御温度逆境存在相关性, 因此, 脯氨酸含量可以作为植物抗逆性的一个检测指标[10]。从图4可以看出, 在低温胁迫过程中, 江蓠体内的脯氨酸含量均比常温条件下有显著提高(P<0.05), 而且, SA处理的实验组脯氨酸含量明显高于未处理实验组含量, 其中, 用 0.5 mmol/L SA处理的实验组脯氨酸含量上升最快, 在同一低温(12、10、8、6℃)条件下与未处理组相比其含量分别高出 43.3%、50.5%、40.4%、51.1 %(P<0.05)。实验表明, 低温胁迫能诱导江蓠体内产生一定量的脯氨酸用以抵抗逆境, 而在添加SA的情况下, 可能促进藻体摄取合成蛋白的主要营养元素, 从而加强脯氨酸的合成, 导致藻体内脯氨酸含量增高[11]。
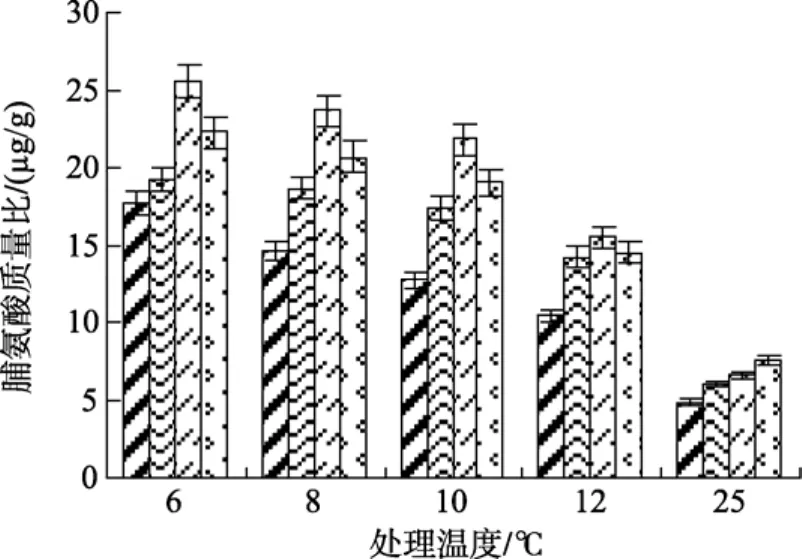
图4 不同浓度水杨酸和温度处理对江蓠脯氨酸含量的影响Fig. 4 Effects of different concentrations of SA on proline content ofG.lichevoidesto chilling stress
2.5 不同温度条件下的 SA处理对江蓠SOD活性的影响
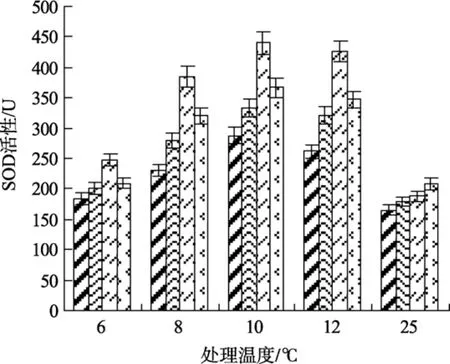
图 5 不同浓度水杨酸和温度处理对江蓠 SOD活性的影响Fig. 5 Effects of different concentrations of SA on SOD activity ofG.lichevoidesto chilling stress
SOD可以催化超氧阴离子自由基的歧化作用成为分子氧或过氧化氢, 控制脂质氧化, 减少超氧阴离子对植物体膜系统的伤害。由图5可以看出, 与常温(25℃)处理相比, 低温(12、10、8℃)条件下各实验组SOD活性均呈上升趋势, 可能是低温刺激了植物体内超氧阴离子的大量产生, 进而诱导了江蓠体内SOD活性的提高。实验表明, 0.5 mmol/L SA处理组的SOD活性水平显著高于其他各低温实验组的水平(P<0.05)。在6℃低温条件下, 各浓度组的SOD活性均较低, 与 25 ℃处理组的 SOD 活性相近, 而 0.5 mmol/L SA处理组的SOD活性仍显著高于其他各处理组和未处理组(P<0.05)。由此可见, 添加 0.5 mmol/L SA可有助于提高江蓠在低温胁迫下其体内SOD活性。
2.6 不同温度条件下的 SA处理对江蓠POD活性的影响
研究表明, 低温胁迫下, 植物体内会产生大量的H2O2, H2O2可以间接地氧化细胞内核酸、蛋白质等生物大分子, 并使细胞膜受到损害, 从而加速细胞的衰老和解体[8], 而POD是植物体内清除H2O2的活性酶。由图 6可见, 与常温(25℃)处理相比, 低温下各实验组POD活性均呈上升趋势, 显示低温胁迫刺激了江蓠体内POD的活性; 且0.5 mmol/L SA处理组的POD活性水平均分别显著高于其他各实验组在低温下的水平(P<0.05)。在 6℃低温条件下, 各浓度组的POD活性均较低, 与25 ℃处理组的POD活性相近, 显示随着低温胁迫的加剧, POD酶合成受到影响; 而0.5 mmol/L SA处理组的POD活性仍显著高于未处理组(P<0.05)。
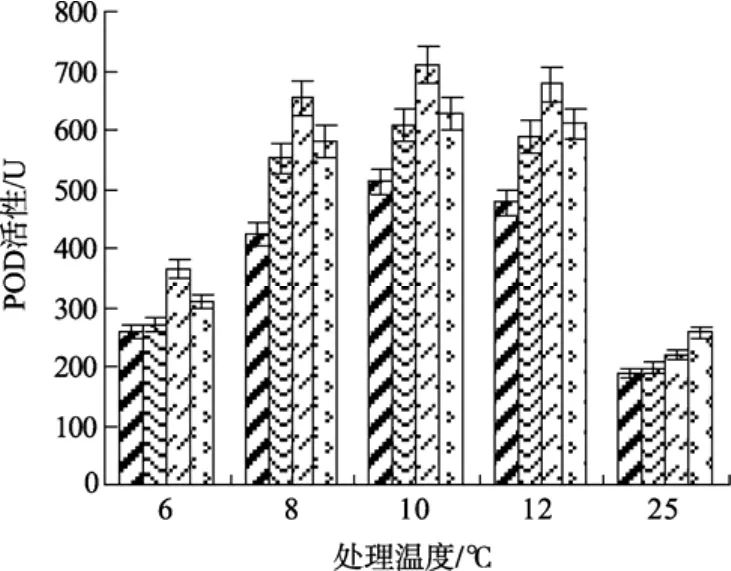
图6 不同浓度水杨酸和温度处理对江蓠POD活性的影响Fig. 6 Effects of different concentrations of SA on POD activity ofG.lichevoidesto chilling stress
2.7 不同温度条件下的 SA处理对江蓠CAT活性的影响
CAT是植物体内清除H2O2的活性酶。由图7可见, 与常温(25℃)处理相比, 低温(12、10、8℃)下各实验组 CAT活性均呈上升趋势, 显示低温胁迫刺激了江蓠体内CAT的活性。且0.5 mmol/L SA处理组的 CAT活性显著高于其他各实验组(P<0.05)。由结果显示, 0.5 mmol/L SA处理实验组在低温(12、10、8℃)条件下的 CAT活性分别达到 370.43、407.82、347.89 U/(g·min), 其含量与未处理组、0.25 mmol/L和1.0 mmol/L SA实验组相比, 分别提高了34.21%、29.78%、25.67%, 33.62%、22.95%、18.75%和 31.80%、25.49%、19.58%。在低温6℃条件下, 各处理组CAT活性均出现了下降, 且与25 ℃处理组的CAT活性相近, 但0.5 mmol/L SA处理组的CAT含量仍然明显高于未处理组的含量(P<0.05)。
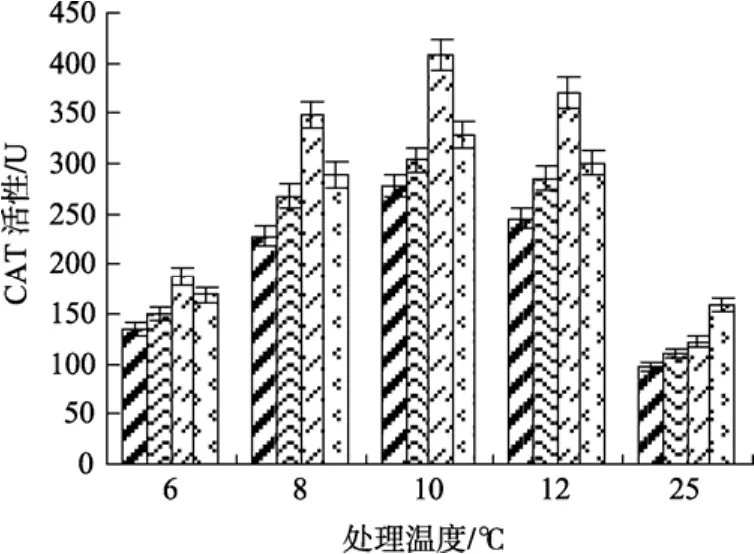
图7 不同浓度水杨酸和温度处理对江蓠CAT活性的影响Fig. 7 Effects of different concentrations of SA on CAT activity ofG.lichevoidesunder chilling stress
3 讨论
3.1 SA与膜系统和膜脂过氧化的关系
植物受到低温伤害时, 细胞质膜透性会有不同程度增大, 电解质会不同程度地外渗, 从而导致电导率提高。抗寒性较强的植株, 细胞膜透性随着低温胁迫的加剧而增大的程度较小; 反之, 抗寒性较弱植株, 细胞膜透性会大大增加[12-13]。因此, 细胞质膜相对透性常用作植物抗寒性生理指标之一。本实验表明, 经SA处理后, 江蓠细胞电解质渗透率明显下降, 说明SA对江蓠细胞膜有保护作用。MDA是膜脂过氧化的主要产物, 是植物器官衰老或在逆境条件下发生膜脂过氧化的产物之一, 其含量高低表示细胞膜脂过氧化程度和植物对逆境条件耐受的强弱[9]。本实验中, SA处理的低温实验组 MDA含量显著低于与未处理组。说明SA处理能使江蓠细胞受伤害程度降低, 提高了江蓠的抗寒性。
3.2 SA与江蓠植株生长和脯氨酸含量的关系
温度是植物生长发育所必需的环境因子之一,它影响植物生长发育的所有过程。低温影响了植物进行光合作用等生理反应的各种酶的合成, 不利于植物的生长。本实验中,RSG虽然随着温度的降低而减小, 但是, SA处理组的RSG明显高于未处理组。脯氨酸作为重要的渗透调节物质, 在正常情况下, 它在植物体内的含量并不高, 但当植物受到逆境时,它的含量往往会增加[14]。Pang等[15]也报道, 脯氨酸的积累对细胞进行渗透调节、稳定细胞结构、降低氧化起着重要作用。实验表明, 在不加SA的情况下,江蓠受低温(6℃)胁迫时, 其藻体内脯氨酸含量与常温(25℃)时相比没有升高, 但经过适宜浓度 SA处理后, 江蓠植株体内脯氨酸的含量有显著提高, 从而有利于植物的生长。
3.3 SA与抗氧化保护酶的关系
植物通过体内保护酶系统清除或减少逆境胁迫所产生的活性氧, 避免其对组织细胞的伤害, 从而表现出对氧化胁迫的抗性。SOD可清除超氧阴离子,生成H2O2[17], CAT和POD共同作用清除H2O2, 生成没有毒害的H2O[18]。保护酶系的SOD、POD和CAT可协同作用, 清除膜脂过氧化产生的中间产物(自由基)[16]。所以, 增加SOD、POD和CAT的总体活性, 均可降低自由基含量, 减少细胞膜损伤[18]。本实验结果显示, 在低温(12、10、8、6℃)胁迫下, 经过 SA 处理的实验组SOD、POD和CAT含量呈上升趋势, 且在0.5 mmol/L SA的处理下, SOD、POD和CAT活性最高; 同时, MDA和相对电导率与其他处理组相比其数值最低。说明, SA对江蓠具有加强保护酶系功能和减少细胞膜损伤的作用。
3.4 SA在江蓠越冬保种中的应用前景
温度是植物生长发育所必需的环境因子之一,它影响植物生长发育的所有过程。0 ℃以上的低温对植物造成的伤害, 叫冷害。冷害本质上是低温对植物体造成的生理损伤, 引起冷害的温度一般在0~10 ℃或15 ℃, 冷害对植物体的损伤程度除取决于低温外,还取决于低温维持的时间长短。使植物发生冷害的0℃以上的低温称为冷胁迫[7]。冷害是世界性的一大难题, 是农业生产中非常严重的自然灾害, 每年都造成巨大损失。菊花江蓠是生活在温带和亚热带潮间带或低潮线附近的天然海域的大型藻类, 因为温度的原因, 在中国浙江、江苏、山东等海域还无法安全越冬。SA是一种常见的植物激素, 其用途广泛,与其他植物激素在抗逆性方面相比有着性价比较高的优势。本实验条件下, 0.5 mmol/L SA的添加量很少, 但对增强藻体抗低温胁迫的效果显著。因此, 如果再辅于适当的保温设施可以将本技术应用于生产实际,从而使该优良藻种在浙、苏、鲁等海域中顺利过冬。
[1] 何京.江蓠的人工栽培技术[J].齐鲁渔业 , 2004,21(4): 13-14.
[2] 刘思俭, 揭振英, 曾淑芳.中国江蓠的商品生产及其与对虾混养[J].湛江海洋大学学报, 1997, 17(2):27-30.
[3] 李兆亮, 原永兵, 刘成连, 等.水杨酸对黄瓜叶片抗氧化剂酶系的调节作用[J].植物学报, 1998, 40:256-261.
[4] 孙艳, 崔鸿文, 胡荣.水杨酸对黄瓜幼苗壮苗的形成及抗低温胁迫能力的生理效应[J].西北植物学报,2000, 20 (4): 616-620.
[5] 张蕊, 吕俊, 米青山, 等.低温下外源水杨酸对水稻幼苗抗氧化酶系的影响[J].西南农业大学学报(自然科学版), 2006, 28(2): 29-34.
[6] 刘萍编.植物生理学实验技术[M].北京: 科学出版社, 2007: 92-93.
[7] 张蕊.低温下外源水杨酸对水稻幼苗生理生化特性的影响研究[D].重庆: 西南大学, 2006.
[8] 邹崎.植物生理学实验指导[M].北京: 中国农业出版社, 2000: 56-59.
[9] 刘娥娥, 宗会, 郭振飞.干旱、盐和低温胁迫对水稻幼苗脯氨酸含量的影响[J].热带亚热带植物学报,2000, 8(3): 235-238.
[10] 耿广东, 程智慧, 李建设, 等.水杨酸对茄子幼苗抗寒性的影响[J].西北农林科技大学学报(自然科学版),2002, 31(3): 101-103.
[11] 彭永康, 郝泗城, 王振英.低温处理对豇豆幼苗生长的POD、COD、ATPase 同工酶的影响[J].1994, 9(2):76-80.
[12] 聂庆娟, 孟朝, 梁海永.低温胁迫对4 种常绿阔叶植物膜脂过氧化及保护酶活性的影响[J].植物研究,2007, 27(5): 578-581.
[13] 曾乃燕, 何军贤, 赵文.低温胁迫期间水稻光合膜色素与蛋白水平的变化[J].西北植物学报, 2000, 20(1):8-14.
[14] Schat H, SharmaS S, Vooijs R.Heavy metal–induced accumulation of free praline in a metal-tolerant and a nontolerant ecotype of Silene vulgaris[J].Physiol Plant,1997, 101: 477-482.
[15] Bassi R Sharma SS.Proline accumulation in wheat seeding exposed to zinc and copper[J]. Phytochemistry, 1993, 33: 1339-1342.
[16] 段咏新, 李松泉, 傅家瑞, 等.钙对延缓杂交水稻叶片衰老的作用机理[J].杂交水稻, 1997, 12(6): 23-25.
[17] 童富淡, 胡家如, 陈进红, 等.不同秧苗方式对早稻叶片 SOD 活性、电解质渗透率和发根力的影响[J].浙江农业大学学报, 1997, 23(6): 682-686.
[18] 潘瑞炽, 豆志杰, 叶庆生, 等.茉莉酸甲脂对水分胁迫下花生幼苗 SOD活性和膜脂过氧化作用的影响[J ].植物生理学报, 1995, 21(3): 221-228.
Received: Jun., 23, 2009
Key words:Gracilaria lichevoides; low temperature; salicylic acid; resistance to chilling injury
Abstract:The effect of salicylic acid on the resistance ofGracilaria lichevoidesto chilling injury was studied through in vitro physiological experiments. It was found that 0.5 mmol/L SA could reduce the content of MDA (a product of membrane lipid peroxidation) and relative conductivity and enhance the proline content, special growth rate and the activities of SOD, POD, and CAT, significantly. At 6~8℃, the treatment group (0.5 mmol/L SA) could survived longer than the untreated group, and the special growth rate was positive. So, 0.5 mmol/L SA can enhance the chilling resistance ofG. lichevoides.
(本文编辑:梁德海)
Effects of exogenous salicylic acid on the resistance of Gracilaria lichevoides to chilling injury
FAN Wan-su, HUANG He-zhong, XU Han-fu, HE Hua-min, JIA Yi-he
(School of Medicine and Life Sciences, Medical College of Soochow University, Fisheries Research Institute of Soochow University, Suzhou 215123, China)
S963
A
1000-3096(2011)02-0038-06
2009-06-23;
2010-01-22
江苏省社会发展资助项目(BS2002016)
范皖苏(1985-), 女, 安徽合肥人, 硕士研究生, 主要从事水生生物生理生态学研究, E-mail: fanwansu@163.com; 黄鹤忠, 通信作者,副教授, 硕士生导师, 电话: 0512-62276802, E-mail: suda-shui@163.com
