基于碰撞理论的次氯酸钠水溶液稳定性的研究
2011-09-22柳士锋李林卢丽霞
柳士锋,李林,卢丽霞
(广州立白企业集团有限公司研发中心,广东广州510170)
基于碰撞理论的次氯酸钠水溶液稳定性的研究
柳士锋,李林,卢丽霞
(广州立白企业集团有限公司研发中心,广东广州510170)
以碰撞理论为模型,对次氯酸钠溶液的分解机理进行了研究,得出次氯酸钠溶液在无催化剂影响条件下的主要分解方程式。研究表明,在强碱性条件下次氯酸钠的分解主要是通过ClO-水解生成HClO引发的一系列反应;歧化反应是通过HClO的分解生成的[O]实现的;在强碱条件下,次氯酸钠的分解速率与溶液的初始浓度有关,而反应前后溶液pH值、游离碱含量却几乎不发生变化;升高温度会增加有效碰撞,从而提高反应速率。次氯酸钠溶液添加0.2%、0.6%或1.0%的硅酸钠后,体系稳定度变化不大。
碰撞理论;次氯酸钠水溶液;有效氯;稳定性
碰撞理论是20世纪初建立起来的最常用的反应速率理论之一,该理论从微观的角度对化学反应进行考虑,认为化学反应物分子经过多次碰撞从而形成有效碰撞,促使新物质的生成。在溶液中起反应的分子要通过扩散穿过周围的溶剂分子后,才能彼此接近而发生碰撞。如果溶剂本身也参与了反应,则情况更加复杂[1,2]。
次氯酸钠是一种具有强氧化性的氯漂化合物,用途非常广泛。但是,由于次氯酸钠自身稳定性较差,对其生产、运输、贮存、销售及使用等均带来了极大的不便[3]。影响次氯酸钠稳定性的因素很多,主要有光照、温度、溶液浓度、酸碱度以及催化剂等。对于次氯酸钠的分解方程式有多种说法[4-9],关于溶液pH值对次氯酸钠稳定性的影响,一般认为pH值上升,分解速度减慢[10];有文献认为pH值为反应速率常数K的函数,每提高pH值一个单位,反应速度约减慢20%左右[11]。
次氯酸钠溶液的有效氯为5.0%~6.0%时,常作为日用化学品(漂白剂、消毒剂)使用。硅酸钠由于其优良的碱性缓冲作用、助洗作用、沉淀重金属离子以及铝锌金属缓蚀作用而用于次氯酸钠溶液中。次氯酸钠溶液中添加硅酸钠对溶液稳定性的效果说法不一,有观点认为加入硅酸钠可以增加体系稳定性[6,12],而另有观点认为单独加入硅酸钠无明显效果[13]。
基于碰撞理论对次氯酸钠溶液在强碱性条件下的分解机理进行研究,得出次氯酸钠分解的反应方程式。通过实验对不同初始浓度的次氯酸钠与pH值和游离碱的关系进行考查,并研究了次氯酸钠溶液在50℃和80℃条件下的分解,同时考查了次氯酸钠溶液添加硅酸钠后体系稳定性的变化。
1 次氯酸钠的分解机理
1.1 次氯酸钠分解的宏观方程式

次氯酸钠溶液的分解相当复杂,对于其分解过程(热因素和光因素)也有不同的说法,在碱性条件下对于其主要的分解方程式有2种说法,第1种说法为:第2种说法认为NaClO水溶液的不稳定性主要是因NaClO的分解放出[O]而引起的,而且这个反应在整个反应体系中占优势地位。也正因为[O]的强氧化性使得其他反应连续不断地发生,同时生成NaClO3、O2、HClO、NaOH、HCl等,使得水溶液始终处在一个复杂反应体系中。文献也认为正是由于此原因引起一系列进一步的反应。其反应方程式为NaClO=NaCl+[O](3)
通过碰撞理论模型,可以认为次氯酸钠的分解过程是经过次氯酸的形成、和次氯酸的分解2个步骤来实现的。
1.2 次氯酸的形成过程
方程式(1)、(2)、(3)都是从宏观的角度对次氯酸钠分解过程进行描述,对于溶液中发生的分解机理却鲜见报道。实际上,在溶液中分子或离子需要通过扩散并经过多次有效碰撞,整个反应才会发生。而扩散作用同化学作用一样也需要一定活化能[2],溶液中分子或离子间如果发生化学反应,需同时克服扩散活化能和化学反应活化能。此外,溶液中的反应一般要考虑溶剂分子所起的物理效应或化学效应的影响。运用碰撞理论探讨在强碱性条件下次氯酸钠溶液的分解过程是:在强碱性条件下,新配制的次氯酸钠溶液有效氯分别为9.0%、5.4%和2.1%(假设还未发生化学反应)主要存在H2O、Na+、H+、OH-、ClO-等,ClO-反应决定着次氯酸钠的分解。以有效氯为9.0%的溶液计算,次氯酸钠的浓度为2.5 mol/L,因此,在ClO-周围主要分散着水分子,其它分子和离子都是少量的。溶液中能与ClO-发生反应的有H2O和H+,其反应的方程式分别为:

由于次氯酸是一种通过共价键结合的弱酸,25℃时的解离常数为2.9×10-8,计算得式(5)的ΔrGmθ= -43.02 kJ/mol,所以,反应(4)、(5)从热力学的角度都极易进行。从反应动力学的角度考虑,在强碱性条件下,[H+]<10-7/mol,并且碱性越强,氢离子浓度就越小,因此,[H+]<<[H2O]。从碰撞几率上看,ClO-几乎只与分布在周围的H2O发生碰撞而发生水解。生成产物为OH-和HClO。体系碱性越强,[OH-]越高,当[OH-]×[HClO]/[ClO-]>Kcθ时,则ΔrGm>0,反应(4)不能自发进行,这也是次氯酸钠必须保持一定的pH值以维持体系稳定的原因。

对于反应(5),根据傅献彩等阐述的扩散控制理论[2],则需突破大量的水形成的笼与ClO-碰撞形成“遭遇对”,然后部分[H+…ClO-]形成HClO:式(6)中,[H+…ClO-]表示遭遇对;k1为形成此遭遇对的速率常数,k-1为遭遇对分离为H+和ClO-的速率常数;k2为遭遇对进行反应时的速率常数。利用稳态法可得:

解方程(7)得:

由于该反应的标准吉布斯自由能非常小,反应(6)极易向右进行,此时k2>k-1,则k≈k1,整个反应主要受扩散控制。综上,由于[H+]自身浓度太低,受扩散控制与ClO-反应困难,在强碱性条件下,反应(5)非主要反应。在溶液中是2个带负电荷的ClO-碰撞由于电荷斥力比较大,且有大量的溶剂阻隔,难以形成遭遇对,反应活化能非常大,难以直接发生歧化反应。
1.3 次氯酸的分解过程
在强碱性条件下主要通过ClO-水解生成的HClO极其不稳定,造成其不稳定的原因是HClO分子结构的高度不对称性。根据杂化轨道理论,中心氧原子以sp3形式杂化,由于氢原子半径小,极化能力非常强,造成氧原子和氯原子周围的电子云形状发生变形,向氢原子周围偏移,这种变形造成氯原子电子云密度降低,Cl—O键能降低,在高温、光照等条件下容易断开。也正是由于极化造成氯原子的离子势(Z/r)比较大,表现为氯有非常强的氧化得电子能力。
基于上述原因,在高温加热或自然状态下,HClO中的键会发生断裂。由于氯原子的离子势比较大,分解后,氯为负一价。

反应(12)会引起以下反应:

在温度比较高或者次氯酸钠浓度比较大的条件下,ClO-(或Cl-)在溶液中与[O]经过反复碰撞而形成遭遇对[ClO-…2O]或[Cl-…3O],进而生成更加稳定的:

由于在次氯酸钠溶液中ClO-要比HClO分解产生的Cl-多很多,故与[O]碰撞的概率比Cl-大很多。且反应(16)中Cl-结合3个[O]的难度可能要比反应(15)大,在温度比较高或者次氯酸钠浓度比较大的条件下反应(15)为主要反应,故反应的ΔrGm应该比较大。结合方程式(4)、(12)、(13)、(14)、(15)整理,可得出次氯酸钠溶液的宏观主要分解方程式为反应式(1)和(2)。值得注意的是,反应(2)所谓的歧化反应是通过[O]来实现的。
2 实验部分
2.1 原料与仪器
次氯酸钠溶液,有效氯质量分数约为10%工业品,广州市一分利化工贸易有限公司;硅酸钠,工业级,广州市雄泽贸易有限公司;PH 140A型恒温干燥箱,上海一恒科技有限公司;PB-10标准型酸度计(pH计),赛多利斯科学仪器(北京)有限公司;其他相关化学试剂为分析纯,实验及分析仪器为实验室常用仪器。
2.2 实验过程
首先,根据计算向400 mL烧杯中加入定量的蒸馏水,然后,加入已精准测量过有效氯的次氯酸钠溶液,配制成有效氯质量分数分别为9.0%、5.4%和2.1%三个梯度的溶液,并加入氢氧化钠调节溶液的游离碱和pH值,用聚四氟乙烯搅拌桨搅拌5 min。按照上述方法再次配制次氯酸钠溶液,加入一定量的氢氧化钠溶液并分别加入质量分数为0.2%、0.6%和1.0%的硅酸钠溶液,搅拌5 min。将配制好的溶液放入不透明的高密度聚乙烯瓶中,将其中部分溶液置于50℃烘箱中,定时取样,测定溶液的有效氯、游离碱、pH值;其余溶液置于80℃的烘箱中,定时取样,测定溶液的有效氯、游离碱、pH值。
2.3 分析方法
次氯酸钠溶液的有效氯含量及游离碱含量根据标准GB19106-2003测定。
次氯酸钠溶液的pH值根据GB/T 6368测量,测量温度为25℃,溶液加蒸馏水稀释100倍后进行测量。
3 结果与讨论
3.1 次氯酸钠浓度对反应的影响

图1为次氯酸钠浓度对稳定性的影响情况。在50℃恒温条件下,次氯酸钠溶液的有效氯含量越高,分解速度越快。如次氯酸钠初始有效氯为9.02%的溶液,反应进行4天后,有效氯就降至6.28%;反应进行8 d后有效氯含量降至5.02%,变化趋势如图1中1线所示;而初始有效氯含量为5.42%的溶液,反应进行4 d后,有效氯含量降至4.89%,反应进行8 d后有效氯含量降至4.34%,分解速度比图1中1、2、3缓和,变化趋势如图1中4所示;而初始有效氯含量为2.14%的溶液,有效氯含量随时间变化却不大,如图1中的7所示。溶液初始有效氯含量相同而pH值不同时,降解程度却几乎相同。实验考查了pH值次氯酸钠溶液用水稀释100倍后从10.87至11.41时的有效氯变化情况。如图1中所示的1、2、3线几乎重合,4、5、6线几乎重合,7、8、9线几乎重合,而反应1、4、7,2、5、8和3、6、9分别有相同的pH值,但分解速率相差却非常大。
相同温度下,溶液初始有效氯含量越多,ClO-浓度越高,反应(4)的反应速率就越快。由此引发的一系列反应速率也会加大。溶液的初始pH值不同时,体系中增加[OH-]在抑制反应(4)的同时,也会加快反应(12),从宏观反应来看,起到了综合平衡的效应。pH值的变化未影响整体反应速率,图1中出现了3条线重合的情况。值得注意的是,当体系pH值接近中性时,反应(5)将不再是次要反应,此结论也不成立,为分界点的pH值有待进一步深入研究。次氯酸钠的分解宏观表现为准一级反应[8,9],浓度极低时为零级反应[11],因此,低浓度保存对体系稳定是有利的。
3.2 次氯酸钠分解过程中pH值和游离碱的变化


图2和图3分别为次氯酸钠在50℃分解过程中溶液稀释100倍后pH值和游离碱的变化曲线图。图中的1~9号样分别和图1中1~9号样对应,为同一样品。初始pH值为次氯酸钠溶液室温测得的数据。由图2可见,热反应进行4天后,所有样品的pH值都是先降低,之后基本保持不变。此现象的产生可能是由于在强碱性条件下,反应(12)中HClO的分解较反应(4)中ClO-水解更易受到温度的影响。当溶液温度升高,反应(12)增大程度比反应(4)大,因此,反应(12)中产生更多的H+与OH-发生中和反应,pH值降低。但总体而言,这种差距不是很大,4 d后所有样品的pH值平均比初始时降低0.12。且随着反应的发生,反应(12)和反应(4)很快就达到了新的平衡,pH值不再发生很大的变化。从图2中还发现一个事实,pH值的变化与有效氯的含量几乎无关。图2中所示的1、4、7,2、5、8以及3、6、9,其pH值变化趋势基本一致。这说明有效氯含量与pH值的变化无关,从宏观反应方程式(1)和(2)中也可得出此结论。
如图3所示,次氯酸钠溶液的游离碱基本不随有效氯的含量以及反应时间而变化。因此,可以认为游离态的OH-未参与整个次氯酸钠分解的反应,起到稳定体系、抑制次氯酸钠分解的作用。
3.3 温度对次氯酸钠分解的影响
温度对次氯酸钠溶液稳定度的影响研究比较多,文献[10]得出当温度超过35℃时,其分解明显加速。文献[14]研究表明,当温度低于25°C时分解缓慢,温度高于30℃时分解速度明显加快。根据Arrhenius公式ln k=-Ea/RT+lnA可知,升高温度,反应活化能降低,有利于反应进行。从碰撞理论考虑,升高温度,分子(或离子)间运动速度加快,单位时间内有效碰撞增多,分子(或离子)形成遭遇对继而转化为产物的速率加快。水解反应(4)为吸热反应,加热有利于反应的发生。此外温度升高有利于反应(12)中原子氧的放出,继而使反应(13)、(15)、(16)加快。图1所示次氯酸钠溶液在50°C条件下分解过程。考查了有效氯含量为5.4%(日用化学品消毒剂、漂白水的浓度)的次氯酸钠溶液在(80±1)℃(溶液稀释100倍)条件下的分解过程,结果见表1。其中,样品1、2、3溶液稀释100倍后的初始pH值分别为:10.82、11.13和11.42。
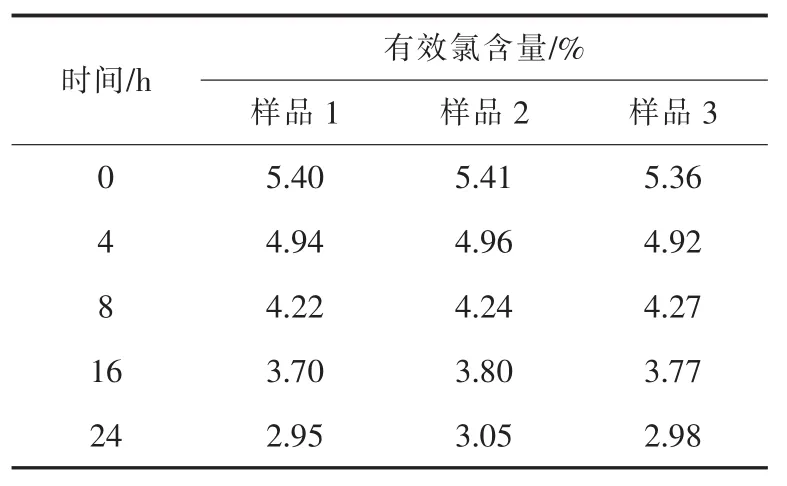
表1 (80±1)℃条件下次氯酸钠的分解
对比表1和图1可知,有效氯含量为5.4%的次氯酸钠溶液50℃分解20 d与80℃分解24 h,有效氯含量的下降程度相同。可见温度对体系的稳定影响很大(反应活化能Ea的求算略)。
3.4 Na2SiO3对次氯酸钠分解的影响
配制有效氯为(5.4±0.05)%的次氯酸钠溶液(日用化学品消毒剂、漂白水的浓度),添加不同比例的Na2SiO3、搅拌5 min保证硅酸钠完全溶解,加入片碱调节pH值。将样品放入50°C的烘箱中,考查其稳定性。结见表2:样品1~7的Na2SiO3质量分数分别为0%、0.2%、0.2%、0.6%、0.6%、1.0%、1.0%,溶液稀释100倍后pH值分别为11.42、11.16、11.36、11.21、11.40、11.22、11.43。

表2 不同Na2SiO3含量下次氯酸钠的分解
表2数据表明,强碱性条件下添加不同质量分数的Na2SiO3与未加Na2SiO3的次氯酸钠溶液的有效氯含量变化趋势基本相同,且与pH值无关,这证明单独添加Na2SiO3对溶液的稳定性无影响。从碰撞理论考虑,同温度下反应式(4)、(12)~(16)均与Na2SiO3含量无关,制约分子间有效碰撞的主要因素为ClO-的浓度。实际上在漂白水、消毒剂的工业生产中,当Na2SiO3加入量超过0.5%时,在半成品沉降罐以及管道中就会产生大量的因其水解而产生的絮状沉淀,增加了成本以及后续清理工艺的困难。因此,次氯酸钠溶液中Na2SiO3的量不宜多加,一般不要超过0.5%。
4 结论
(1)在强碱性条件下,根据碰撞理论得出次氯酸钠的分解主要是通过ClO-水解生成HClO引发的一系列反应,歧化反应是通过HClO的分解生成的[O]实现的。遭遇对的生成决定着整个的反应速率。
(2)次氯酸钠的分解在一定碱性范围内只与初始有效氯含量有关,有效氯含量越低,溶液就越稳定;当溶液稀释100倍后pH值在10.82~11.42范围内,与初始pH值无关,反应过程中溶液的pH值和游离碱也几乎不会发生变化。因此保持次氯酸钠溶液稳定不必加入过多的碱。
(3)升高温度有利于增加分子(或离子)间的有效碰撞,形成遭遇对,继而促使分解。
(4)硅酸钠的添加对次氯酸钠的稳定性无影响,只起到碱性缓冲作用、助洗作用、沉淀重金属离子以及铝锌金属缓蚀作用。
[1]C.E.NordmanandS.M.Blinder.Collision Theory of Chemical Reactions. Chem.Educ.,51,790(1974).
[2]傅献彩,沈文霞,姚天扬.物理化学.第四版.北京:高等教育出版社, 1990:758-760,786,823-832.
[3]张婉枫,胡满成.次氯酸钠溶液稳定性增强技术研究进展.榆林学院学报,2008,(4):79-82.
[4]Milton J.Rosen and Zhu Zhen Huo.The Stability of Sodium Hypochlorite in the Presence of Surfactants.JAOCS,1992,69(7):667-671.
[5]邵黎歌,陈卿.次氯酸钠的分解特性及提高其稳定性性能的途径.氯碱工业,1997,(4):21-24.
[6]李光华,曾伍华,崔凤玲.含次氯酸钠消毒洗涤剂稳定性的研究.江西化工,2003,(4):152-154.
[7]杨卫国.次氯酸钠水溶液的稳定技术.中国氯碱,2002,(11):20-21.
[8]刘少友,黄雪莉,甄卫军,等.用原子矩阵法对工业级次氯酸钠水溶液分解反应宏观动力学的研究.氯碱工业,2003(5):30-32.
[9]马德垺,苏瑜,薛仲华.次氯酸钠水溶液分解动力学的研究.上海工程技术大学学报,2002,16(1):8-10.
[10]苏瑜,罗鑫龙,马德垺,等.次氯酸钠水溶液稳定性及增稠体系研究.精细化工,2000,17(12):708-710,716
[11]平静.次氯酸钠稳定性研究.中国医院药学杂志,1995,15(10):455-456.
[12]雍丽珠,孙秀武,吴宗华.高浓度次氯酸钠水溶液的制备及其稳定性能的探讨.中国氯碱,2004(1):13-15.
[13]方贤达.氯的含氧化合物生产与应用.北京:化学工业出版社,2004.11-13.
[14]盛梅,马芬,杨文伟.次氯酸钠溶液稳定性研究.化工技术与开发,2005,34(3):8-10.
Study on stability of aqueous sodium hypochlorite solution based on the theory of collision
LIU Shi-feng,LI-Lin,LU Li-xia
(R&D Center,Guangzhou Liby Enterprise Group Co.,Ltd,Guangzhou 510170,China)
The mechanism of sodium hypochlorite solution’s decomposition was studied based on the theory of collision model.The main reaction equations of sodium hypochlorite solution’s decomposition were obtained without catalysts.Research shows that the decomposition of sodium hypochlorite are cascade of reactions that mainly triggered by the hydrolysis of ClO-which to form HClO in a strong alkaline condition. Disproportionation of sodium hypochlorite is generated by the[O]which formed from hypochlorous's decomposition.The decomposition rate of sodium hypochlorite solution is related to the initial concentration of itself,but the change of pH value and free alkali,before and after reaction,is tiny.Rising temperatures can increase effective collision,so as to improve the reaction rate.The values of stability of sodium hypochlorite solution have not outstanding differences when the dosage of sodium silicate in sodium hypochlorite solution is 0%,0.2%,0.6%or 1.0%.
collision theory;sodium hypochlorite;chlorine;stability
TQ083+.1
B
1009-1785(2011)01-0023-05
2010-08-16
