尖晶石型铁酸铜的制备及其可见光催化性能
2011-09-20傅杰沈昱程国伟邓跃强
傅杰,沈昱,程国伟,邓跃强
(大连交通大学 环境与化学工程学院,辽宁 大连 116028)*
0 引言
光催化氧化技术自20世纪80年代后期应用于环境污染控制领域以来,由于其可以有效降解许多结构稳定的有机污染物,已成为国内外重视的污染治理技术之一[1-2].目前,二氧化钛光催化剂具有无毒、稳定、催化活性高、价格合理等优点而被公认为最佳的光催化剂[3-4].然而,TiO2是宽带隙半导体,需要紫外光才能激发[5],而太阳光中的紫外光不到5%,这极大地限制了人们对太阳能的利用率.因此,寻找新型的具有可见光活性的光催化剂成为新的研究热点.纳米铁酸铜具有良好的物理和化学性质,在磁学性能、气敏性能、吸附性能和催化性能等方面均已得到研究与应用[6-7]. 由于铁酸铜的禁带宽度约为 2 eV[8],对可见光有所响应,因此本文采用水热法和共沉淀法制备了尖晶石型纳米铁酸铜,并以其为光催化剂,研究了在模拟太阳光的条件下,对目标污染物罗丹明B的光催化降解性能.
1 实验方法
1.1 主要试剂及仪器
Cu(NO3)2·3H2O,Fe(NO3)3·9H2O,聚乙烯醇 (PVA),Cu(CH3COO)2,浓氨水,罗丹明 B(RhB)(均为分析纯).EJS型电子分析天平(沈阳龙腾电子有限公司),KQ3200DB型超声振荡洗涤器(昆山市超声仪器有限公司),JB-3型定时恒温磁力搅拌器(上海雷磁新径仪器有限公司),XQ 500W可调型氙灯(上海蓝晟电子有限公司),TG16-WS台式高速离心机(长沙湘仪离心机有限公司),Quanta 200 FEG扫描电子显微镜(欧洲);Shimadzu LabX-6000 X射线衍射仪(日本),紫外可见分光光度计(uv-1100)(日本).
1.2 催化剂的制备
水热法制备CuFe2O4:实验所用药品均为分析纯,没有进一步纯化.称取1.933 g Cu(NO3)2·3H2O和6.464 g Fe(NO3)3·9H2O溶于80 mL蒸馏水中,制成0.1 mol/L Cu2+和0.2 mol/L Fe3+混合溶液,机械搅拌下混合均匀.然后将溶液放在恒温磁力搅拌器上开始搅拌,用胶头滴管缓慢逐滴滴加30% 氨水溶液,调节pH值为9~10,继续搅拌30 min.用去离子水洗涤3次,60℃干燥6 h.
共沉淀法制备CuFe2O4:0.998 2 g Cu(CH3COO)2·H2O和4.040 2 g Fe(NO3)3·9H2O溶解在100 mL蒸馏水中生成透明溶液.然后在剧烈搅拌下,逐滴加入NH3·H2O(28%)溶液,直至pH值约为9,且有粘性沉淀物产生为止.干燥的沉淀物,在80℃的水浴锅内蒸发,直到水分全部蒸发掉.最后,以10℃/min的升温速率,在850℃煅烧3 h.
1.3 光催化降解实验
将50 mL一定浓度的罗丹明B溶液加入石英烧杯中,称取50 mg铁酸铜催化剂加入其中,避光磁力搅拌30 min后,在氙灯光源照射下进行光催化反应.间隔一定时间取样3 mL,离心分离,取上清液,在分光光度计上测定吸光度A.根据朗伯—比尔定律A=εbc,当ε和b为定值,吸光度和浓度呈正比,所以可以按吸光度的大小来判断罗丹明B溶液降解的程度,也可通过R%=(A0-A)/A0计算罗丹明B的降解率,从而考察催化剂的光催化活性.
2 实验结果与讨论
2.1 催化剂的表征
2.1.1 SEM分析
如图1所示,使用扫描电子显微镜对所制备铁酸铜催化剂的表面形貌和样品尺寸进行了表征.由图1(a)可以看出,水热法所制备催化剂的微观形貌是球形,且尺寸分布均匀,球的直径是200 nm左右.而由图1(b)可以看出,共沉淀法制备的样品虽然没有规则形貌,但也是由100~200 nm的小颗粒聚集而成的.

图1 两种方法制备CuFe2O4的SEM图
2.1.2 XRD分析
图2(a)和图2(b)分别是水热法和共沉淀法所制备的纳米铁酸铜的XRD图,两种样品的各个特征衍射峰与铁酸铜标准卡片(JCPDS 25-0283)相符.其中在 30.05°,35.51°,37.23°,43.64°,57.54°和62.23°的衍射峰分别对应于铁酸铜的(220),(311),(222),(400),(511),(440)晶面,说明两种方法所制备的催化剂均为尖晶石型铁酸铜.从各个衍射峰的峰宽和峰形可以推测所制备的催化剂都为纳米级的,这与SEM的分析结果一致.另外,XRD图中少量其他衍射峰的出现,可能是因为样品制备过程中的少量杂质引起的.

图2 两种方法制备CuFe2O4的XRD图
2.1.3 DRS分析
图3是水热法和共沉淀法所制备的纳米铁酸铜的紫外-可见吸收光谱图.由图可知,两种方法所制备的催化剂在紫外和可见光区都有比较强的吸收,并且水热法所制备的催化剂有更高的吸光度.可以推测,两种催化剂在紫外和可见光区都可能有一定的光催化活性,水热法制备催化剂的光催化活性应高于共沉淀法制备的催化剂.

图3 两种方法制备CuFe2O4的DRS图
2.2 模拟太阳光照射下光催化降解RhB溶液
2.2.1 测定波长的选择
为了考察纳米铁酸铜材料的可见光催化活性,在模拟太阳光照射下,光催化降解罗丹明B溶液.测定了20 mg/L罗丹明B溶液的紫外-可见吸收光谱曲线,如图4所示.由图可知,罗丹明B的最大吸收波长为556 nm,在没有干扰组分存在的情况下,以此作为测定波长灵敏度比较高.因此,在以下的实验中,均以556 nm作为测定波长,来考察罗丹明B溶液的光催化降解情况.
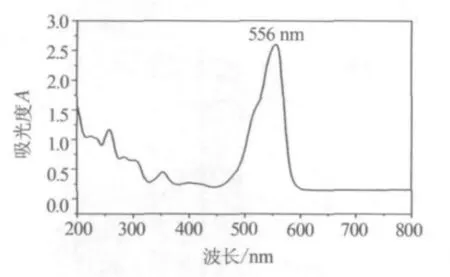
图4 20 mg/L罗丹明B溶液的紫外-可见吸收光谱曲线
2.2.2 催化剂用量的影响
首先,考察了水热法所制备催化剂的用量对20 mg/L罗丹明B溶液光催化降解的影响.由图5可知,在只有模拟太阳光照射的条件下,50 mL罗丹明B溶液在3.5 h内吸光度值几乎没有变化,说明罗丹明B的直接光解作用可以被忽略.在催化剂的用量分别为0.035,0.05和0.075 g时,罗丹明B溶液的吸光度值均有不同程度的减小.随着催化剂用量的增加,降解效果也越来越明显.催化剂用量为0.05和0.075 g的降解效果好于0.035 g,从成本和效果综合考虑,以下的实验均选用0.05 g催化剂.
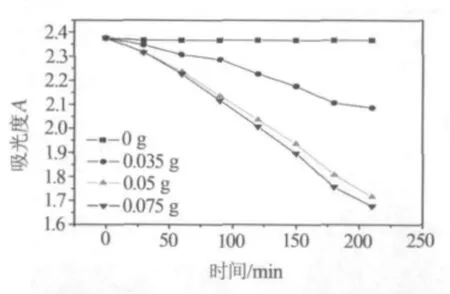
图5 不同用量催化剂降解罗丹明B溶液的吸光度随时间变化曲线
2.2.3 RhB溶液初始浓度的影响
以0.05 g水热法制备的铁酸铜为催化剂,分别对50 mL 10 mg/L和20 mg/L的罗丹明B溶液进行了光催化降解实验.由图6可知,10 mg/L罗丹明B溶液的降解率明显高于20 mg/L的罗丹明B溶液.可以推测,低浓度罗丹明B溶液的降解效果好于高浓度罗丹明B溶液.
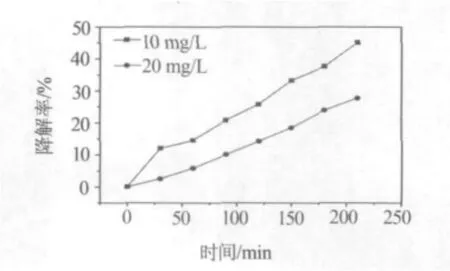
图6 不同起始浓度罗丹明B溶液的降解率随时间变化曲线
2.2.4 不同方法所制备CuFe2O4催化性能比较
分别取水热法和共沉淀法制备的催化剂0.05 g,降解20 mg/L罗丹明B溶液.由图7可知,水热法制备的铁酸铜作为催化剂时,罗丹明B溶液的降解率较高.这可能是由于水热法制备的铁酸铜为有规则形貌的纳米球,比表面积较大,可以更多地吸附污染物.另外,从前面的紫外-可见吸收光谱的表征结果也说明水热法制备的铁酸铜具有更高的光催化活性.
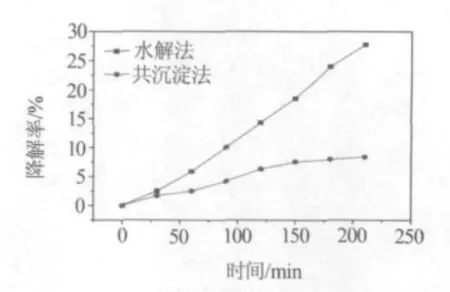
图7 不同制备方法制备的催化剂对罗丹明B溶液的降解率随时间变化曲线
2.2.5 H2O2的加入对降解效果的影响
研究表明[9-10],H2O2可以提供羟基自由基,它是光催化降解的活性物种,因此我们考察了H2O2的加入对罗丹明B降解效果的影响.由图8可知,虽然H2O2对罗丹明B溶液有很强的降解作用,但催化剂和H2O2协同作用的效果好于单独使用催化剂和H2O2.以0.05 g水热法制备的铁酸铜为催化剂,加入0.1 mL H2O2,降解50 mL 20 mg/L罗丹明B溶液,120 min后降解率能够达到96%以上.

图8 H2O2加入前后罗丹明B溶液的降解率随时间变化曲线
3 结论
(1)共沉淀法制备的铁酸铜颗粒较大,水热法制备的铁酸铜是直径在200 nm左右的球形颗粒.两种方法制备的催化剂均为尖晶石型铁酸铜.两种方法制备的铁酸铜在紫外-可见光区均有不同程度的吸收,具有可见光响应性;
(2)催化剂的适宜用量为 0.05 g,低浓度RhB溶液的降解效果较好,水热法制备的铁酸铜的光催化活性高于共沉淀法制备的催化剂,少量H2O2的加入有助于提高 RhB溶液的降解率.0.05 g水热法制备的铁酸铜催化剂,加0.1 mL H2O2,降解50 mL 20 mg/L罗丹明 B溶液,120 min后降解率能够达到96%以上.
[1]TANG JUN WANG,ZOU ZHI GANG,YE JIN HUA.Effcient photocatalytic decomposition of organic contaminants on CaBi2O4under visible light irradiation[J].Angew.Chem.Int.Ed,2004,43:4463-4466.
[2]FU XIAN ZHI,WALTER A ZELTNER,MARC A ANDERSON.The gas-phase photocatalytic mineralization of benzene on porous titania-based catalysts[J].Appl.Catal.B:Environ,1995(6):209-224.
[3]FUJISHIMA AKIRA,RAO TATA N,TRYK DONALD A.Titanium dioxide photocatalysis[J].J.Photochem.Photobiol.C,2000(1):1-21.
[4]CHEN XIAO BO,MAO SAMUEL S.Titanium dioxide nanomaterials:Synthesis,properties,modifications,and applications[J].Chem.Rev.,2007,107:2891-2959.
[5]BERGER T,STERRERm,DIWALD O,et al.Light-Induced Charge Separation in Anatase TiO2Particles[J].J.Phys.Chem.B,2005,109:6061-6068.
[6]GOMES JULIANO DE A,SOUSA MARCELO A,TOURINHO FRANCISCO A,et al.Synthesis of Core-Shell Ferrite Nanoparticles for Ferrofluids:Chemical and Magnetic Analysis[J].J.Phys.Chem.C,2008,112:6220-6227.
[7]YANG HAI HUA,YAN JIANHUI,LU ZHOU GUANG,et al.Photocatalytic activity evaluation of tetragonal CuFe2O4nanoparticles for the H2evolution under visible light irradiation[J].J.Alloys Compd.,2009,476:715-719.
[8]LALANNEm,BARNABE A,MATHIEU F,et al.Synthesis and thermostructural studies of a CuFe1-xCrxO2delafossite solid solution with 0 ≤ x≤ 1[J].Inorg.Chem.,2009,48:6065-6071.
[9] KIM SOONHYUN, PARKHYUNWOONG, CHOI WONYONG.Comparative study of homogeneous and heterogeneous photocatalytic redox reactions:PW12O403-vs TiO2[J].J.Phys.Chem.B,2004,108:6402-6411.
[10] WATTSRICHARDJ, WASHINGTONDIANA,HOWSAWKENG JIMMY.Comparative toxicity of hydrogen peroxide,hydroxyl radicals,and superoxide anion to Escherichia coli[J].Adv.Environ.Res.,2003(7):961-968.
