在非小细胞肺癌患者中甲状旁腺激素相关蛋白PTHrP的表达及其临床意义
2011-09-20龚丽明黄云超李鸿钧欧霞王东坤
龚丽明 黄云超 李鸿钧 欧霞 王东坤
1.昆明医学院第四附属医院,云南省第二人民医院心胸外科,云南 昆明 650021;2.昆明医学院第三附属医院胸心血管外科,云南 昆明 650118;3.中国医学科学院北京协和医学院医学生物研究所,云南 昆明 650118
肺癌是一常见恶性肿瘤,占癌症相关死亡原因的首位,在环境污染及吸烟等易发因素影响下,其发病率呈上升趋势,病理学确诊的病例中以非小细胞肺癌(non-small cell lung cancer,NSCLC)的发病率最高。尽管吸烟都是引起男、女性患者发生肺癌的最主要原因,但是在临床病理特点及生存率方面男、女性患者之间仍有不同,无论处于哪一期的女性患者,其预后往往比男性患者好[1]。因此探讨肺癌发病机理、发展过程及临床预后与性别的关系十分必要。大约2/3的NSCLC表达甲状旁腺激素相关蛋白(parathyroid hormone-related protein,PTHrP),该蛋白在结构上与甲状旁腺激素(parathyroid hormone,PTH)相似,可导致恶性肿瘤高钙血症,还可改变癌细胞的增殖率、调节凋亡倾向并阻止肿瘤血管生成[2]。PTHrP的水平与性别及性激素的状态相关[3],有文献报道女性肺癌患者PTHrP的水平较男性肺癌患者PTHrP的水平高,但仍缺乏PTHrP与患者生存率关系的研究。本实验用免疫组织化学方法检测125例NSCLC肿瘤组织、癌旁组织及远端正常组织中PTHrP的表达,分析其与患者性别、组织分化程度、临床分期及预后的相关性,探讨在NSCLC患者中PTHrP的表达和女性患者生存期的关系。
1 资料和方法
1.1 临床资料
125 例NSCLC肿瘤组织、癌旁组织及远端正常肺组织来自昆明医学院第四附属医院和昆明医学院第三附属医院心胸外科2007年1月—2011年1月间手术切除标本,所取标本用10%甲醛固定后送病理科做组织蜡块,男性73例,女性52例,年龄35~75岁,平均年龄54.5岁,中位年龄52岁。所有患者均行肺癌根治术,术前未经化疗或放疗且经过组织病理学诊断证实。按照WHO/IASLC肺上皮肿瘤组织学分类标准(1999年)进行组织学分类:鳞癌48例,腺癌65例,腺鳞癌12例;高分化癌20例,中分化癌66例,低分化癌39例。按国际抗癌联盟(UICC,2009年第7版)TNM分期:Ⅰ期18例,Ⅱ期57例,Ⅲ期36例,Ⅳ期14例。随访时间从术后第1天至2011年1月16日。
1.2 试剂
抗PTHrP鼠抗人单克隆抗体(3D1.1)和UltraSensitiveTMSP试剂盒(KIT-9720)均由福州迈新生物技术开发有限公司提供。
1.3 方法
标本经10%甲醛固定,常规脱水包埋,做4 μm厚连续切片,分别进行HE染色和免疫组织化学染色(SP法)。以EDTA抗原修复液直接煮沸抗原修复法修复组织抗原,已知阳性片作为阳性对照,PBS代替一抗作为阴性对照。
1.4 结果判定
PTHrP蛋白以细胞质染色呈棕黄色颗粒为阳性反应细胞。高倍镜下(×400)每张切片计数200个细胞,根据阳性反应细胞所占百分比将结果分为:阴性(-)为0~<10%;阳性(+)为10%~50%;强阳性(++)为>50%。
1.5 统计学处理
用χ2检验、Fisher精确概率法和秩和检验比较组间差异,用Kaplan-Meier曲线和Log-rank检验进行生存分析,Cox比例风险回归进行多变量生存分析。所有数据均采用SPSS 17.5统计软件分析,P<0.05为差异有统计学意义。
2 结 果
2.1 PTHrP在NSCLC肿瘤组织、癌旁组织、远端正常肺组织中的表达
PTHrP在肺癌组织中阳性表达50例,强阳性表达32例,阳性率为65.6%;在癌旁组织中阳性表达19例,强阳性表达11例,阳性率为24.0%;在正常组织中阳性表达10例,强阳性表达11例,阳性率为16.8%。其中在癌旁组织及远端正常肺组织中的表达多呈阴性,在癌组织中的表达显著强于癌旁组织及远端正常肺组织,3组间比较差异有统计学意义(H=70.130,P<0.001,图1,表1)。

表1 PTHrP在NSCLC肿瘤组织、癌旁组织及远端正常肺组织中的表达Tab.1 Expression of PTHrP in NSCLC cancer tissues, noncancerous adjacent lung tissues and normal lung tissues
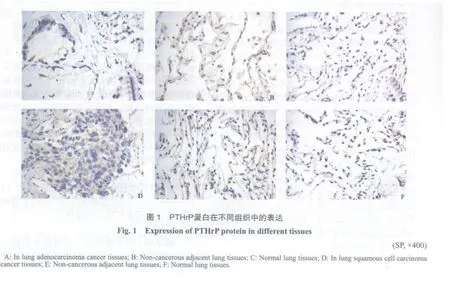
PTHrP在NSCLC肿瘤组织的阳性表达率为65.6%,其中在腺癌、鳞癌及腺鳞癌中的阳性表达率分别为:70.8%、64.6%和41.7%,腺癌的阳性表达率较高,但组间比较差异无统计学意义(H=2.049, P=0.359);PTHrP在癌旁组织中的阳性表达率是24.0%;在远端正常肺组织中的阳性表达率是16.8%。三者间两两比较,肿瘤组织与癌旁组织的PTHrP阳性表达率差异有统计学意义(P<0.001);肿瘤组织与远端正常肺组织的PTHrP阳性表达率差异有统计学意义(P<0.001);癌旁组织与远端正常肺组织的PTHrP阳性表达率差异无统计学意义(P=0.201)。三者比较PTHrP阳性表达率差异有统计学意义(P<0.001),其中在NSCLC肿瘤组织的阳性表达率最高。
2.2 在NSCLC组织中PTHrP的表达与患者各种临床病理因素的关系
92例65 岁以下患者中PTHrP阳性表达63例(68.5%);33例65岁以上患者中PTHrP阳性表达19例(57.6%),两组间PTHrP的表达差异无统计学意义(P=0.258)。根据不同分期分组,PTHrP的表达差异无统计学意义(P=0.732)。腺癌组、鳞癌组及腺鳞癌组间比较,PTHrP的表达差异无统计学意义(P=0.147)。吸烟者与不吸烟者组间比较,PTHrP的表达差异无统计学意义(P=0.692)。男性与女性组间比较,PTHrP的表达差异有统计学意义(P=0.001)。说明PTHrP的表达与年龄、临床分期、组织学分型和吸烟史无关,但与性别相关,女性患者中PTHrP的表达较男性患者中PTHrP的表达高(表2)。
2.3 PTHrP在NSCLC组织中的表达与患者性别的关系
如表3所示,在女性患者和男性患者中,PTHrP的表达差异有统计学意义(P=0.001),其中女性患者的表达最高(82.7%);Ⅰ期患者不同性别的PTHrP表达差异有统计学意义(P=0.023),其中女性患者的表达最高(100%),Ⅱ期患者不同性别的表达差异无统计学意义(P=0.091),Ⅲ和Ⅳ期患者不同性别的表达差异无统计学意义(P=0.059);腺癌组不同性别的PTHrP表达差异无统计学意义(P=0.056),鳞癌组不同性别的表达差异有统计学意义(P=0.035),腺鳞癌组不同性别的表达差异无统计学意义(P=0.092);吸烟组不同性别的PTHrP表达差异无统计学意义(P=0.202),不吸烟组不同性别的表达差异有统计学意义(P=0.001)。女性不吸烟者的阳性表达较高(80.9%)。
在所有患者、女性患者和男性患者中,PTHrP的表达在临床Ⅰ~Ⅳ期中差异无统计学意义(P>0.05);在腺癌、鳞癌和腺鳞癌组中的表达差异无统计学意义(P>0.05);在吸烟组和不吸烟组中的表达差异无统计学意义(P>0.05)。

表2 PTHrP表达与NSCLC患者临床病理特征的关系Tab.2 The relationship between expression of PTHrP protein and NSCLC clinicopathologic factors
2.4 PTHrP在NSCLC组织中的表达与患者生存率的关系
Kaplan-Meier生存曲线显示:在女性患者中PTHrP的表达与生存率相关(P<0.001),但是在男性患者中PTHrP的表达与生存率无关(图2)。
在多变量分析中,有关吸烟史和PTHrP的表达情况均与患者的生存率相关。女性患者中,不管其是否吸烟,PTHrP表达阳性者较PTHrP表达阴性者有较长的生存期(P<0.05);而男性患者中,从不吸烟者较少,其PTHrP的表达与生存率无关,吸烟者PTHrP的表达与生存率无关(图3)。
3 讨 论
PTHrP与PTH氨基端部分相似,有部分相似的功能,是一种分泌蛋白,可通过减少肾脏的钙分泌、增加骨的钙释放而产生高钙血症[4]。该蛋白在胎儿肺、成人肺和肺癌中都有表达,在胎肺的发育、正常肺的生理、肺
损伤及肺癌的病理生理方面均有作用[5]。最早在BEN肺鳞癌细胞中发现PTHrP,在55%~95%的肺癌细胞株和人类肺肿瘤中表达,约2/3的NSCLC患者表达PTHrP[6]。人类PTHrP基因位于12q29染色体,包含15个以上碱基、7个外显子、6个内含子、3个独立的驱动子和多个3’非编码区域,而PTH位于11q39染色体,包含3个外显子,通常认为这两个染色体在进化方面有相关性,有一个共同的外显区编码前序列[7-8]。PTHrP通过影响细胞生长周期而改变癌细胞的增殖率、调节凋亡倾向、调节integrin的大小和基质金属蛋白酶的表达并阻止肿瘤血管生成,这种对肺癌细胞生长的影响能够调节肿瘤的进展、改变肿瘤的侵袭或转移[9-11]、改变肿瘤对治疗的敏感并在不同方面影响肿瘤的病理发生,从而可影响肺癌患者的生存率[12-13]。
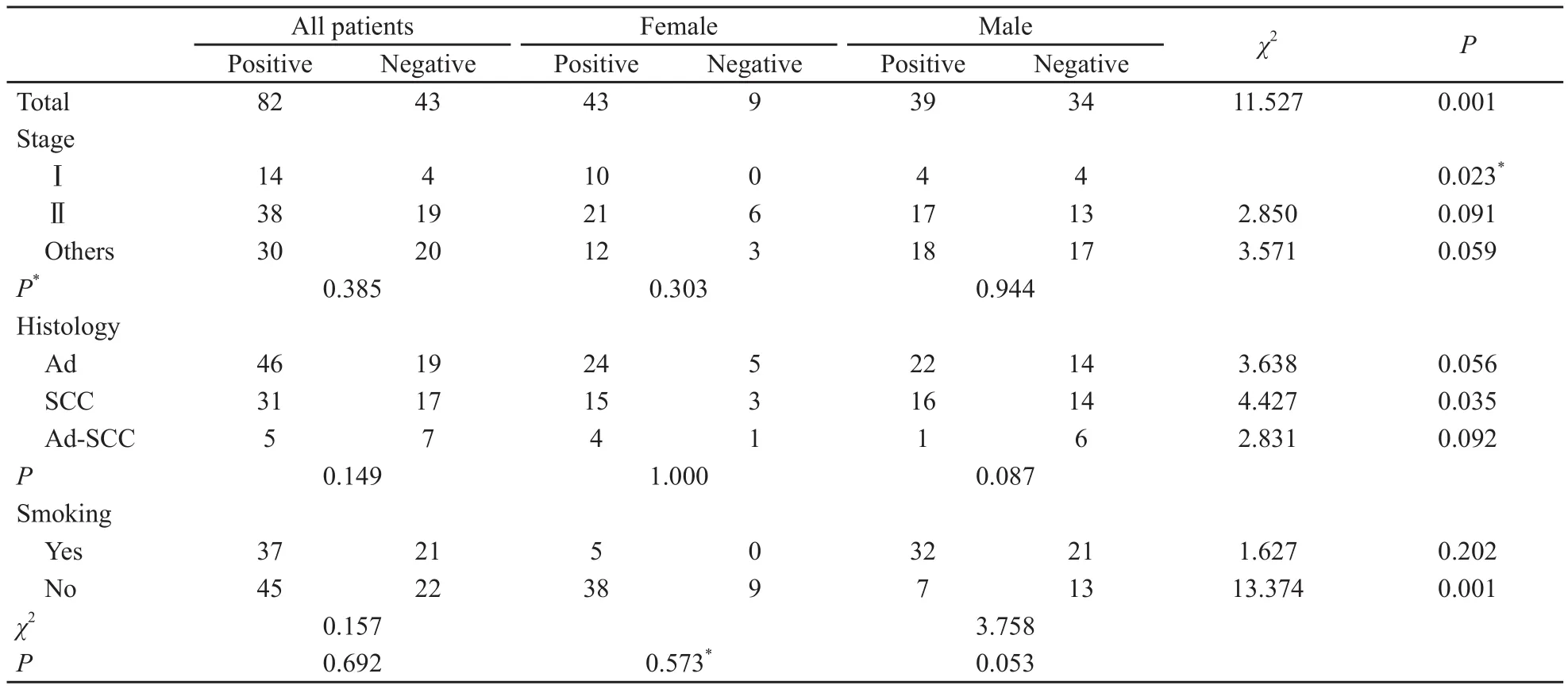
表3 PTHrP表达与NSCLC患者性别的关系Tab.3 Demographic and lung cancer data by gender and PTHrP protein expression in NSCLC

图2 不同性别NSCLC患者PTHrP的表达与其生存率的关系Fig.2 Kaplan-Meier survival curves for female and male patients with NSCLC as a function of tumor PTHrP A: Female; B: Male.
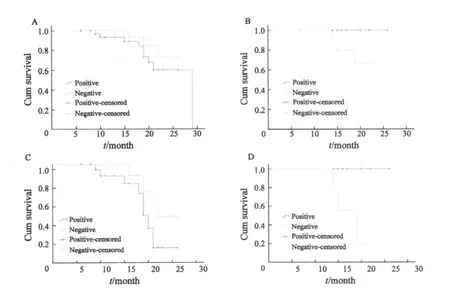
图3 NSCLC患者的吸烟史、PTHrP的表达与其生存率的关系Fig.3 Survival curves for non-smokers versus smokers
大量的研究工作已经评价了PTHrP在肺癌中导致高钙血症的作用,但揭示其在肺癌的进展或生存预后方面的工作还很少,尤其是探讨PTHrP的表达和女性肺癌患者生存优势之间关系的工作更少。近期国外的一些研究提示在肺癌中PTHrP的表达是一个有益的预后因子,女性肺癌患者PTHrP的水平较男性肺癌患者PTHrP的水平高[3,9-10]。Hastings等[10]观察两株正常情况下PTHrP表达阴性的肺腺癌细胞株,转染PTHrP后肺癌细胞的DNA合成受抑制,降低了肺癌细胞的增殖率,通过对细胞周期和分裂的影响减慢了肺癌细胞的生长。Yamada等[14]和Bhatia等[15]分别用抗PTHrP抗体治疗肿瘤患者,均降低了骨转移的发生率,增加了肿瘤细胞的凋亡。本实验用免疫组织化学方法检测NSCLC肿瘤组织、癌旁组织及远端正常肺组织中PTHrP的表达,分析其与患者临床病理因素的相关性,比较阳性及阴性患者的生存率。研究发现约2/3的NSCLC中存在PTHrP的免疫反应,PTHrP在肺癌组织中的表达显著高于在非癌肺组织中的表达,在女性患者中肿瘤PTHrP的表达(82.7%)高于男性患者(53.4%)。PTHrP阳性更倾向于腺癌患者,但差异无统计学意义(P=0.056)。在PTHrP阳性和PTHrP阴性的患者间,其临床分期、组织学、吸烟史和年龄之间差异无统计学意义(P>0.05)。生存率按患者性别分析有较大差异,男性患者中PTHrP阳性者的中位生存时间是27.14个月,PTHrP阴性者的中位生存时间是25.00个月,差异无统计学意义(P>0.05),说明男性患者的生存率与PTHrP状态无关;女性患者中PTHrP阳性的中位生存时间是38.62个月,PTHrP阴性者中位生存时间是20.00个月,差异有统计学意义(P<0.05)。用有吸烟史的所有女性患者的数据绘制的生存曲线显示了一种倾向:PTHrP 阳性者有较长的生存期。男性吸烟患者的生存曲线不受PTHrP状态的影响。研究结果提示:在NSCLC患者中,女性PTHrP的表达率较男性高;PTHrP阳性的女性患者比男性患者有较长的生存期;PTHrP阳性的女性患者生存期较PTHrP阴性的女性患者长。从而提示PTHrP的表达可以作为女性NSCLC患者生存优势的一个有意义的预测指标,但PTHrP是否为影响NSCLC患者预后的独立因子还需要下一步的研究结果来确定。
[1] MONTGRAIN P R, DEFTOS L J, ARENBERG D, et al.Prognostic implications of parathyroid hormone-related protein in males and females with non-small cell lung cancer[J].Clin Lung Cancer, 2011, 12(3): 197-205.
[2] MONTGRAIN P R, QUINTANA R, RASCON Y, et al.Parathyroid hormone-related protein varies with sex and androgen status in non-small cell lung cancer[J].Cancer,2007, 110(6): 1313-1320.
[3] HASTINGS R H, LAUX A P, CASILLAS A, et al.Sexspecific survival advantage with parathyroid hormone related protein in non-small cell lung carcinoma patients[J].Clin Cancer Res, 2006, 12(2): 499-506.
[4] HIRAKI A, UEOKA H, BESSHO A, et al.Parathyroid hormone-related protein measured at the time of first visit is an indicator of bone metastases and survival in lung carcinoma patients with hypercalcemia[J].Cancer, 2002, 95(8): 1706-1713.
[5] RANDOLPH H, HASTINGS R H.Parathyroid hormonerelated protein and lung biology[J].Respir Physiol Neurobiol, 2004, 142(2-3): 95-113.
[6] MONEGO G, LAURIOLA L, RAMELLA S, et al.Parathyroid hormone-related peptide and parathyroid hormonerelated peptide receptor type Ⅰ expression in human lung adenocarcinoma[J].Chest, 2010, 137(4): 898-908.
[7] SOURBIER C, MASSFELDER T.Parathyroid hormonerelated protein in human renal cell carcinoma[J].Cancer Lett, 2006, 240(2): 170-182.
[8] NISHIGAKI Y, OHSAKI Y, TOYOSHIMA E, et al.Increased serum and urinary levels of a parathyroid hormone-related protein cooh terminus in non-small cell lung cancer patients[J].Clin Cancer Res,1999(5):1473-1487.
[9] HASTINGS R H, BURTON D W, NEFZI A, et al.Combinatorial library discovery of small molecule inhibitors of lung cancer proliferation and parathyroid hormone-related protein expression[J].Cancer Biol Ther, 2010, 10(10):1067-1075.
[10] HASTINGS R H, MONTGRAIN P R, QUINTATA R,et al.Cell cycle actions of parathyroid hormone-related protein in non-small cell lung carcinoma[J].Am J Physiol Lung Cell Mol Physiol, 2009, 297(4): 578-585.
[11] BAKRE M M, ZHU Y, YIN H, et al.Parathyroid hormonerelated peptide is a naturally occurring, protein kinase A-dependent angiogenesis inhibitor[J].Nat Med, 2002, 8:995-1003.
[12] HASTINGS R H, ARAIZA F, BURTON D W, et al.Role of parathyroid hormone-related protein in lung cancer cell survival [J].Chest, 2004, 125(5 Suppl): 150-151.
[13] FLEMINGl N I, TRIVETT M K, GEORGE J, et al.Parathyroid hormone-related protein protects against mammary tumor emergence and is associated with monocyte infiltration in ductal carcinoma in situ[J].Cancer Res, 2009, 69(18):7473-7479.
[14] YAMADA T, MUGURUMA H, YANO S, et al.Intensification therapy with anti-parathyroid hormonerelated protein antibody plus zoledronic acid for bone metastases of small cell lung cancer cells in severe combined immunodeficient mice[J].Mol Cancer Ther, 2009, 8(1):119-126.
[15] BHATIA V, SAINI M K, FALZON M.Nuclear PTHrP targeting regulates PTHrP secretion and enhances LoVo cell growth and survival[J].Regul Pept, 2009, 158: 149-155.
