甘草次酸在Caco-2细胞模型中的转运机制1)
2011-09-18王筱萌祖元刚付玉杰
王筱萌 祖元刚 王 微 付玉杰 张 琳
(森林植物生态学教育部重点实验室(东北林业大学),哈尔滨,150040)
传统中药用药大多数为口服,药物分子进入血液循环、到达靶器官、达到药效程度、产生生物学效应,其中足够量的药物分子从胃肠道吸收是一个关键的环节。因此,在口服创新药物或者先导化合物、中药有效成分和有毒成分研究过程中,其肠吸收研究显得非常的重要[1-3]。目前,用于药物吸收的实验方法包括体内和体外两部分。尽管体内实验能更好地反映给药后药物的吸收过程,但很难从细胞或分子水平研究药物的吸收机制,而且由于动物有个体差异,建立生物样本中药物的分析方法难度大。另外,整体动物吸收代谢的耗药量大,周期较长,不适合药物开发早期的快速筛选过程。而体外实验能提供较为直观的药物吸收过程的证据,因此被广泛采用。目前,体外实验的方法主要有:在体肠灌流法、肠襻法、分离肠黏膜法、翻转肠法等[4]。然而,这些方法存在着动物组织与人体组织的差异性。从20世纪80年代起,国外开始应用一种人结肠癌细胞(The Human Colon Carcinoma Cell Line,简称Caco-2细胞)体外培养模型进行药物的吸收研究。Caco-2细胞可在体外培养条件下自发形成上皮样分化且可形成紧密连接,分化出绒毛面(apical side,AP端,顶端)和基底面(basolateral side,BL端,底端),能够表达刷状缘酶、某些细胞色素药物代谢酶和异构酶,诸如谷胱甘肽S转移酶和磺基转移酶等药物代谢Ⅱ相酶。包括氨基酸、二肽、维生素、细胞抑制剂在内的许多转运系统也在Caco-2细胞发现。Borchardt等[5]最早提出Caco-2细胞模型可用于研究药物分子经小肠上皮吸收的过程。Rubas等[6]比较了一系列具有低渗透率的药物在Caco-2细胞模型和人体小肠的吸收,结果表明:细胞培养模型能很好地模拟肠道组织。因此,Caco-2模型被广泛应用于药物研究与开发中,在药物开发早期对药物或者先导化合物的肠道吸收性质所作出的科学评价,大大推动了制药业创新药物开发的速度。在之前的研究中曾经报道了小檗碱、喜树碱、9-硝基喜树碱、紫杉醇等[7-8]在 Caco-2 细胞单层模型的转运,预测其肠吸收,实验结果表明:Caco-2细胞单层的体外过程与药物口服后在肠中的吸收和代谢有良好的相关性。
甘草次酸(Glycyrrhizic acid)是甘草的主要活性成分之一,具有抗过敏、抗炎、抗溃疡、抗病毒和保肝、解毒等功效。由于甘草次酸有大多数肾上腺皮质激素的药理作用,无其他严重不良反应,被广泛用于治疗各种急慢性肝病。但长期大量使用甘草次酸或甘草制剂,可引起浮肿、钠水潴留[9]。甘草次酸在临床中常被用于静脉注射,口服给药报道很少。本实验采用体外给药的方法研究甘草酸的口服生物利用度。本文利用Caco-2单层模型对甘草次酸进行体外转运的初步研究,预测甘草次酸在体内的吸收机制,并且研究了P-糖蛋白抑制剂对甘草次酸吸收的影响。
1 材料与方法
Caco-2细胞,购于中国医学科学院肿瘤细胞库;甘草次酸(实验室自制),MEM培养基(含谷氨酰胺、核糖核苷、脱氧核糖核苷,不含碳酸钠,美国Hyclone公司)。
细胞培养[10-12]:将 Caco-2 细胞置于常规培养瓶内,以MEM为培养基(含10%胎牛血清,1%非必需氨基酸,1%青霉素-链霉素双抗液),在温度为37℃、体积分数为5%CO2和相对湿度90%的培养箱内培养,培养基隔天更换,4~5 d达到融合。当细胞长至覆盖瓶底80% ~90%时,用含0.25%EDTA的胰酶消化,并以每1 mL 2.5×105个接种于Transwell聚碳酸酯膜六孔板中。在Transwell六孔板AP一侧每孔加1.5 mL培养液,BL一侧每孔加入2.5 mL培养液,第一个星期每天更换培养液,第8天只更换顶部培养液,8 d后每天更换顶部培养液,隔天更换底部培养液,至21 d。
跨膜电阻的测定:首先测量出没有接种细胞之前聚碳酸脂膜的空白电阻,在计算接种细胞的TEER值时扣除空白电阻值。于接种细胞 3、5、7、9、11、13、15、17、19、21 d 测定接种细胞的电阻值,当细胞电阻值大于300 Ω·cm-2时,说明单层细胞膜趋于完整,可用于转运实验。
甘草次酸双向转运实验:配制甘草次酸母液浓度2000 μmol·L-1,将Transwell六孔板的上层培养液吸出,加入含有一定药物浓度的HBSS 1.5 mL,下层加入不含药物的HBSS 2.5 mL。①在0 h时按照图1加药(从药物母液中吸取,上层加药)。在 0.5、1.0、1.5、2.0、2.5、3.0 h,分别于下层中取出缓冲液200 μL至2 mL离心管中,取药后立刻补充相同体积的HBSS。3.0 h后更换新的HBSS缓冲液,重复3次。②在0 h时按照图2加药(从药物母液中吸取,下层加药)。在0.5、1.0、1.5、2.0、2.5、3.0 h,分别于上层中取出缓冲液200 μL 至2 mL离心管中,取药后立刻补充相同体积的HBSS。3.0 h后更换新的HBSS缓冲液,重复3次。
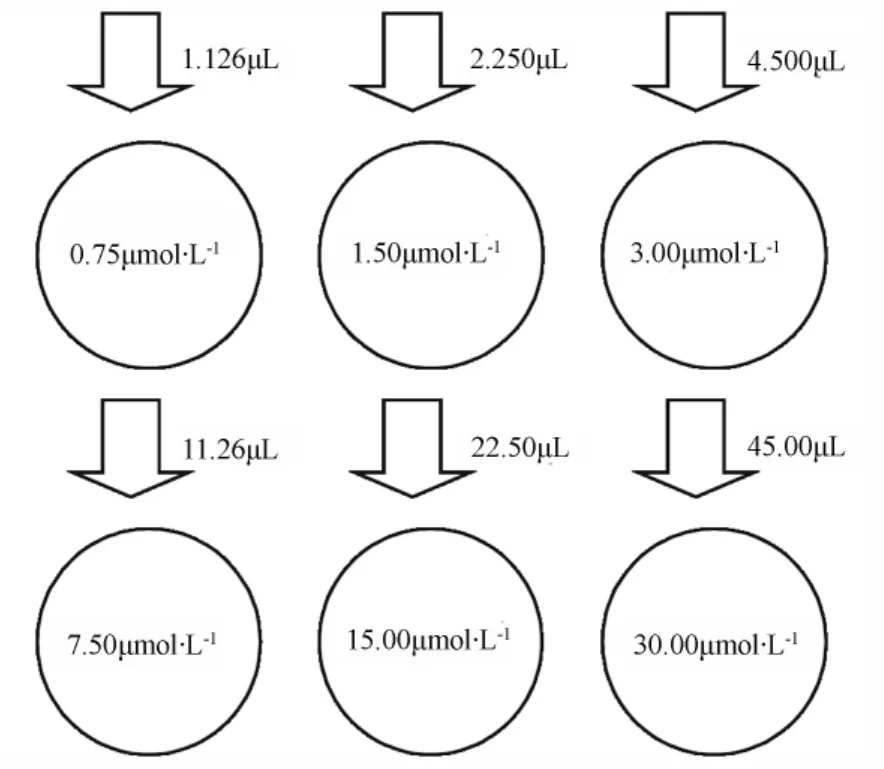
图1 Transwell六孔板上层加入甘草次酸
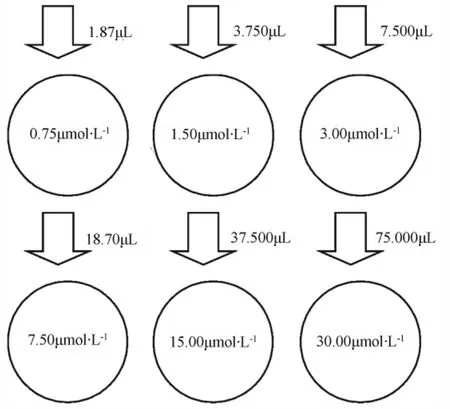
图2 Transwell六孔板下层加入甘草次酸
抑制剂对甘草次酸转运实验:在Transwell六孔板AP侧孔1、2、3 加入 11.25 μL 浓度为 15 μmol·L-1的甘草次酸,BL侧孔 4、5、6 加入 18.75 μL 浓度为 15 μmol·L-1的甘草次酸。在BL侧,如图3方法加入抑制剂,其中A为25 μmol·L-1汉防己甲素,B为50 μmol·L-1维拉帕米。取样方法及步骤同“甘草次酸双向转运实验”。其中:孔1、2、3为AP→BL侧转运,孔4、5、6 为 BL→AP 侧转运。
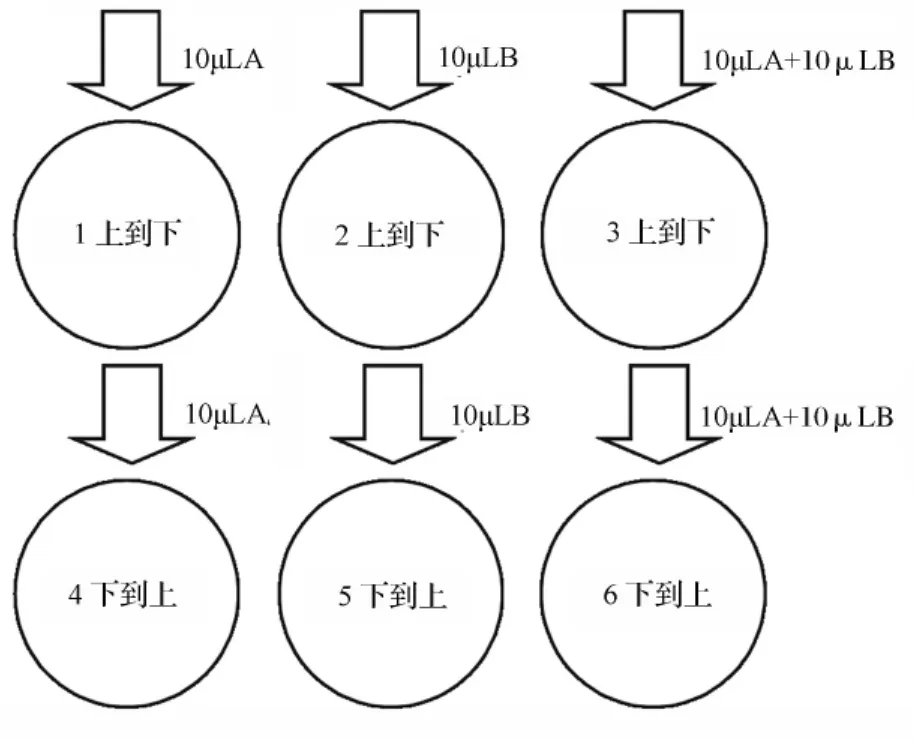
图3 加入抑制剂维拉帕米和汉防己甲素
HPLC-MS/MS 分析:色谱条件——色谱柱(150 mm×4.6 mm×5 μm)为 Agilent Eclipse XDB-C18,流动相为 V(甲醇)∶V(水)(含0.1%甲酸)=90 ∶10,流速为1 mL·min-1,柱温为300℃,保留时间为8 min。
样品处理:取200 μL样品于2 mL离心管中,加入800 μL乙酸乙酯涡旋震荡3 min;震荡后3000 r·min-1离心5 min取上清液,移至新的2 mL离心管中;再向下层加入800 μL乙酸乙酯震荡3 min,离心5 min取上清;混合2次上清液,氮气环境挥干。残渣用200 μL流动相溶解,震荡3 min;12000 r·min-1离心 5 min,取上清液。
数据处理:表观渗透系数Papp代表药物转运能力的大小。其公式为:Papp=(dQ/dt)/A×C0。式中:dQ/dt为接受药物侧待测药物出现的速率,即渗透速率(单位为mmol·s-1);A为单细胞层表面积(4.2 cm2);C0为给药测初始药物浓度(单位为mmol·cm-3);Q(单位为mmol)为任何一点的累积转运量=被测样品在接受侧的量+先前所有时间点取样总量。
外排率(EfR)=P(appBL→AP)/P(appAP→BL),代表药物净外排能力的大小,同时也可以预测外排作用引起的药物口服吸收减弱的程度。P(appBL→AP)为分泌表观通透系数,P(appAP→BL)为吸收表观通透系数。
2 结果与分析
2.1 Caco-2细胞完整性检查结果
形态学检查可观察到完整的单层上皮细胞,细胞表面覆盖一层刷状缘绒毛,垂直于细胞表面,并且细胞具有不对称性,细胞间连接紧密。这些形态均与小肠上皮细胞极为相似。TEER值>500 Ω,细胞融合成连续的单细胞层。[1-3H]甘露醇放射性活度为1.25 ~1.37 Bq,可以认为无甘露醇泄露[13]。结果表明:Caco-2细胞膜具有良好的完整性,可用于药物转运实验。
2.2 甘草次酸浓度与转运时间对转运量的影响
应用Caco-2细胞模型,对6个浓度(0.75、1.50、3.00、7.50、15.00、30.00 μmol·L-1)的甘草次酸分别考察了从 AP侧→BL侧和BL侧→AP侧的跨细胞转运特征。在同一时间点,6个浓度的转运量随浓度和转运时间的变化而增大,并呈非线性饱和状态(见图4~图6)。
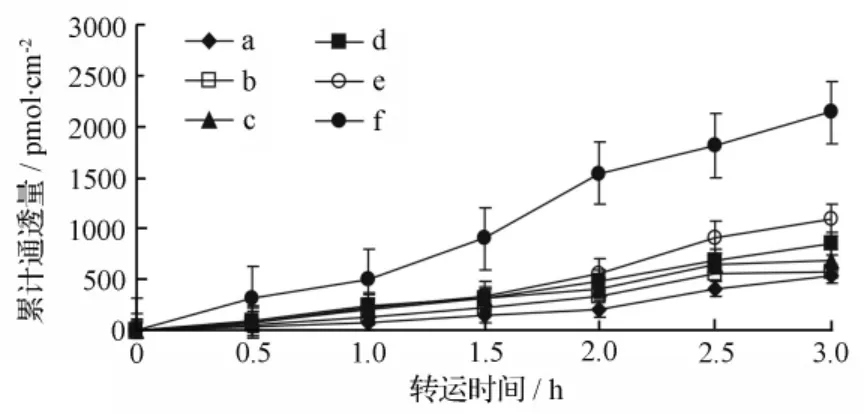
图4 甘草次酸(GA)随转运时间的累积通透量(AP侧→BL侧)
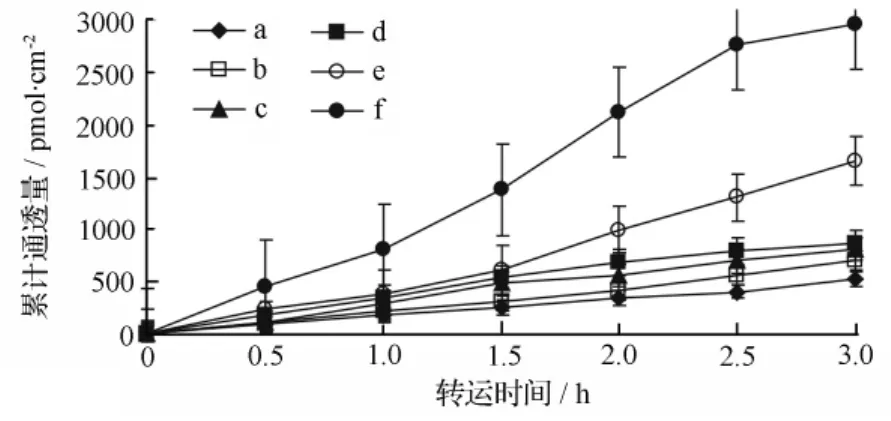
图5 甘草次酸(GA)随转运时间的累积通透量(BL侧→AP侧)
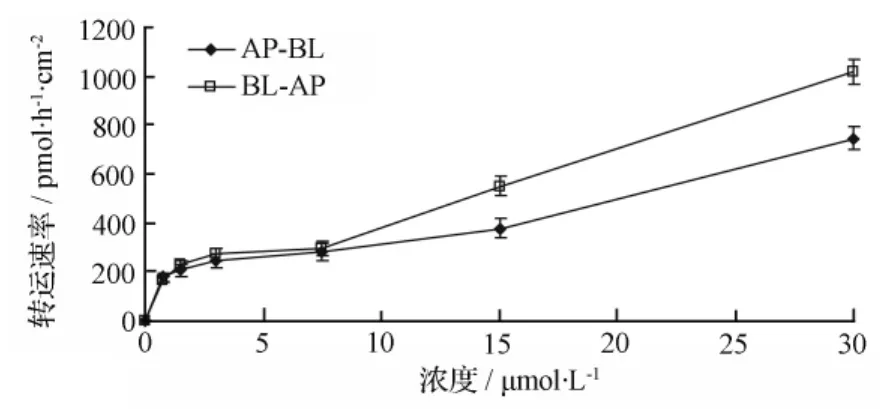
图6 甘草次酸(GA)在Caco-2单细胞层中浓度和流量的关系
2.3 甘草次酸在Caco-2模型中的转运
在Caco-2细胞模型中,药物分子的渗透系数Papp与口服吸收相关联,Papp的大小直接反应了药物经肠道吸收的能力。吸收良好药物的Papp大于10-6cm·s-1,吸收较好药物的Papp为(0.1 ~1)×10-6cm·s-1,而吸收差的药物的 Papp小于 10-7cm·s-1[14]。若在整个浓度范围内测得的 Papp值保持恒定,则认为被动扩散为主要转运机制。Papp值可由AP→BL方向测得(Papp1),也可由BL→AP方向测得(Papp2)。若Papp1与Papp2相同,也可认为被动扩散为主要转运机制;若Papp2/Papp1>1.5,则可能存在主动转运机制[15]。
在甘草次酸转运过程中,BL→AP侧的转运的表观渗透系数 Papp由(17.1±4.2)×10-6cm·s-1变化到(54.3±6.3)×10-6cm·s-1;而AP→BL侧的转运的表观渗透系数 Papp维持在(15.6±3.4)×10-6cm·s-1。实验结果表明:甘草次酸的Papp大于10-6cm·s-1。所以甘草次酸口服吸收良好,甘草次酸双侧转运流出率EfR=P(appBL→AP)/P(appAP→BL)=1.37<1.5,则说明甘草次酸经小肠上皮吸收主要为被动扩散。
2.4 抑制剂对甘草次酸转运实验的影响
加入抑制剂维拉帕米后,甘草次酸从BL到AP侧流出量由 16×10-6cm·s-1变化为 9.2×10-6cm·s-1,减少了 50% 左右;从 AP 到 BL 的流量从 12.9×10-6cm·s-1变化为 25.9×10-6cm·s-1,有约2.5 倍的增幅。在加入汉防己甲素后,甘草次酸从 BL 到 AP 侧流出量由 16×10-6cm·s-1变化为 8.7×10-6cm·s-1,同样减少了50%左右;从 AP到 BL的流量从12.9×10-6cm·s-1变化为 31.9×10-6cm·s-1,有约 2.8 倍的增幅(见表1)。结果表明:甘草次酸可能是细胞膜上P-糖蛋白的底物。细胞膜上的P-糖蛋白参与了甘草次酸的外排转运,维拉帕米和汉防己甲素有抑制细胞膜上转运载体P-糖蛋白外排的功能。
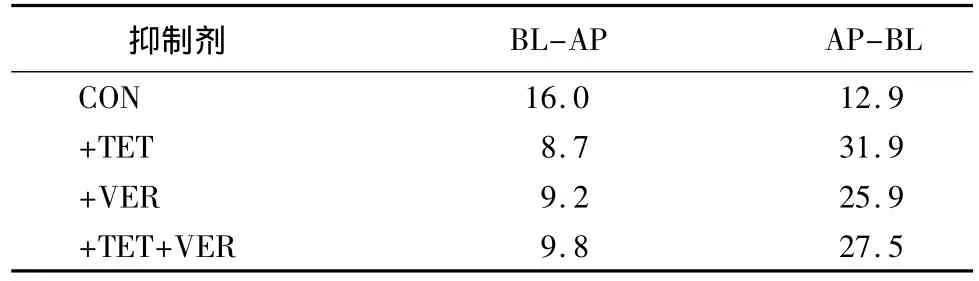
表1 维拉帕米和汉防己甲素对甘草次酸在Caco-2 单细胞层中流量的影响 10-6cm·s-1
4 结论与讨论
采用Caco-2细胞模型进行药物吸收机制研究是一种较好的模拟肠管真实的生理环境的离体实验,作为研究药物吸收的快速筛选工具,能够在细胞水平提供关于药物分子通过小肠黏膜的吸收、代谢、转运的信息,有重现性好、易于操作、可同时研究药物对黏膜的毒性、与人体不存在种属差异等优点。但仍有不足,如药物经该模型的吸收与体内实际吸收还有一定差距;细胞培养时间过长;该模型本身为纯细胞系,缺乏在小肠上皮细胞中的黏液层,同时Caco-2细胞的吸收转运体表达较小肠上皮的低,因而在主动转运药物的研究方面相对不如被动扩散药物研究的成功。
本文探讨了甘草次酸在Caco-2细胞模型上的双向转运,结果表明:甘草次酸为吸收良好的化合物且主要为被动扩散;从P(appBL-AP)/P(appAP-BL)比值判断,甘草次酸从BL端到AP端转运占优势。由此可推测出,在甘草次酸的跨膜转运的过程中可能存在外排机制。
P-糖蛋白是一种质膜糖蛋白,是多药耐药基因mdr1的产物,存在于Caco-2细胞中,其功能是外排底物(或进入BL端的药物)。若甘草次酸是P-糖蛋白的底物,P-糖蛋白会将它们排到肠腔侧(AP侧)[16],使它们在小肠中的吸收量减少。这也可能是说明甘草次酸从BL侧到AP侧的吸收较AP侧到BL侧吸收好的原因,有待于下一步实验继续研究。
[1]杨秀伟,杨晓达,蒲小平,等.创新药物研究中的吸收、分布、代谢、排泄/毒性(ADME/Tox)平台建设[J].北京大学学报:医学版,2004,36(1):5.
[2]杨秀伟.基于体内过程的中药有效成分和有效效应物质的发现策略[J].中国中药杂志,2007,32(5):365.
[3]杨秀伟.基于体内过程的中药毒性成分和毒性效应物质的发现策略[J].中华中医药杂志,2007,22(2):67.
[4]Gμpt A E,Vyas V,Ahmed F,et al.Pharmacokinetics of orally administered camptothecins[J].Ann N Y Acad Sci,2000,922:195-204.
[5]Hidalgo I J,Raub T J,Borchardt R T.Char acterizat ion of the human colon carcinoma cell line(Caco-2)as a model system for intestinal epithelial permeability[J].Gastr Oent Erology,1989,96(3):736.
[6]Rub as W,Mlomwell M E,Sh ah rokh Z,et al.Flux measurements across Caco-2 monolayers may predict transport in human large intestinal tissue[J].J Pharm Sci,1996,85:165.
[7]Maeng H J,Yoo H J,Kim I W,et al.P-glycoprot ein-mediated transport of berberine across Caco-2 cell monolayers[J].J Pharm Sci,2002,91(12):2614-2621.
[8]Woo J S,Lee C H,Shin C K,et al.Enhanced oral biovailability of paclitaxel by coadminist ration of the P-glycoprotein in hibitor KP30031[J].Pharm Res,2003,20(1):24-30.
[9]金敏,吴红金.甘草次酸药理作用的研究进展[J].医学综述,2009,11(4):17-21.
[10]Liao X H,Wang J J,Gao M Y,et al.Effect of major components of Marijuana tablets on the transport of hydrochlorothiazide in Caco-2 cell monolayer model[J].Acta Pharm Sin,2010,45:104-108.
[11]Cai R L,Wang M,Qi Y,et al.Selection and utilization on the evaluation criterions of Caco-2 cell model[J].Chin Pharm J,2008,43:1471-1475.
[12]Sun M J,Sheng X,Hu Y Q.Establishment and validation of Caco-2 cell lines for intestinal epithelial permeability[J].Chin Pharm J,2006,41:1431-1434.
[13]Cai W Q.Modern Useful Manual of Cell and Molecular Biology Techniques[M].Beijing:People’s Military Medical Publisher,2003:22.
[14]Arturs son P,Karls son J.Correl at ion between oral drug absorption in humans and apparent drug permeability coefficients in human intestinal epithelial(Caco-2)cells[J].Biochem Biophys Res Commun,1991,175(3):880-885.
[15]Rouquayrol M,Gaucher B,Roehe D.Transepithelial transport of prodrugs of the HIV Protease inhibitors saquinavir,indinavir and nelfinavir across Caco-2 cell monolayers[J].Pharm Res,2002,19(11):1701-1712.
[16]Patel J,Bmddha B,Des S,et al.In vitro interaction of the HIV protease inhibitor ritonavir with herbal constituents:changes in P-gp and CYP3A4 activity[J].Am J Ther,2004,11(4):262-277.
