柽柳类锌指基因ThZFL酵母诱饵表达载体的构建及其表达验证1)
2011-07-02郑唐春臧丽娜王亚军曲冠证夏德安
郑唐春 王 英 臧丽娜 王亚军 曲冠证 夏德安
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)(嘉荫县林业局)(林木遗传育种国家重点实验室(东北林业大学))
柽柳(Tamarix hispida)是分布在干旱荒漠区域的一类常见的盐生、旱生和沙生植物,具有良好的防风固沙作用,通过对其进行干旱、盐胁迫处理提取RNA进行RT-PCR分析,然后对获得的柽柳cDNA文库的测序及Blast比较分析,获得了一个具有完整开放读码框的基因序列(GenBank No.EG971462),因其与拟南芥的命名为 C2H2型锌指蛋白(AT5G16470、AT3G02790、TAIR)的基因具有较高的相似性(氨基酸序列相似性约为80%),并且通过对SwissProt数据库进行Blast未发现有相似的已知植物蛋白基因,因此可以认为此基因为一个新基因。此基因与来源于哺乳动物的特定锌指基因(ZFP706,Q9Y5V0)具有一定的相似性(氨基酸相似性22%),因此暂时命名该基因为ThZFL(Tamarix hispida Zinc finger like gene)[1]。
盐碱耐受性的应答机制是受多基因表达互作调控的,例如各种各样的相溶性溶质或渗透剂,多胺类,活性氧分子和抗氧化剂的防卫机制,离子运输和有害离子的区分[2]。多基因间复杂的相互作用导致的高效胁迫应答系统机制尚不清楚,因此寻找相关蛋白之间的联系,绘制蛋白质相互作用图谱就显得格外重要。由Fields和Song[3]发明的酵母双杂交系统,实现了在活体细胞内验证蛋白质间的相互作用。目的蛋白经过在真核细胞中修饰加工后,更能体现其正常的生理活性,对研究此基因的具体生理功能提供实验依据。
本试验以柽柳的cDNA文库为模板,扩增全长的目的片段,构建酵母诱饵表达载体pGBKT7-ThZFL,使其在酵母中稳定表达。检测其表达蛋白对酵母菌株所含的4种报告基因有无自激活作用及对酵母菌株自身是否有毒害作用,为下一步通过酵母双杂交方法在柽柳cDNA文库中筛选与ThZFL蛋白相互作用的蛋白奠定基础,也为探究ThZFL基因在细胞中的生理功能和表达机制提供试验依据。
1 材料与方法
1.1 试验材料
柽柳cDNA由本实验室保存;E.coli DH5α感受态菌株购自天根生化科技有限公司(北京);酵母双杂交表达载体pG-BKT7-BD,对照质粒 pGBKT7-53、pGBKT7-lam、pGAD-T,Y2Hgold和Y187酵母菌种,酵母省缺培养基及转化试剂均购自Clontech公司;质粒提取、胶回收试剂盒购自OMEGA公司(美国);PCR相关试剂、DNA marker、pMD18-T载体、限制性内切酶EcoR I、BamH I,T4 DNA连接酶购自TaKaRa公司(日本);胰蛋白胨、酵母提取物、葡萄糖、YNB(无氨基酸酵母氮源)购自 Amresco公司(美国),Yeastmaker Carrier DNA、X-αgal、3-AT等购自Clontech公司(美国);所用引物由英潍捷基贸易有限公司合成(上海);DNA序列由六合华大基因科技股份有限公司测定(北京);其他试剂为进口或国产分析纯。
1.2 酵母诱饵载体的构建
1.2.1 引物设计
根据ThZFL基因序列(GenBank No.EG971462),并结合酵母表达载体pGBKT7-BD读码框及多克隆位点自行设计引物,BLAST分析排除异源基因同源性序列,序列设计:上游引物 Primer-F:5'-ATCGAATTCACGATGGCAGGAAAGGCGAAGCC-3'含有编码区20个核苷酸,其中5'端含有EcoR I酶切位点;下游引物 Primer-R:5'-AGCGGATCCTTAGATCTTCTTGAGGCTTCC-3'含有编码区21个核苷酸,其中5'端含有BamH I酶切位点。
1.2.2 PCR 克隆目的基因
以柽柳cDNA为模板,进行PCR克隆。反应体系:cDNA 1 μL;10×PCR Buffer 2.5 μL;dNTP(10 mmol/L)2 μL;Primer-F(10 μmmol/L)2 μL;Primer-R(10 μmmol/L)2 μL;rTaqDNA聚合酶(5 U/μL)0.25 μL,加 ddH2O 至终体积 25 μL。反应条件:94℃ 4 min、94℃ 30 s、56℃ 30 s、72℃ 1 min共35个循环,72℃ 7 min。取3 μL反应产物进行1%琼脂糖凝胶电泳分析。
1.2.3 PCR 产物连接 pMD18-T 载体
将PCR产物电泳后,用胶回收试剂盒回收目的条带,然后与pMD18-T载体进行连接,反应体系:T4 DNA连接酶1 μL;10×T4 DNA 连接酶 buffer 1 μL;PCR 产物 4 μL;pMD18-T载体1 μL,加水至终体积10 μL。室温过夜重组反应,转化大肠杆菌DH5α感受态细胞,涂布到含有IPTG(24 mg/mL 10 μL)和 X-Gal(20 mg/mL 40 μL)的氨苄青霉素(Amp 50 μg/mL)LB平板上,37℃培养12~16 h,观察蓝白斑菌落。随机挑取白色菌落,进行菌液PCR再用质粒提取试剂盒提取质粒PCR验证,验证完成后取菌液送北京六合华大进行序列测定。
1.2.4 构建酵母诱饵表达载体
对测序正确连有目的基因的pMD18-T载体和pGBKT7-BD空载体,用BamH I和EcoR I限制性内切酶酶切,酶切体系:BamH I 2 μL;EcoR I 2 μL;10×K buffer 3 μL;质粒 15 μL;ddH2O 9 μL。混匀后先在30℃水浴锅中恒温处理3~4 h,期间每隔半个小时震荡1次,然后转到37℃水浴锅中继续恒温处理3~4 h。酶切完成后用1%琼脂糖凝胶电泳,用试剂盒胶回收酶切后的目的片段。然后进行目的片段的连接重组,重组体系:T4 DNA连接酶1 μL;10×T4 DNA连接酶buffer 1 μL;目的片段6 μL;pGBKT7-BD 载体2 μL,终体积10 μL。16℃过夜连接,转化大肠杆菌DH5α感受态细胞,涂布含有卡那霉素(Kana 50 μg/mL)的LB平板培养,37℃恒温培养16~20 h。然后挑取单克隆进行菌液PCR,提质粒进行质粒PCR和酶切鉴定,最后将阳性克隆送往北京六合华大基因有限公司测序鉴定。
1.2.5 酵母Y2Hgold感受态制备
购买的酵母菌株为Y2Hgold,将冻存于-70℃的Y2Hgold划线接种于新鲜的YPDA平板倒置于30℃孵育3~4 d,在15 mL的离心管中,加入3 mL的新鲜YPDA液体培养基,挑取2~3 mm的单克隆,震荡混匀,在30℃,250 r/min中震荡培养8~12 h;转移5 μL培养液到50 mL(250 mL的培养瓶)新鲜的YPDA 中,继续震荡培养,直至 OD600达到0.15~0.30(约16~20 h);在室温下,将酵母培养液700 g离心5 min,弃上清,用100 mL的YPDA液体培养基重悬,30℃温育,使OD600达到0.4~0.5(约3~5 h);将培养液分到两个50 mL的离心管中,700 g室温离心5 min,弃上清,各用30 mL的灭菌的去离子水重悬;再700 g 室温离心5 min,弃上清,各用 1.5 mL 1.1×TE/LiAc重悬;分装于2个1.5 mL离心管中,高速离心15 s,弃上清,每管用600 μL 1.1×TE/LiAc重悬,至此感受态制备完成。
1.2.6 酵母诱饵载体转化酵母Y2Hgold及其阳性验证
酵母Y2Hgold感受态制备完成后,取两个1.5 mL离心管中分别加入100 ng的pGBKT7-ThZFL载体和pGBKT7-BD空载体,再各加入5 μL(10 mg/mL)的变性的鲱鱼精载体DNA,50 μL 的感受态细胞,500 μL 的 PEG/LiAc,轻轻震荡混匀;在30℃水浴锅中温育30 min,每间隔10 min轻轻震荡1次;然后每个管中加入20 μL的DMSO,混合均匀,放在42℃水浴中15 min,间隔5 min,轻轻震荡1次;高速离心15 s,弃上清,用1 mL YPD plus液体重悬;继续高速离心15 s,弃上清,用无菌的1 mL 0.9%NaCl液体重悬。按照1 ∶10,1 ∶100,1 ∶1 000 稀释后,吸取100 μL,涂布 SD/-Trp平板,30℃倒置培养 3~4 d,观察转化情况。随机挑取直径大于2 mm的菌落进行阳性验证。
1.2.7 酵母诱饵载体的自激活作用验证
随机挑取直径大于2 mm的含有pGBKT7-ThZFL质粒及对照空载体pGBKT7-BD单克隆,用20 μL无菌水重悬后,分别画线于 SD/-Trp/X-α-gal、SD/-Trp/X-α-gal/AbA、SD/-Leu/-Trp/X-α-gal、SD/-Trp/-Leu/-His/X-α-gal培养基平板上,30℃培养3~5 d后观察平板的生长情况及菌落颜色变化,来检测诱饵蛋白有无自激活作用。
1.2.8 酵母诱饵载体对酵母自身的毒性检验
在经阳性验证的平板上挑取直径大于2 mm的单菌落,分别接种与5 mL SD/-Trp(Kana 50 μg/mL)液体培养基中,30℃ 230~250 r/min,震荡培养12 h,将过夜菌液以1∶100稀释后接种于100 mL的 SD/-Trp(Kana 50 μg/mL)液体培养基中,在同样条件下继续培养,并分别于培养后 0、3、6、9、12、15、18、21、24、27、30 h 后吸取菌液3 mL,以新鲜的 SD/-Trp 液体培养基为空白对照,用可见光分光光度计在OD600处测定其吸光度,绘制酵母生长曲线,分析诱饵蛋白对酵母细胞自身有无毒害作用。
2 结果与分析
2.1 PCR扩增ThZFL基因编码序列
以柽柳cDNA为模板进PCR扩增,取产物3 μL,在1%的琼脂糖凝胶电泳,获得1条亮带,分子大小介于250~500 bp,与目的基因大小的318 bp相符(图1)。
2.2 将目的条带连接到pMD18-T载体
胶回收PCR产物,与pMD18-T载体连接后转化大肠杆菌,获得重组质粒pMD18-T-ThZFL,首先对质粒 pMD18-TThZFL进行PCR检验,然后用BamH I和EcoR I进行双酶切验证,最后送样到北京六合华大公司测序,测序结果分析表明所扩增的目的片段和基因库中的ThZFL基因序列(GenBank No.EG971462)完全一致,没有发生碱基突变。

图1 ThZFL基因的PCR扩增产物琼脂糖凝胶电泳
2.3 酵母诱饵表达载体的构建及验证
用 BamH I和 EcoR I对质粒 pMD18-T-ThZFL、酵母空载体pGBKT7-BD同时进行双酶切后(图2),用T4连接酶连接后转化到大肠杆菌中,获得重组载体暂命名为pGBKT7-ThZFL,提取质粒PCR验证(图3),双酶切目的条带(图4),对菌液送样测序。测序结果表明柽柳ThZFL基因已经完全重组到酵母表达载体中,未发生碱基突变,至此酵母诱饵表达载体构建完成。

图2 重组质粒pMD18-T-ThZFL和pGBKT7-BD的 BamH I和EcoR I双酶切鉴定
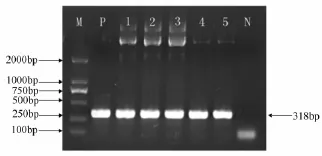
图3 诱饵质粒pGBKT7-ThZFL PCR产物电泳
2.4 pGBKT7-ThZFL载体转化酵母Y2Hgold菌株及阳性验证
通过TE/LiAc法制备Y2Hgold酵母感受态,用PEG/LiAc法将诱饵载体转化到酵母细胞中,涂布到SD/-Trp平板上筛选阳性克隆,随机挑取单菌落PCR,提取质粒PCR,BamH I、EcoR I双酶切验证,都在300 bp左右获得目的条带,表明pGBKT7-ThZFL质粒已经成功转化到酵母细胞中(图5)。
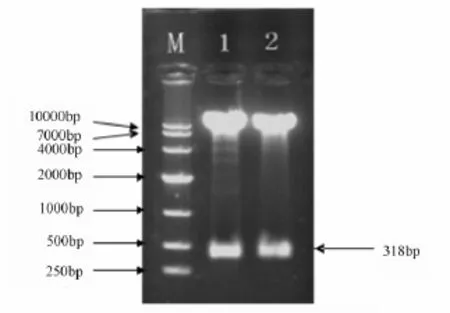
图4 重组质粒pGBKT7-ThZFL的BamH I和EcoR I双酶切鉴定
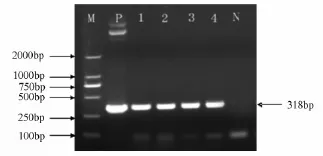
图5 诱饵表达载体pGBKT7-ThZFL转化酵母后菌液PCR产物电泳
2.5 诱饵蛋白的自激活验证
酵母转化涂板3 d后观察平板发现,诱饵载体和空载体对照都在 SD/-Trp/X-α-gal上生长,菌落颜色为白色,SD/-Trp/X-α-gal/AbA、SD/-Leu/-Trp/X-α-gal、SD/-Trp/-Leu/-His/X-α-gal平板上都未见菌落生长,说明酵母诱饵表达载体没有自激活作用(表1)(图6)。
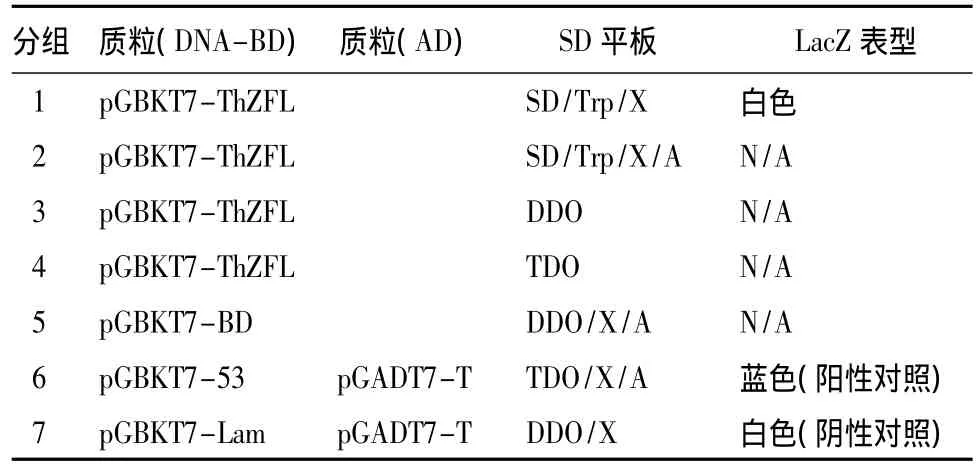
表1 pGBKT7-ThZFL的自主激活作用的检测
2.6 诱饵蛋白对自身的毒害作用
从单缺板上挑取的阳性克隆,与空载体的对照菌在SD/-Trp液体培养基中,在30℃中震荡培养,每隔3 h,吸取培养液测定OD600处的吸光度。数据结果表明,两者在OD600处的吸光度随时间先增长后稳定,但两者生长情况变化不显著,整体生长曲线相同,说明重组诱饵载体pGBKT7-ThZFL对酵母自身没有毒害作用(表2)。
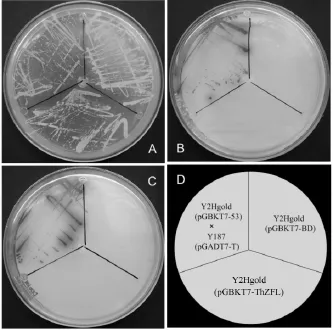
图6 在SD/-Trp/X、SD/-Trp/X/A、DDO/X平板上的自激活验证

表2 酵母诱饵载体pGBKT7-ThZFL和阴性对照载体pGBKT7-BD的生长对比
3 讨论
柽柳(Tamarix hispida)是干旱荒漠区域常见的沙生植物,除具有抗旱能力外,还普遍具耐盐性。柽柳属于典型的泌盐性盐生植物,泌盐腺的分泌细胞内含许多小的液泡,通过主动运输将积累的盐分储存在液泡中而实现区隔化,维持细胞液中正常的渗透势[4]。因此,从柽柳基因库中寻找抗旱、抗盐基因,研究植物的胁迫抗性具有重要意义。Wang Yucheng等[5]从柽柳中克隆到一个新的bZIP基因,在转基因烟草中能增强过氧化酶(POD)和过氧化物歧化酶(SOD)的活动,并增加可溶性糖与可溶性蛋白质的含量。Guo Xiaohong等[6]从柽柳根系盐胁迫cDNA文库中,分离出一个编码冷冻适应蛋白基因ThCAP,转基因杨树对低温具有较强的抵抗能力。最新研究表明,柽柳中的V-ATP酶亚基基因ThVHAc1,编码由4个跨膜结构域构成的高级疏水蛋白。RT-PCR数据表明NaCl、NaHCO3、PEG和CdCl2胁迫能诱导该基因在柽柳的根、茎、叶中表达,在非胁迫条件下,脱落酸(ABA)的外源性应用也能刺激ThVHAc1的转录水平,表明该基因参与ABA-依赖性胁迫信号途径。另外,ThVHAc1转酵母菌株能提高对盐、干旱、紫外线、氧化剂、重金属、冷冻和高温耐性[7]。因为柽柳生长于环境恶劣的荒漠地区,在自然选择的条件下,适应严酷条件的抗性基因得到富集与积累,所以从柽柳基因组中探究新基因的生理功能具有重要的经济价值与生态意义。
植物锌指基因是一类广泛研究的抗逆性植物基因蛋白,广泛分布在动植物和微生物中。大量研究表明,一些锌指蛋白与植物的抗逆性有关。例如:在胡椒中克隆到一个对氧化物、甲基紫精、过氧化氢和脱落酸等产生胁迫应答反应的新基因(CaAbsi1),该基因可能在植物创伤和非生物胁迫产生的多基因应答中发挥重要的作用[8];研究人员还从菊花中分离到一个C2H2锌指蛋白基因DgZFP,该基因在种子中可被NaCl、干旱、冷冻处理和微弱的ABA诱导,DgZFP的过表达能增强转基因烟草的耐盐性[9];Byung Kook Ham 等[10]还发现锌指蛋白基因(Tsip1),在烟草中过表达能提高其对水杨酸、乙烯、酸、盐和病毒的耐性。最新研究发现,特殊的锌指基因对植物的生长和发育可能存在着致命的影响,在用CaMV 35S启动子过量表达编码锌指蛋白的AZF1和AZF3基因转染拟南芥时,转化效率非常的低,无法获得任何转基因植株[11];Xu Shouming等[12]在研究柽柳的ThZF1基因在非生物胁迫下的功能时,尝试着在CaMV 35S启动子下过量表达ThZF1基因转染野生型拟南芥从而获得转基因拟南芥,但一直没获得转基因苗。
酵母双杂交是一种简便快速研究蛋白质间相互作用的一种方法。与传统的方法相比,其最大的优势在于不用分离纯化蛋白质,而是将所研究的基因置于真核酵母细胞体内表达目的蛋白,从而为蛋白的功能修饰提供一个场所。通过酵母双杂交技术,为研究蛋白质与蛋白质间的相互联系提供了支持,蛋白关系图谱变得越来越清晰,通过研究已知蛋白的功能,也能为探究新基因的生理功能提供理论依据。如将柽柳的Thprxl基因构建到酵母诱饵表达载体,通过双杂交筛选验证获得了两个与ThPrxl蛋白互作的蛋白,分别是油体钙蛋白(ealciumlipid binding protein)和与 CONSTANS互作蛋白(CONSTANS interacting protein)[13];以拟南芥的 HHP1 基因作为诱饵,从cDNA library中筛选到编码ZFHD1(at1g69600)和ICE1(at3g26744)的基因,有趣的是ICE1和ZFHD1都参与冷冻和渗透胁迫的信号网络[14];通过微阵列分析,发现水稻籽苗中的锌指蛋白基因(ZFP179)能诱导OsDREB2A、OsP5CS、OsProT和OsLea3一系列基因表达,共同对NaCl、PEG 6000、ABA等胁迫处理产生应答反应,从而使转基因水稻能增强抗氧化胁迫能力,活性氧清除能力,转基因植物还能增加自由脯氨酸和可溶性糖的含量[15]。
前期研究结果证明ThZFL基因受盐、渗透及冷胁迫等诱导,烟草的转基因试验证明ThZFL基因的过量表达能提高烟草的耐盐、抗渗透等抗逆性,转基因酵母也表明对低温、NaCl、甘露醇和LiCl等胁迫有一定的应答反应。为进一步探究ThZFL基因的生理功能,构建了酵母诱饵表达载体,通过酵母双杂交技术从柽柳cDNA文库中筛选与之相互作用的蛋白和基因,参考对已知功能蛋白的研究,来推测并验证该基因的生理功能及抗性机理。本实验通过cDNA PCR、双酶切、基因重组、DNA测序等技术,成功将ThZFL基因构建到酵母诱饵表达载体获得转化子pGBKT7-ThZFL,并成功转化进入酵母菌种Y2Hgold(含有真菌抗生素AbA(AnreobasidinA)),通过在SD/-Trp平板上筛选阳性克隆及单克隆培养在液体SD/-Trp(Kana 50 μg/mL)培养基中获得的生长曲线,证明pGBKT7-ThZFL酵母载体对酵母自身没有毒性作用。通过SD/-Trp、SD/-Trp/X、SD/-Trp/X/A、DDO、TDO 平板筛选,试验结果显示转化了诱饵载体的Y2Hgold酵母在SD/-Trp板上生长,SD/-Trp/X板上生长但不变蓝,SD/-Trp/X/A板上不生长,DDO、TDO平板上不生长,证明诱饵蛋白没有自激活功能,不能激活报告基因的表达。许多研究表明,锌指蛋白具有核定位特征,并在酵母诱饵表达载体中具有自激活功能[16],研究表明,此基因既不具有核定位特征,也不能激活酵母双杂交系统中报告基因的表达,尽管ThZFL基因的同源基因在拟南芥中被标注为锌指基因,但实际上ThZFL基因完全不属于锌指蛋白基因家族,而是一个新基因[1]。以上数据为应用酵母双杂交技术筛选与诱饵蛋白相互作用的靶蛋白奠定了实验基础,有助于进一步探究ThZFL基因的生理功能和抗逆机理。
[1]An Yan,Wang Yucheng,Lou Lingling,et al.A novel zinc-fingerlike gene from Tamarix hispida is involved in salt and osmotic tolerance[J].Journal of Plant Research,2010,123(2):10-15.
[2]Sairam R K,Aruna T yagi.Physiology and molecular biology of salinity stress tolerance in plants[J].Current Science,2004,86:406-421.
[3]Fields S,Song O.A novel genetic system to detect protein-protein interactions[J].Nature,1989,340:245-246.
[4]Thomson W W,Kathryn PlattAloia.The ultrastructure of the plasmodesmata of the salt glands of tamarix as revealed by transmission and freeze-fracture electron microscopy[J].Planta,1985,125:13-23.
[5]Wang Yucheng,Gao Caiqiu,Liang Yenan,et al.A novel bZIP gene from Tamarix hispida mediates physiological responses to salt stress in tobacco plants[J].Journal of Plant Physiology,2010,167:222-230.
[6]Guo Xiaohong,Jiang Jing,Lin Shijie,et al.A ThCAP gene from Tamarix hispida confers cold tolerance in transgenic Populus(P.davidiana 3 P.bolleana)[J].Biotechnology Letters,2009,31:1079-1087.
[7]Gao Caiqiu,Wang Yucheng,Jiang Bo,et al.A novel vacuolar membrane H+-ATPase c subunit gene(ThVHAc1)from Tamarix hispida confers tolerance to several abiotic stresses in Saccharomyces cerevisiae[J].Japanese Journal of Applied Physics,2011,38:957-963.
[8]Eun Soo Seong,Myeong-Hyeon Wang.A novel CaAbsi1 gene induced by early-abiotic stresses in pepper[J].Biochemistry and Molecular Biology,2008,41(1):86-91.
[9]Liu Qinglin,Xu Kedong,Ma Nan,et al.Isolation and functional characterization of DgZFP:a gene encoding a Cys2/His2-type zincfinger protein in chrysanthemum[J].Japanese Journal of Applied Physics,2010,37:1137-1142.
[10]Byung Kook Ham,Jeong Mee Park,Suk Bae Lee,et al.a DnaJType Zn Finger Protein,Is Recruited to and Potentiates Tsi1-Mediated Transcriptional Activation[J].The Plant Cell,2006,18:2005-2020.
[11]Hideki Sakamoto,Kyonoshin Maruyama,Yoh Sakuma,et al.Arabidopsis Cys2/His2-Type Zinc-Finger Proteins Function as Transcription Repressors under Drought,Cold,and High-Salinity Stress Conditions[J].Plant Physiology,2004,136:2734-2746.
[12]Xu Shouming,Wang Xuechen,Chen Jia.Zincfinger protein1(ThZF1)from salt cress(Thellungiella halophila)is a Cys-2/His-2-type transcription factor involved in drought and salt stress[J].Plant Cell Reports,2007,26:497-506.
[13]蒋丽丽.柽柳peroxiredoxi基因(Thprxl)的克隆及抗逆性分析[D].哈尔滨:东北林业大学林学院,2010:5.
[14]Chen Chinchung,Liang Chingshin,Kao Ailing,et al.HHP1,a novel signalling component in the cross-talk between the cold and osmotic signalling pathways in Arabidopsis[J].Journal of Experimental Botany,2010,61:3305-3320.
[15]Sun Shujing,Guo Shuqiao,Yang Xia,et al.Functional analysis of a novel Cys2/His2-type zincfinger protein involved in salt tolerance in rice[J].Journal of Experimental Botany,2010,61(10):2807-2818.
[16]徐守明.小盐芥C2H2类锌指蛋白基因ThZF1的克隆及其功能研究[D].北京:中国农业大学生物学院,2005:6.
