以高砷精炼铋烟尘为原料制备高纯氯氧化锑
2011-09-17
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
粗铋经过吹炼得到精铋[1],铋吹炼过程中As,Sb,Pb和Bi等杂质以氧化物挥发后形成精炼铋烟尘[2−3],因为其中砷含量高而成为一种难处理、有毒危害固体废弃物。利用高砷精炼铋烟尘制备氯氧化锑不仅有利于消除危险性,而且得到资源化及产生经济效益。氯氧化锑是一种理想的锑系无机阻燃剂[4],广泛用于各种热塑性聚合物阻燃[5−6],同时也是生产锑白[7]、精锑产品[8]及其他锑系产品的原料。氯氧锑制备方法主要有三氯化锑水解法[9]、三氯化锑−乙醇法[10]、三氯化锑−三氧化二锑法[11−12]和氯化氢−三氧化二锑法[12]。由于 SbCl3溶液所含杂质及对氯氧化锑杂质含量要求不一样,三氯化锑水解法又可分为一次水解法[13]、多次水解法、蒸馏−水解法[14]和蒸馏−精馏−水解法[15]。在此,本文作者采用高砷精炼铋烟尘为原料经过盐酸浸出后加除杂剂水解制备高纯氯氧化锑。
1 实验
1.1 实验步骤及工艺流程
1.1.1 实验步骤
将高砷精炼铋烟尘加入盐酸溶液中,启动搅拌,加热反应一定时间后过滤得到酸浸液。在酸浸液中加入锑粉还原得到SbCl3溶液。
取一定量的 SbCl3溶液和水加入三颈瓶中,启动搅拌,加热反应一定时间后过滤得到滤液和滤饼。盐酸溶解滤饼,将溶解液和除杂剂一起加入三颈瓶中,搅拌反应一定时间后进行水解,得到高纯氯氧化锑。
1.1.2 工艺流程
根据实验步骤,其工艺流程如图1所示。

图1 高砷精炼铋烟尘制备氯氧化锑工艺流程图Fig.1 Process of antimony oxychloride made from high-arsenic refined bismuth dust
1.2 分析及检测
1.2.1 成分分析
采用硫酸联氨还原—硫酸铈—溴酸钾滴定法测定溶液中Sb和As的含量,采用X荧光分析(XRF)测定固体产物中Sb,As,Pb和Bi的含量。
1.2.2 结构及形貌检测
采用D/mac−rA型X线衍射仪分析水解产物的物相,用扫描电镜(SEM)观察产物表面形貌。
2 实验结果与讨论
2.1 精炼铋烟尘的盐酸浸出
实验将 2.5 kg高砷精炼铋烟尘加入体积分数为50%的盐酸溶液中,高砷精炼铋烟尘成分及物相分析结果如表1所示。根据优化实验结果,在液固比为3:1、反应时间为4 h、反应温度为80 ℃、盐酸用量为1.2倍理论用量条件下进行反应,盐酸浸出实验结果如表2所示。

表1 高砷精炼铋烟尘物相组成Table 1 Phase composition of high-arsenic refined bismuth dust

表2 盐酸浸出分析结果Table 2 Analysis results of hydrochloric acid leaching
由表1可知:高精炼铋烟尘中锑、砷质量分数分别为57.48%和10.53%,锑主要以Sb2O3形式存在,砷主要以 As2O3和砷酸盐形式存在,铋主要以 Bi2O3形式存在。浸出过程发生的主要反应如下:

由表2可知:浸出液中Sb,As,Bi和Pb的质量浓度分别为102.36,17.49,9.01和1.7 g/L,Sb,As,Bi和 Pb浸出率分别为 99.50%,92.79%,95.12%和85.34%。
2.2 浸出液中Sb5+的还原
盐酸浸出液中含有少量高价金属离子Sb5+和Sb5+必须在SbCl3溶液水解前还原为Sb3+,否则会影响氯氧化锑产品质量。当还原时间为2 h、还原温度为60℃、锑粉用量为1.2倍理论用量时, Sb5+完全被还原,还原后溶液成分(质量浓度)如表3所示。

表3 SbCl3溶液主要成分(质量浓度)Table 3 Basic compositions of antimony trichloride solution g/L
由表3可知:精炼铋烟尘盐酸浸出液经过锑粉还原,溶液中Sb浓度增加,其反应如下:

2.3 氯氧化锑的制备
2.3.1 水解温度对Sb3+水解率的影响
取SbCl3溶液100 mL,当稀释比10:1,水解时间为 30 min时,水解温度对 Sb3+水解率的影响如图 2所示。

图2 水解温度对Sb3+水解率的影响Fig.2 Effect of hydrolysis temperature on hydrolysis rate of Sb3+
由图2可知:水解温度对Sb3+水解率影响较小;随着水解温度的升高,Sb3+水解率约减小;当水解温度从20 ℃增加到80 ℃时,Sb3+水解率从98.40%降至96.91%。一般升高温度有利于水解反应进行,但SbCl3溶液稀释10倍后,溶液pH为0.15,Sb3+迅速水解生成Sb4O5Cl2,而Sb4O5Cl2的溶解度随温度升高而升高,温度升高使少量的Sb4O5Cl2返溶。因此,适宜的水解温度为20 ℃。
2.3.2 水解时间对Sb3+水解率的影响
当其他条件不变,水解温度为20 ℃时,水解时间对Sb3+水解率的影响如图3所示。
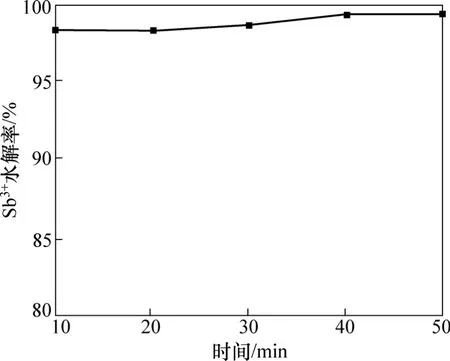
图3 水解时间对Sb3+水解率的影响Fig.3 Effect of hydrolysis time on hydrolysis rate of Sb3+
由图3可知:水解时间对Sb3+水解率影响不大,当水解时间从10 min增加到50 min时,Sb3+水解率从97.45%增加到98.94%;当反应时间为10 min时,水解反应不充分,Sb3+水解率较低,Sb3+水解速度快;随着水解时间的增加, Sb3+水解率增加不大。因此,控制水解时间为40 min。
2.3.3 稀释比对Sb3+水解率的影响
当其他条件不变,水解时间为40 min,稀释比(即水与SbCl3溶液的体积比)对Sb3+水解率的影响如图4所示。

图4 稀释比对Sb3+水解率的影响Fig.4 Effect of volume ratio of water to SbCl3 solution on hydrolysis rate of Sb3+
由图4可知:稀释比对Sb3+水解率影响较大,Sb3+水解率随稀释比增加而增加,当稀释比为3时,Sb3+水解率为88.99%;当稀释比为10时,溶液pH为0.15,Sb3+水解率为98.25%。考虑Sb3+水解率及废水排放量,确定适宜的稀释比为10。
水解所得产物成分如表4所示,XRD分析结果如图5所示。
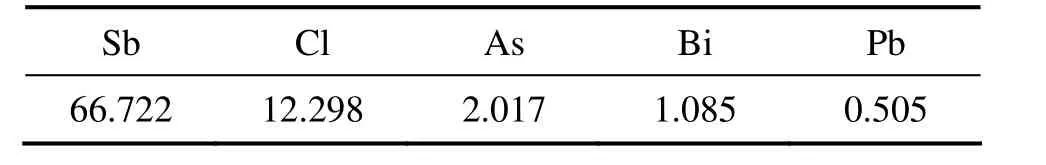
表4 一次水解产物主要成分(质量分数)Table 4 Basic compositions of once hydrolysate %

图5 不同水解产物的XRD图谱Fig.5 XRD patterns of different hydrolysates
由表4可知:一次水解所得产物中As,Pb和Bi主要杂质得到有效去除,但As,Pb和Bi含量分别达到2.017%,1.085%和0.505%,杂质含量较高。由图5可知:一次水解产物为Sb4O5Cl2。
2.4 高纯氯氧化锑的制备
2.4.1 氯氧化锑盐酸溶解后二次水解除杂
实验将一次水解产物Sb4O5Cl2用盐酸溶解后进行二次水解,二次水解产物成分如表4所示,XRD分析结果如图5所示。
由表4和表5可知:与一次水解产物相比,二次水解产物中As,Pb和Bi杂质含量急剧减少,但杂质含量仍然较高,需进一步除杂。由图5可知:二次水解产物为Sb4O5Cl2。

表5 二次水解产物主要成分(质量分数)Table 5 Basic composition of twice hydrolysate %
2.4.2 二次水解时除杂剂对氯氧化锑质量的影响
取一次水解氯氧化锑50 g,加入100 mL浓盐酸和100 mL水溶解,然后加入除杂剂A反应1 h后进行二次水解,除杂剂A用量(m)对产物Sb4O5Cl2中杂质As,Pb和Bi质量分数的影响如图6所示。

图6 除杂剂A用量对产物中As,Pb和Bi含量的影响Fig.6 Effect of A impurity remover amount on contents of As,Pb and Bi in Sb4O5Cl
由图6可知:二次水解前加入除杂剂A能有效降低产物Sb4O5Cl2中杂质含量,随着除杂剂A用量的增加,产物Sb4O5Cl2中As,Pb和Bi含量减小。除杂剂A为一种螯合剂,对许多金属有很强的络合能力,在强酸性溶液中,As,Bi和 Pb分别以 AsO+,BiO+和Pb2+存在,除杂剂A与它们形成具有五节环结构的稳定络合物而留在溶液中;随着溶液 pH的增大,Sb3+水解生成氯氧化锑沉淀,从而达到Sb与杂质的分离。因此,确定适宜的除杂剂A用量为5.0 g(即氯氧化锑与除杂剂A质量比为10:1),所得产物中Sb的质量分数为75.71%,而杂质As,Pb和Bi的质量分数分别为0.081 9%,0.039 2%和0.118 7%。
除杂后二次水解产物XRD实验结果如图5所示,除杂后二次水解产物仍为Sb4O5Cl2。
对一次水解氯氧化锑、二次水解氯氧化锑及除杂后二次水解氯氧化锑进行 SEM 分析,其形貌比较如图7所示。
由图7可知:一次水解产物为片层状颗粒,二次水解产物为颗粒粒径均匀、分散性较好的椭球粒子,除杂后二次水解产物为粒径均匀、分散性好的菱形颗粒。经过二次水解和除杂,不仅形貌发生变化,而且分散性变好。

图7 不同水解产物的SEM像Fig.7 SEM images of different hydrolysates
3 结论
(1) 用盐酸浸出锑、砷质量分数分别为57.48%和10.53%高砷精炼铋烟尘,当固液比为 1:3、反应时间为4 h、反应温度为80 ℃、盐酸用量为1.2倍理论用量时,Sb,As和 Bi和 Pb浸出率分别为 99.50%,92.79%,95.12%和85.34%。在酸浸液中加入锑粉还原后,在水解温度为20 ℃、水解时间为45 min、稀释比为10条件下水解,Sb3+水解率达到98.25%。
(2) 将一次水解产物用盐酸溶解,按氯氧化锑与除杂剂A质量比10:1加入除杂剂A,反应1 h后进行二次水解。除杂后二次水解产物中 Sb含量达到75.71%,而As,Pb和Bi杂质含量分别为0.081 9%,0.039 2%和0.118 7%。
(3) XRD结果证实水解产物均为Sb4O5Cl2。SEM扫描电镜结果表明各水解产物形貌差异较大,一次水解产物为片层状颗粒,二次水解产物为均匀、分散性较好的椭球粒子,除杂后二次水解产物为粒径均匀、分散性好的菱形颗粒。
[1] 屠海令, 赵国权, 郭青蔚. 有色金属冶金、材料、再生与环保[M]. 北京:化学工业出版社, 2003: 160−162.TU Hai-ling, ZHAO Guo-quan, GUO Qing-wei. Nonferrous metallurgy, materials, regeneration and environmental protection[M]. Beijing: Chemical Industry Press, 2003:160−162.
[2] XIONG Li-zhi, HE Ze-qiang, LIU Wen-ping, et al. Preparation of high-purity bismuth by sulphur deleadization in vacuum distillation[J]. Transactions of Nonferrous Metals Society of China, 2004, 14(6): 1210−1214.
[3] 吴斌秀. 含铋铅烟尘制取铋品新工艺研究[J]. 中南大学学报:自然科学版, 2004, 32(3): 273−276.WU Bin-xiu. New process study on preparation of bismuth production from lead dust bearing bismuth[J]. Journal of Central South University: Science and Technology, 2004, 32(3):273−276.
[4] 唐谟堂, 阳卫军. 氯氧化锑阻燃剂研究进展[J]. 现代化工,2000, 20(6): 15−19.TANG Mo-tang, YANG Wei-jun. Research progress in antimony oxychlorides as flame retardants[J]. Modern Chemical Industry, 2000, 20(6): 15−19.
[5] CHEN Xiang-ying, Huh H S, Lee S W. Hydrothermal synthesis of antimony oxychloride and oxide nanocrystals: Sb4O5Cl2,Sb8O11Cl2, and Sb2O3[J]. Journal of Solid State Chemistry, 2008,181(9): 2127−2132.
[6] Jaubert R. Fire-retardant treatment of thermosetting resins,textiles and other combustible materials with antimony oxides:EP, 46890[P]. 1982−03−10.
[7] 柳松. 高铅粗锑氧制取锑白的研究[J]. 无机盐工业, 2007,39(1): 19−20.LIU Song. Preparation of antimony white from crude antimony trioxide with high-lead[J]. Inorganic Chemicals Industry, 2007,39(1): 19−20.
[8] 河南豫光金铅股份有限公司. 综合回收氯氧锑渣中有价金属的工艺: CN, 1908208A[P]. 2007−02−27.Henan Yuguang Gold and Lead Group Co Ltd. The comprehensive recovering technique of valuable metals from antimony oxychloride residue: CN, 1908208A[P]. 2007−02−27.
[9] 项斯芬, 严宣申, 曹庭礼, 等. 无机化学丛书: 第4卷[M]. 北京: 科学出版社, 1995: 438.XIANG Si-fen, YAN Yuan-shen, CAO Ting-li, et al. Inorganic chemistry: Vol.4[M]. Beijing: Science Press, 1995: 438.
[10] 郑国渠, 黄荣斌, 潘勇, 等. 含氟三氯化锑溶液中锑产物的物相[J]. 中国有色金属学报, 2005, 15(8): 1278−1282.ZHENG Guo-qu, HUANG Rong-bin, PAN Yong, et al. Phases of antimony trichloride solution containing fluorine neutralization-hydrolysis products[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(8): 1278−1282.
[11] Jenkner H, Jaubert R. Verfabren zur herstellung von antimonoxihalogeniden: DE, 3031009 [P]. 1982−06−16.Jenkner H, Jaubert R. Process for preparing antimonoxihalogeniden: DE, 3031009 [P]. 1982−06−16.
[12] Regenbogen D. Novel process for preparing antimony oxychloride: US, 3179494[P]. 1965−04−20.
[13] Hashimoto H, Nishimura T, Umetsu Y. Hydrolysis of antimony(III)-hydrochloric acid solution at 25°C[J]. Materials Transactions, 2003, 44(8): 1624−1629.
[14] 甘庆民, 胡乃信, 吴鸿铭, 等. 从锑矿石制备三氯化锑的工艺研究[J]. 材料工程, 1997(1): 38−39.GAN Qing-min, HU Nai-xin, WU Hong-ming, et al. Study on preparation of antimony trichloride from antimony sulphide ore[J]. Journal of Materials Engineering, 1997(1): 38−39.
[15] 段学臣, 杨向萍, 黄蔚庄. 高纯三氯化锑的制备[J]. 中南工业大学学报: 自然科学版, 2001, 32(2): 169−172.DUAN Xue-chen, YANG Xiang-ping, HUANG Wei-chuang.Preparation of high purity antimony chloride[J]. Journal of Central South University of Technology: Natural Science, 2001,32(2): 169−172.
