温度控制TiO2纳米管及管/线复合阵列的制备
2011-09-15蔡芳共杨程翠华
蔡芳共杨 峰*,赵 勇,程翠华
(1西南交通大学超导研究开发中心,材料先进技术教育部重点实验室,成都 610031)
(2新南威尔士大学材料科学与工程学院,悉尼 2052,澳大利亚)
温度控制TiO2纳米管及管/线复合阵列的制备
蔡芳共1杨 峰*,1赵 勇1,2程翠华2
(1西南交通大学超导研究开发中心,材料先进技术教育部重点实验室,成都 610031)
(2新南威尔士大学材料科学与工程学院,悉尼 2052,澳大利亚)
以含有NH4F的乙二醇溶液为电解液,在宽温度范围内(10~70℃)对纯Ti表面进行阳极氧化,制得形貌可控的TiO2纳米结构。利用场发射扫描电子显微镜(FESEM)和透射电镜(TEM)对纳米TiO2的形貌进行表征。结果表明,随着电解液温度的变化,纳米TiO2的形貌得到控制,可形成TiO2纳米管阵列及纳米管阵列/纳米线复合结构,温度40~50℃为转折温区。
阳极氧化;TiO2纳米管阵列;TiO2纳米线;复合结构
自1991年Iijima[1]发现碳纳米管以来,管状结构纳米材料因其独特的物理化学性能,在微电子、应用催化和光电转换等领域展现出良好的应用前景。在Zwilling等[2]通过阳极氧化制备TiO2多孔薄膜的基础上,2001年Grimes等[3]首次在低电压下用含有氢氟酸的电解液成功制备出了分布均匀、排列整齐有序的TiO2纳米管阵列。TiO2纳米管阵列在氢气敏传感器[4]、光解水制氢[5]、染料敏化太阳能电池[6]等方面均具有很好的应用前景,引起了广泛关注。
利用阳极氧化法可简单有效的制备出高度有序的TiO2纳米管阵列,目前的研究表明,TiO2纳米管的管径(20~150 nm)、管长(0.2~1000 μm)、管壁厚度(10~70 nm)以及管的形态可以通过改变阳极氧化电压、氧化时间、电解液组成、电解液的pH值等加以控制[7-13]。然而电解液温度对纳米管形貌的影响,目前的研究较少,且温度调控范围不大[14-16]。本工作通过较大范围改变电解液的温度(10~70℃),发现在NH4F-乙二醇体系中,除了控制氧化时间可以有效的提高TiO2纳米管的长度以外,通过提高电解液的温度,同样能达到显著提高纳米管长度,从8 μm(10℃)增大至58 μm(40℃),增幅达近7倍。随着电解液温度的升高,出现TiO2纳米线覆盖在纳米管阵列表层,形成纳米线/纳米管阵列复合结构。
1 实验部分
采用两电极体系,阳极氧化法制备TiO2纳米管阵列。3 cm×4 cm×0.2 mm 的纯 Ti箔(纯度≥99.6%)为阳极,同等面积的Pt箔为阴极,两电极间距离固定为3 cm,电压恒定为60 V,电解液为0.25wt%NH4F的乙二醇溶液(80 mL),不另外加水,且所有试剂未经进一步的纯化。实验中通过改变电解液温度,研究TiO2纳米管阵列的形貌变化及形成机理。整个实验过程在磁力搅拌下进行,温度由恒温油浴调控,阳极氧化时间为6 h。纳米管阵列微观形貌的表征采用场发射扫描电子显微镜FESEM(Strata DB235 FIB型号)和透射电镜TEM(JEOL 200CX)。其中,进行TEM测试前,先将制得的TiO2膜从Ti箔上剥离,置于乙醇中超声一段时间,使其分散,再进行TEM观察。
2 结果与讨论
图1(a~g)为不同电解液温度(T=10~70 ℃)下,相同时间(t=6 h)制得的TiO2纳米管阵列的形貌FESEM图像,其中插图为对应的表面形貌,并在图中用“Ti”标注出相应的Ti基底的位置。由此可以看出:随着温度的升高,TiO2的形貌先后表现为清晰规整的纳米管阵列结构(图a~c)、纳米线/纳米管阵列复合结构(图d~g)。当电解液温度T=10℃时(图1a),制得的TiO2膜呈现为结构完整,排列整齐,管壁光滑的纳米管阵列,膜层厚度(即为纳米管层)约为 8 μm。温度升高至 20 ℃(图 1b)和 30 ℃(图 1c),TiO2膜仍为清晰完整的纳米管阵列,相比于T=10℃,TiO2膜层(纳米管层)明显增厚,分别达到 17 μm和35 μm。当温度升高至40℃时(图1d),除了观察到TiO2膜层的厚度继续增大达到58 μm外,还可观察到在TiO2纳米管的管口出现少量的纳米线,如图1d插图所示。当T=50℃时(图1e,双箭头表示管、线分界线),可以观察到TiO2膜层的厚度继续增大达到77 μm,而且分成54 μm厚的纳米管层和23 μm厚的纳米线层两层,纳米线层完全覆盖在纳米管层表面,形成纳米管/线复合结构,纳米线为纳米管劈裂而成,如图1e插图所示。当T=60℃时(图1f),与T=50℃时类似,为纳米管/线复合结构,TiO2膜层、纳米管和纳米线层的厚度分别为56、36和20 μm。结合实验过程中的现象,可以发现在阳极氧化过程中,Ti箔正反两面均被氧化形成TiO2膜,电解液温度T介于10~60℃区间时,均仍有一定厚度的Ti箔存在,如图1a~f中“Ti”标识的位置。当温度升高至70℃时,我们观察不到Ti基底的存在,而是正反两面Ti基底经阳极氧化反应得到的TiO2膜层紧挨在一起,如图1g,总厚度达 68 μm,单层 TiO2膜层厚度为34 μm。Prakasam等[12]通过不断延长阳极氧化时间,也观察到两面氧化层紧挨的现象。最后,由图1a~d中插图(纳米管阵列的正视图)及图1e,g中插图(纳米管/线的交界处)可知纳米管内外径随温度变化不大,分别约为90和120 nm,而由纳米管劈裂而成的纳米线直径介于10~20 nm之间 (图1f插图)。

图2为典型的纳米管和纳米线的TEM照片,A为阳极氧化温度T=10℃,B、C为T=60℃。由图2A可以看出,T=10℃时,纳米管的内外径分别约为90和120 nm。T=60℃时,可见明显的纳米管(图2B)和纳米线(图2C),纳米管的内外径约为95和120 nm,纳米线的直径约为10~20 nm,与图1f插图结果相近。结合前面的FESEM结果,说明在阳极氧化温度T=10~70℃区间,纳米管的内外径随温度变化不大,与文献[16]报道的TiO2纳米管内外径随温度的变化规律一致。

由以上分析,可以得出,电解液温度T主要影响阳极氧化制得的TiO2的形貌(纳米管、纳米线)及膜层厚度。图3为根据图1 FESEM图像得出的TiO2膜层、纳米管层及纳米线层的厚度与电解液温度T的关系曲线。由图3可以明显的看出TiO2膜层、TiO2纳米管层及TiO2纳米线层厚度随温度变化均为先增大后减小,TiO2膜层、TiO2纳米线层的厚度均在50℃达到极值,分别为77和23 μm,TiO2纳米管层的极值(58 μm)出现在40℃。

一般认为,利用阳极氧化法制备TiO2纳米管阵列的过程大致经过3个阶段[17]:首先,在Ti基底表面形成一层致密的氧化膜(即阻挡层),反应过程为:
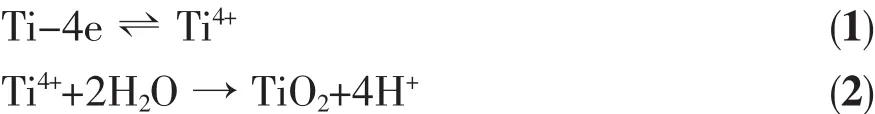
接着,在电场和F-的作用下,氧化膜转变为均匀的多孔膜结构;最后,随着阻挡层向Ti金属界面的推进,以及孔底氧化层的溶解,形成纳米管阵列结构,反应过程可用以下方程式表示:
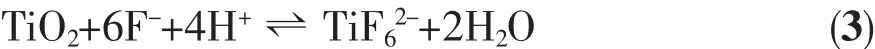
由以上可知,TiO2纳米管阵列的形成的影响因素主要有电压、F-离子浓度、pH值(H+浓度)和反应时间等,而温度又会对有机电解液的性质、Ti4+离子的水解等产生影响,从而影响TiO2纳米管阵列的形成。TiO2纳米管的生长速率是阻挡层向Ti金属界面的推进速率和氧化层的溶解速率两者综合的结果[17]。阻挡层的推进占主导地位,使得TiO2纳米管不断增长;氧化层的溶解占主导地位,会促使纳米管缩短;两者达到平衡时,纳米管的长度达到极值。根据图1和图3,温度变化引起的纳米管长度和形貌的变化规律如下所述:
(1)随着电解液温度的升高(T=10~30℃),其粘度变小,电阻随之变小,从而表现为加载在氧化膜上的电压提高[16];加速了金属Ti的氧化过程,产生较大浓度的Ti4+,管底部由于Ti4+水解作用产生的H+浓度也随之增大,呈现出比溶液相更低的酸性,从而保持对TiO2较高的溶解速率,管底部的电化学腐蚀与管顶部的化学腐蚀速度差增大,使得TiO2纳米管不断长大。高电压会使Ti-O键的极化作用增强,Ti-O键更容易断裂,导致管底部的电化学氧化及场助溶解速度增加,即阻挡层向Ti基底的推进速度增加,从而使得纳米管的长度增大。这个过程符合氧化膜场致溶解机理[9]。在小孔的生长初期,小孔底部的氧化层因薄于孔间的氧化层而承受更高强度的电场。强电场使水电离产生的O2-快速移向基体进行氧化反应,同时也使氧化物加速溶解,故小孔底部氧化层与孔间氧化层以不同的速率向基体推进,导致原来较为平整的氧化膜/金属界面变得凹凸不平。随着小孔的生长,孔间未被氧化的金属向上凸起,形成峰状,引发电力线集中,增强了电场,使其顶部氧化膜加速溶解,产生小空腔。方程(3)溶解主要作用在于使小空腔逐渐加深,将连续的小孔分离,形成有序独立的纳米管阵列。
(2)随着电解液温度的继续升高(T=40℃),纳米管表面逐渐出现纳米线结构,说明方程(3)的溶解作用除了沿垂直于Ti金属基底方向溶解TiO2氧化层形成纳米管外,对纳米管存在一个二次溶解过程。Jae等[18]利用bamboo-splitting模型来解释TiO2纳米线的形成,认为在高电压下,电解液从纳米管底部扩散到表面,从而在表面产生H+,H+在电场作用下迅速迁移到阴极,使得纳米管表面产生表面张力,促进纳米管沿张力方向发生化学溶解,由于纳米管壁光滑,则管的溶解优先在纳米管顶部的缺陷处开始,随后使纳米管劈裂为纳米线。这可由图1e,g中插图(纳米管、线分界处)得到佐证。根据方程(3),TiO2的溶解使水含量增加,使得电解液体系的黏度降低,间接提高加载在氧化膜上的电压,促使更快的形成纳米线。
(3)当电解液温度达到40℃后,继续升高电解液温度至50℃,出现TiO2膜层厚度继续增大,而纳米管长度却缩短的现象。说明纳米管的腐蚀溶解开始占据主导地位,纳米线开始出现。
(4)当温度T≥50℃,由于纳米管不断增长,管底的F-和H+浓度受到一定的限制,使得管底的氧化层化学溶解速率(即阻挡层的推进速率)减小;纳米管管口周围的H+浓度增多 (管内化学溶解速率减小,H+消耗减少),加快了管口处的纳米管腐蚀。此时纳米管的腐蚀溶解占主导,纳米管的长度有所缩短。同时由于纳米线的形成,逐渐的覆盖在纳米管阵列表面,管内H+的流动受到限制,其浓度相对的更低,导致阻挡层的推进速率更慢,这也造成纳米管的长度逐渐缩短。纳米线的出现导致纳米管的厚度不断减小,同时纳米线也发生溶解,以致当温度升高到70℃时,纳米线的厚度也大幅减小。纳米管/线的形成与方程(3)对TiO2氧化层不同的溶解机制所致,在10~40℃,纳米管的长度不断增长,因此我们认为对TiO2氧化层的溶解主要沿垂直于Ti金属基底方向,一方面使小空腔逐渐加深,将氧化层向基底不断推进,同时将连续的小孔分离,形成有序独立的纳米管阵列,是管形成的诱因;40℃~70℃时,主要从纳米管口开始对纳米管开始溶解,形成纳米线;随着温度的进一步升高,纳米线也开始被溶解消失。
(5)阳极氧化过程是从Ti基底的两个表面同时向内进行的,Ti基底的厚度为200 μm,因此单面TiO2氧化层的理论最大厚度应为100 μm。当温度在10~60℃时,阳极氧化6 h后还能观察到Ti基底(如图1a~g),说明氧化层还未到极值,温度为50℃时,TiO2膜层的厚度为最大值 77 μm(60 V,6 h),氧化层已经很接近基底,电解液温度在10~50℃区间,每升高10℃,氧化层厚度分别增加9、18、23和19 μm,60℃时厚度不升反降;温度为70℃时,Ti基底消失,两片氧化层底部连接在一起,说明钛片已经被氧化完全,单片氧化层厚度为34 μm,不仅没有达到50℃的77 μm,更远小于氧化层的理论最小厚度100 μm。结合以上的分析,Ti基底在不同温度下存在不同的阳极氧化过程,在相同阳极氧化电压、时间下,温度较低时(10~30℃)主要以氧化层向基底不断推进转换为纳米管阵列的过程;温度在40℃时氧化层厚度继续增加,然而管口开始向纳米线转变;温度继续升高(50~60℃),一定厚度的纳米线出现,造成氧化层厚度和纳米管层的厚度减小,温度在10~60℃氧化层还未贯穿基底;温度达到70℃时,氧化层已经贯穿基底,厚度却较小,结合10~60℃氧化层还存在钛基底未被氧化的情况推测,氧化层在贯穿基底的过程中可能是氧化→形成纳米管→纳米管溶解转化为管/线复合结构→纳米线溶解→氧化层继续向基底推进,阳极氧化就是以上过程的循环。
3 结 论
在 0.25wt%NH4F-乙二醇体系中,TiO2纳米管阵列的形貌可以通过调节电解液的温度实现有效控制,管内径约为90 nm,管外径为120 nm左右,管径变化不大,但管长变化范围较大,从8 μm至58 μm。随着电解液温度的升高,出现TiO2纳米线覆盖在纳米管阵列表层,形成纳米线/纳米管阵列复合结构,TiO2膜层最大可达77 μm。电解液温度T=10~40℃,呈现完整的TiO2纳米管阵列结构;T=40℃是纳米管腐蚀形成纳米线的转变温度;T=50~70℃表现为TiO2纳米线/纳米管阵列复合结构。研究表明,可在较短时间内控制纳米管阵列的大范围长度变化;通过调节温度,实现可控合成纳米管及纳米管/线的复合结构。
[1]Iijima S.Nature,1991,354:56-58
[2]Zwilling V,Darque C E,Boutry F A,et al.Surf.Interface Anal.,1999,27(7):629-637
[3]Gong D,Grimes C A,Varghese O K,et al.J.Mater.Res.,2001,16(12):3331-3334
[4]Varghese O K,Gong D,Paulose M,et al.Sens.Actuators B,2003,93(1/2/3):338-344
[5]Mor G K,Shankar K,Paulose M,et al.Nano Lett.,2005,5(1):191-195
[6]Macak J M,Tsuchiya H,Schmuki P,et al.Electrochem.Commun.,2005,7(11):1133-1137
[7]Zhao J L,Wang X H,Chen R Z,et al.Solid State Commun.,2005,134(10):705-710
[8]Lai Y K,Sun L,Chen C,et al.Appl.Surf.Sci.,2005,252(4):1101-1106
[9]Cai Q Y,Paulose M,Varghese O K,et al.J.Mater.Res.,2005,20(1):230-236
[10]Paulose M,Shankar K,Yoriya S,et al.J.Phys.Chem.B,2006,110(33):16179-16184
[11]Albu S P,Ghicov A,Macak J M,et al.Phys.Stat.Sol.,2007,1(2):R65-R67
[12]Prakasam H E,Shankar K,Paulose M,et al.J.Phys.Chem.C,2007,111:7235-7241
[13]Paulose M,Prakasam H E,Varghese O K,et al.J.Phys.Chem.C,2007,111:14992-14997
[14]LAI Yue-Kun(赖跃坤),SUN Lan(孙岚),ZUO Juan(左娟),et al.Acta Phys.-Chim.Sin.(Wuli Huaxue Xuebao),2004,20(9):1063-1066
[15]NING Cheng-Yun(宁成云),WANG Yu-Qiang(王玉强),ZHENG Hua-De(郑华德),et al.Chem.Res.Appl.(Huaxue Yanjiu Yu Yingyong),2010,22(1):14-17
[16]LIANG Jian-He(梁建鹤),XIAO Xiu-Feng(肖秀峰),LIU Rong-Fang(刘榕芳),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(1):112-119
[17]Mor G K,Varghese O K,Paulose M,et al.J.Mater.Res.,2003,18(11):2588-2593
[18]Jae H L,Jinsub C.Small,2007,3(9):1504-1507
Preparation of TiO2Nanotube and Nanotube/Nanowire Composite Arrays by Temperature Control
CAI Fang-Gong1YANG Feng*,1ZHAO Yong1,2CHENG Cui-Hua2
(1Superconductivity R&D Center(SRDC),Key Laboratory of Advanced Technology of Materials
(M
inistry of Education of China),Mail Stop 165#,Southwest Jiaotong University,Chengdu 610031,China)
(2School of Materials Science and Engineering,University of New South Wales,Sydney,2052,NSW,Australia)
Morphology controllable TiO2nanostructures were fabricated on the Ti substrate in an ethylene glycol solution of 0.25wt%NH4F via anodic oxidation method at different temperatures(10~70 ℃).The morphology of TiO2films were studied by field emission scanning electron microscope(FESEM)and transmission electron microscope(TEM).The results show that the morphology of TiO2nanostructures can be synthesized by temperature control,such as the TiO2nanotube array or nanotube/nanowire composite film.Temperature between 40 and 50℃ is the turning area of changing nanotube to nanowire.
anodic oxidation;TiO2nanotube arrays;TiO2nanowire;composite structures
O614.41+1
A
1001-4861(2011)03-0504-05
2010-09-02。收修改稿日期:2010-11-17。
中央高校基本科研业务费专项资金(No.2009QK46,SWJTU09ZT24);国家自然科学基金(No.50588201,50872116)资助项目。
*通讯联系人。E-mail:yf@home.swjtu.edu.cn
猜你喜欢
杂志排行
无机化学学报的其它文章
- Synthesis,Crystal Structure and Cytotoxicity of Palladium(Ⅱ)Complexes with N-(4-methylbenzoyl)-L-valine Dianion and Aromatic Diimine
- Synthesis,Crystal Structure of Uranium-Potassium Heteronuclear Coordination Polymer
- Synthesis,Crystal Structure and Antibacterial Activity of Magnesium(Ⅱ)Complex with N-Benzenesulphonyl-L-phenylalanine and 1,10-Phenanthroline
- 盐湖卤水萃取提锂及其机理研究
- 氧化钛催化羟基磷灰石分解制备可降解磷酸钙陶瓷
- 菱镁矿风化石与叶腊石合成堇青石的结构表征
