饲料中的维生素E对大菱鲆幼鱼生长、脂肪过氧化及抗氧化能力的影响
2011-09-13魏玉婷王小洁麦康森艾庆辉
魏玉婷,王小洁,麦康森,艾庆辉
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
饲料中的维生素E对大菱鲆幼鱼生长、脂肪过氧化及抗氧化能力的影响
魏玉婷,王小洁**,麦康森,艾庆辉
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
采用6种维生素E(VE)含量为26、52、66、132、191、339 mg/kg饲料干质量的等氮等能实验饲料,研究饲料中维生素E对大菱鲆(Scophthalmus maximus)幼鱼生长,肝脏和肌肉中的硫代巴必妥酸反应底物(TBARS)含量、超氧化物歧化酶(SOD)活性及总抗氧化力(T-AOC)的影响。结果表明大菱鲆的生长和体成分受饲料中VE含量的影响产生的差异不显著,然而肝脏和血清中的VE含量以及肝脏和肌肉中的硫代巴必妥酸底物(TBARS)含量、超氧化物歧化酶(SOD)活性和肝脏总抗氧化力(T-AOC)则受其影响显著(P<0.05)。结果显示大菱鲆幼鱼摄取不适宜量的VE时在表现出各种缺乏症之前会先发生脂肪过氧化现象,同时饲料中的VE能够有效提高大菱鲆幼鱼的抗氧化能力。
大菱鲆幼鱼;维生素E;脂肪过氧化;抗氧化能力
大菱鲆(Scophthalmus maximus),分类上属于硬骨鱼纲(Osleichthyes),鲽形目(Pleuronectiformes),鲽亚目(Pleuronectoidei),鲆科(Bothidae),菱鲆属(Scophthalmus)。为原产于欧洲沿海的冷水性鱼类,其较高的经济价值使之成为欧洲重要的海水养殖良种之一,自上个世纪90年代引种到我国以来,已经在我国北方沿海地区大规模养殖,成为我国的1个新养殖品种[1-3]。目前,国内外有关大菱鲆营养生理的研究主要集中在大量营养元素的利用方面,如氨基酸、蛋白质和脂肪需要量[4-6],蛋白源和脂肪源替代[7-8]以及免疫增加剂的开发[9],而有关大菱鲆维生素的营养生理研究尚少见报道。
维生素E(VE)是鱼类的1种必需营养素,具有维持鱼肉质量、机体正常免疫、防止细胞溶血、毛细血管渗透、心肌渗透等功能[10]。VE作为脂溶性抗氧化剂,在体内参与清除氧自由基终止脂肪过氧化反应,这种脂肪过氧化反应可以激发细胞内包括膜、核酸、酶等不稳定成分的氧化损失,从而导致机体形成损伤。因此VE对水生动物体内抗氧化能力的影响一直是关注的热点[11-18]。本文旨在检测饲料中的VE对大菱鲆幼鱼生长、脂肪过氧化以及抗氧化能力的影响。
1 材料与方法
1.1 实验饲料设计
实验采用半精制饲料,基础饲料中各组分的含量如表1。其中脱脂鱼粉、脱脂虾粉是将商业鱼粉、虾粉用乙醇按1∶2的比例进行脱脂制成的,维生素预混物中未添加VE,每千克饲料中分别添加0、20、40、80、160、320 mg的DL-α-生育酚醋酸酯(Sigma公司),并以微晶纤维素填充,制成6种等氮等能的实验饲料。利用高效液相层析色谱(HPLC)测得实验饲料中实际α-生育酚的含量分别为26、52、66、132、191、339 mg/kg饲料干质量。在饲料制作过程中,所有原料粉碎后过220μm筛网,各原料按配比定量后混合均匀,然后加入适量的水揉匀,经双螺杆挤条机(华南理工大学研制的F-Ⅲ(26)型)加工成粒径为2.0 mm,长2~5 mm的颗粒状饲料,35℃烘箱烘干,用塑料袋装好密封后放于-20℃冰箱备用。
1.2 实验鱼及饲养管理
实验在山东省莱州市明波水产公司进行,实验鱼购自当地明波水产公司。在开始实验前,所有实验鱼置于2个300 L水族箱内暂养10 d,其间投喂基础饲料以适应实验饲料。选择体质量为(4.44±0.02)g的健康鱼苗540尾,随机分成6组,每组设3个重复,每个重复放鱼30尾。
实验鱼饲养在120 L的水族箱内,供水为常流水,水流量为6 L/min。实验期间,每天分别于07··30及16··30饱食投喂2次,实验持续8周,其间水温为17~19℃,盐度为27,p H在7.5~7.8之间,24 h曝气,溶氧含量大于7 mg/L,光周期为12 h光照∶12 h黑暗。

表1 基础饲料原料及营养组成(%干质量)Table 1 Ingredients and nutritional composition of control diet(%dry weight)
1.3 样品采集和分析
实验结束,饥饿24 h后称各水族箱内的鱼重,计算特定生长率(SGR)、饲料系数(FCR)、蛋白质效率(PER)。每箱随机取鱼5尾,留作鱼粗蛋白、粗脂肪、粗灰分分析;另随机取5尾鱼,从尾静脉取血,在4℃冰箱中静置24 h,然后3 000 r/min离心10 min取上清液即为血清,用于检测血清中的VE含量;取血后的鱼立即解剖分离肝脏、肌肉,-80℃保存于液氮中,用于检测组织中VE含量及硫代巴必妥酸反应底物(BARS)含量、超氧化物歧化酶(SOD)活性和总抗氧化力(T-AOC)。
饲料成分、实验饲料和鱼体样品的水分、蛋白、脂肪及灰分含量采用AOAC(1995)的方法进行分析。饲料及全鱼样品在105℃烘至恒重测定水分;蛋白质采用Kjeldahl全自动蛋白分析仪检测;脂肪采用Soxhlet脂肪抽提仪检测;灰分采用在马福炉中550℃燃烧失重法检测。血清中VE含量利用邵裕坤等[19]的高效液相色谱检测,肝脏及饲料中的VE含量参考Salo-Vä änänen等[20]的方法进行分析,即将抽提后的残渣溶于1 mL甲醇中上机检测,使用HP1100高效液相色谱仪,ODS反相色谱柱,甲醇∶异丙醇=95∶5为流动相,柱温25℃。肝脏和肌肉中的硫代巴必妥酸反应底物(TBARS)含量、超氧化物歧化酶(SOD)活性及总抗氧化力(T-AOC)均采用南京建成公司试剂盒,其中组织中硫代巴必妥酸反应底物用丙二醛(MDA)的含量表示。
1.4 数据处理与统计分析
生长数据、饲料系数、鱼体成分、各种抗氧化指标及组织中VE含量采用SPSS11.5软件进行单因素方差分析(One-way ANOVA),若差异显著,再进行Tukey's多重比较。
特定生长率(SGR)、饲料系数(FCR)、蛋白质效率(PER)计算公式如下:
特定生长率(SGR)=[ln(终末体质量)—ln(初始体质量)]/养殖时间×100;
饲料系数(FCR)=摄食量/体增质量;
蛋白质效率(PER)=(终末体质量×终末鱼尾数—初始体质量×初始鱼尾数)/(摄入干物质质量×饲料中蛋白质含量)。
2 实验结果
2.1 维生素E对大菱鲆生长的影响
饲料中不同浓度的VE对大菱鲆幼鱼的特定生长率、蛋白质效率、饲料系数及成活率均无显著性影响(P>0.05)(见表2),体蛋白含量为(67.05±1.12)%、脂肪含量为(11.80±1.46)%、灰分含量为(18.68± 1.17)%、水分含量为(78.24±0.67)%,各处理之间差异不显著(P>0.05)(见表3)。
2.2 维生素E对大菱鲆幼鱼脂肪过氧化及抗氧化力的影响
饲料中不同含量的VE对大菱鲆幼鱼肝脏、肌肉组织的脂肪过氧化、超氧化物歧化酶活性和肝脏总抗氧化力都产生显著影响(P<0.05),然而对肌肉总抗氧化力的影响不显著(P>0.05)(见表4)。肝脏和肌肉中的TBARS随着饲料中VE含量的升高显著降低,其中肝脏TABRS在D1处理组最高,且显著高于其他5组;肌肉TBARS含量在D6处理组显著低于D1~D4处理组,但D5~D6处理组间差异不显著。
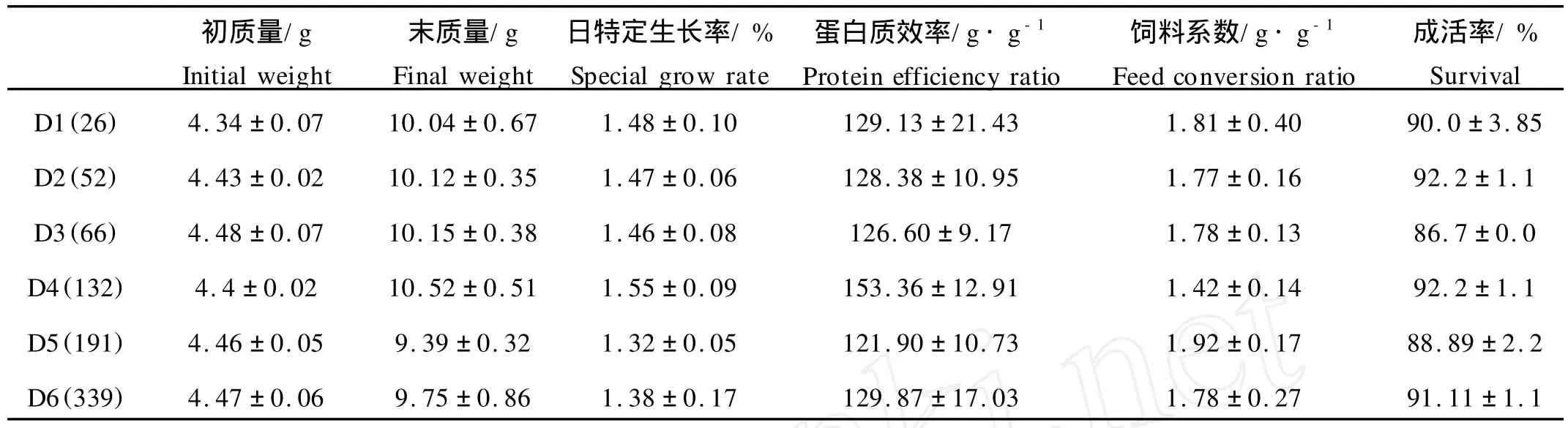
表2 饲料中不同浓度的维生素E对大菱鲆幼鱼生长的影响(平均值±标准误)Table 2 Effects of dietary vitamin E levels on growth and feed utilization in juvenile turbot(Means±S.E.)

表3 饲料中不同浓度的维生素E对大菱鲆幼鱼体成分的影响(平均值±标准误)Table 3 Effects of dietary vitamin E levels on whole body composition in juvenile turbot(Means±S.E.)/%
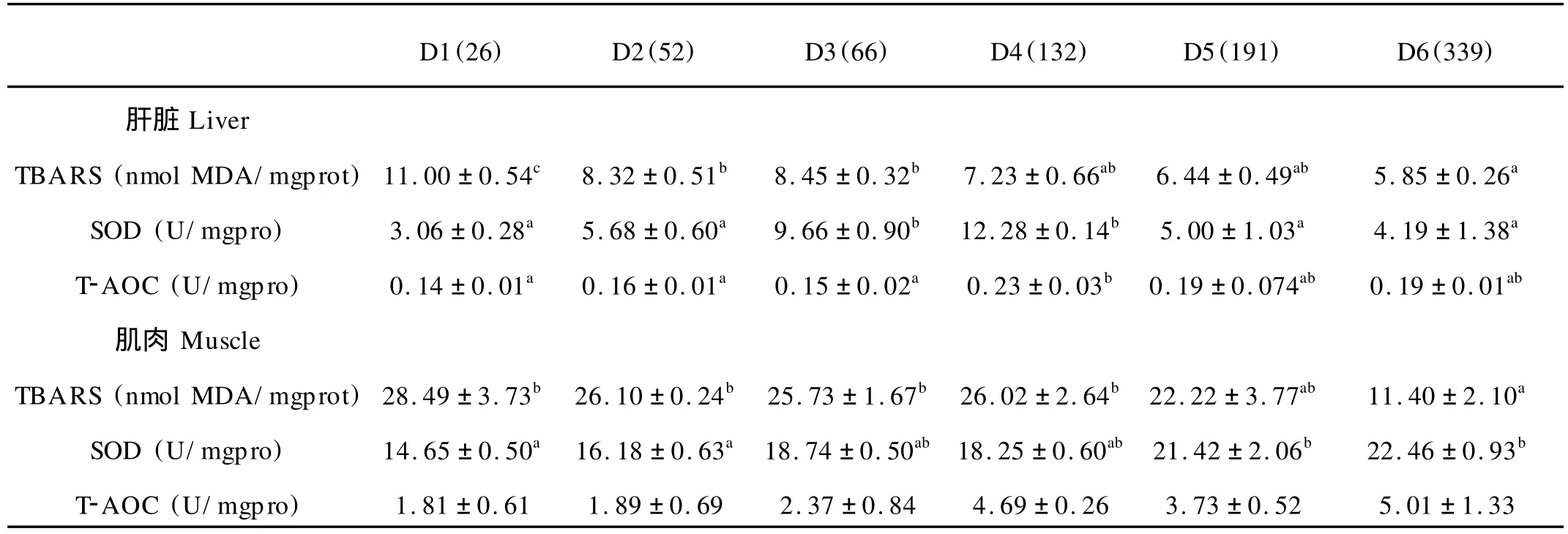
表4 饲料中不同浓度的维生素E对大菱鲆幼鱼肝脏和肌肉硫代巴必妥酸反应底物(TBARS)、超氧化物歧化酶(SOD)及总抗氧化力(T-AOC)的影响(平均值±标准误)Table 4 Effects of dietary vitamin E levels on hepatic and muscle thiobarbituric acid reactive substances(TBARS), superoxide dismutase(SOD)and total-antioxidantcapacity(T-AOC)in juvenile turbot(Means±S.E.)
肝脏中的SOD酶活力随着饲料VE的含量呈现先升高后降低的趋势,在D3和D4处理组达到最大值,显著高于其他4组;肌肉中的SOD酶活力随着饲料中VE含量的增加显著升高,在D5和D6处理组显著高于D1和D2处理组,D1~D4处理组间差异不显著,D5~D6处理组间差异不显著。肝脏的T-AOC在D4处理组显著高于D1~D3处理组,但与D5和D6处理组之间无显著性差异;肌肉中的总抗氧化力随着饲料中VE含量的增加而呈上升趋势(1.81~5.01 U/mg pro),但各组之间的差异不显著。
2.3 维生素E对大菱鲆血清及肝脏中的VE含量的影响
血清和肝脏组织中VE含量随着饲料中VE含量的升高而显著升高(P<0.05),当饲料中VE的含量低于132 mg/kg时,各组之间差异不显著,但VE含量为191和339 mg/kg时,肝脏和血清中VE含量显著高于其他处理组(见表5)。

表5 饲料中不同浓度的维生素E对大菱鲆幼鱼肝脏和血清中α-生育酚含量的影响(平均值±标准误)Table 5 Effects of dietary vitamin E levels on liver and serumα-tocopherol in juvenile turbot(Means±S.E.)
3 讨论
在本研究中,不同VE浓度的饲料并未对大菱鲆幼鱼的生长、饲料利用以及体成分产生显著影响,也未观察到如生长迟缓、死亡率升高、贫血、上皮色素损失、腹水、眼球突出、不集群等VE缺乏症出现[21]。然而从实验结果看,饲料中添加VE显著降低了大菱鲆幼鱼脂肪过氧化的程度,提高了大菱鲆幼鱼的抗氧化能力,说明脂肪过氧化和抗氧化酶活性要比生长、死亡率更敏感地反映鱼类的VE缺乏症状。水生动物体内通常含有较多的高不饱和脂肪酸,其组织尤其是富含不饱和脂肪酸的生物膜易发生过氧化反应[14]。脂肪过氧化最终产物丙二醛的量可敏锐的反映机体内脂质过氧化强弱[22],一分子丙二醛可以和两分子硫代巴必妥酸聚合,因此硫代巴必妥酸反应底物(TBARS)常用来作为评价组织脂肪过氧化的指标[12,14-15,17,23]。在对虹鳟[13]、杂交罗非鱼[14]、转基因银大马哈鱼[15]、斑点叉尾鮰[21]的研究中均证实在表现出生长差异之前,鱼体组织中都不同程度的发生了脂肪过氧化,而且饲料中添加VE可以减少鱼体组织中TBARS的含量,提高机体的抗氧化能力。
组织中的TBARS含量常被作为鱼类对VE需求量的评判依据[13,21,23],然而TBARS并不总是能真实反映出鱼类对VE的需求量。Cowey等[13]在未观察到生长差异的情况下,成功的利用肝小体的TBARS作为评价指标对虹鳟的VE需求量进行了估测,Lin和Shiau[23]用肝脏中TBARS含量作为估测指标获得的点带石斑鱼对VE需求量,与用生长作为估测指标获得的需要量相吻合;然而Kocabas和Gatlin[24]却得到了相反的结果,即在杂交条纹鲈的生长与饲料系数都受到VE影响的同时,脂肪过氧化反应却未受影响;在本实验中,大菱鲆幼鱼肝脏和肌肉中的TBARS含量随着饲料中VE含量的增加而线性降低(y=-0.013 3x+ 9.667 1,r2=0.716 2,肝脏;y=-0.050 7x+30.143, r2=0.919 1,肌肉)。因此TBARS虽然可以敏感地反映鱼类的VE缺乏症状,然而是否可以将它代替生长率作为评价鱼类VE需求量的指标,还需要进一步的研究。
机体防御体系的抗氧化能力可以用总抗氧化力(T-AOC)来表示,本实验中大菱鲆肝脏T-AOC随饲料中VE含量的增加而显著升高,并且尽管差异不显著,肌肉T-AOC也表现出上升的趋势,这表明饲料中添加VE能够提高机体的抗氧化能力,从而减少机体的氧化损伤程度。细胞正常的需氧代谢过程会连续不断地产生活性氧O-2,过量的O-2会对机体产生反作用,引起氧化损伤。VE是O-2的直接清除剂,与超氧化物歧化酶(SOD)同是体内抗氧化防御系统的重要组成成分,保护细胞膜及细胞内的核酸免受自由基的攻击。关于VE和SOD之间的相互关系已有研究报道,但至今并无统一的结论。朱勇飞等[25]发现高浓度VE(VE500、VE1000)处理组的黑鲷血清SOD活性显著高于低浓度VE(VE250)处理组,然而Tocher等[17]却发现金头鲷肝脏中的SOD活性在低浓度处理组(E10)显著高于高浓度处理组(E100和E1000);此外,Lee和Shiau等[18]发现斑节对虾血清SOD活性随饲料中VE浓度升高表现出先显著升高后又显著降低的趋势;而在皱纹盘鲍中发现,VE对血清中的SOD活力没有显著影响[26]。本实验中,肝脏和肌肉中的SOD活性随饲料中VE浓度变化表现出不同的变化趋势,肝脏的SOD活性呈现先上升后下降的趋势,然而肌肉SOD活力却随VE浓度升高而线性升高(y=0.023x+15.525,r2= 0.8115)。由此可见,饲料中VE和SOD活性的关系会受到实验动物种类、取样部位、其他抗氧化剂的含量等多种因素的影响。
SOD是底物诱导酶,它的活力升高说明体内O-2或羟自由基含量上升,从而导致动体内氧化压力过大[26]。因此,当饲料中VE含量小于大菱鲆的适宜需求量时,肝脏中VE浓度较低,TBARS含量高,氧化压力大,SOD活性会随着饲料中VE浓度的增加而升高;当饲料中VE含量足以满足大菱鲆需要时,肝脏中VE浓度升高,TBARS含量降低,氧化压力减小,SOD活性会随着饲料中VE浓度增加而降低。由此作者估测大菱鲆幼鱼VE的适宜需求量在66~132 mg/kg饲料干质量之间。
综上所述,饲料中的VE能够有效地提高大菱鲆幼鱼的抗氧化能力。当大菱鲆幼鱼摄取非适宜量的VE时,在表现出各种VE缺乏症之前会发生脂肪过氧化现象。根据饲料中不同添加量的VE对大菱鲆幼鱼肝脏SOD活性的影响估测,大菱鲆幼鱼对VE的需求量大约在66~132 mg/kg饲料干质量之间。
[1] 雷霁霖.大菱鲆养殖技术[M].上海:上海技术出版社,2003.
[2] 陈慕雁,张秀梅,连建华.大菱鲆仔稚鱼期消化酶及碱性磷酸酶活性的变化[J].中国海洋大学学报:自然科学版,2005,35(3): 483-486.
[3] 李筠,颜显辉,陈吉祥,等.养殖大菱鲆腹水病病原的研究[J].中国海洋大学学报:自然科学版,2006,36(4):649-654.
[4] Lee J K,Cho S H,Park S U,et al.Dietary protein requirement for young turbot(Scophthalmus maximusL.)[J].Aquaculture Nutrition,2003,9:283-286.
[5] Cho S H,Lee S M,Lee S M,et al.Effect of dietary protein and lipid levels on growth and body composition of juvenile turbot (Scophthalmus maximusL)reared under optimum salinity and temperature conditions[J].Aquaculture Nutrition,2005,11(4): 235-240.
[6] Peres H,Oliva-Teles A.Lysine requirement and efficiency of lysine utilization in turbot(Scophthalmus maximus)juveniles[J]. Aquaculture,2008,275:283-290.
[7] 陈京华.米曲霉AS 3.951发酵豆粕对大菱鲆摄食生长的影响[J].中国农学通报,2009,25(02):277-282.
[8] Peres H,Oliva-Teles A.The effect of dietary protein replacement by crystalline amino acid on growth and nitrogen utilization of turbotScophthalmus maximusjuveniles[J].Aquaculture,2005, 250:755-764
[9] 郝林华,孙丕喜,石红旗,等.牛蒡寡糖对大菱鲆生长和免疫机能的影响[J].海洋科学进展,2007,25(2):208-214.
[10] Halver J E.The vitamins.Fish nutrition[M].San Diego:Academic Press,2002:61-141.
[11] Huang C H,Huang S L.Effect of dietary vitamin E on growth, tissue lipid peroxidation,and liver glutathion level of juvenile hybrid tilapia,Oreochromis niloticus×O.aureus,fed oxidized oil [J].Aquaculture,2004,237:381-389.
[12] Sau S K,Paul B N,Mohanta K N,et al.Dietary vitamin E requirement,fish performance and carcass composition of rohu (L abeo rohita)fry[J].Aquaculture,2004,240:359-368.
[13] Cowey C B,Adron J W,Walton M J,et al.Tissue distribution, uptake,and requirement forα-tocopherol of rainbow trout(Salmo gairdneri)fed diets with a minimal content of unsaturated fatty acids[J].Journal of Nutrition,1981,111:1556-1567.
[14] Huang C H,Chang R J,Sue-Lan,et al.Dietary vitamin E supplementation affects tissue lipid peroxidation of hybrid tilapia, Oreochromis niloticus×O.aureus[J].Comparative Biochemistry and Physiology,Part B,2003,134:265-270.
[15] Huang C H,Higgs D A,Balfry S K,et al.Effect of dietary vitamin E level on growth,tissue lipid peroxidation,and erythrocyte fragility of transgenic coho salmon,Oncorhynchus kisutch[J]. Comparative Biochemistry and Physiology,Part A,2004,139: 199-204.
[16] Baker R T M,Davies S J.Oxidative nutritional stree associated with feeding rancid oils to African catfish,Clarias gariepinus (Burchell)and the protective role ofα-tocopherol[J].Aquaculture Research,1996,27(10):795-803.
[17] Tocher D R,Mourente G,Eecken A V D,et al.Effects of dietary vitamin E on antioxidant defence mechanisms of juvenile turbot (Scophthalmus maximusL.),halibut(Hippoglossus hippoglossusL.)and sea bream(S parus aurataL.)[J].Aquaculture Nutrition,2002,8:195-207.
[18] Lee M H,Shiau S Y.Vitamin E requirements of juvenile grass shrimp,Penaeus monodon,and effects on non-specific immune responses[J].Fish&Shellfish Immunology,2004,16:475-485.
[19] 邵裕坤,徐军,王珏.反相高效液相色谱法同时测定血清中维生素A,D3,E[J].中国现代应用药学杂志,2005,22(6):503-505.
[20] Salo-Vä änänen P,Ollilainen V,Mattila P,et al.Simultaneous HPLC analysis of fat-soluble vitamins in selected animal products after small-scale extraction[J].Food Chemistry,2000,71:535-543.
[21] Wilson R P,Bowser P R,Poe W E.Dietary vitamin E requirement of fingerling Channel Catfish[J].Journal of Nutrition, 1984,114:2053-2058.
[22] Musalmah M,Fairuz A H,Gapor M T,et al.Effect of vitamin E on plasma malondialdehyde,antioxidant enzyme levels and the rates of wound closures during wound healing in normal and diabetic rats[J].Asia Pacific J Clin Nutr,2002,11:448-451
[23] Lin Y H,Shiau S Y.Dietary vitamin E requirement of grouper, Epinephelus malabaricus,at two lipid levels,and their effects on immune responses[J].Aquaculture,2005,248:235-244.
[24] Kocabas,Gatlin III.Dietary vitamin E requirement of hybrid striped bass(Morone chrysopsfemale×M.saxatilismale)[J]. Aquaculture Nutrtition,1999,5(1):3-7.
[25] 朱勇飞,吴天星,张晓东.饲料维生素E对黑鲷抗氧化能力和鱼肉货架期的影响[J].水生态学杂志,2009:2(3):131-135
[26] 万敏,麦康森,马洪明,等.硒和维生素E对皱纹盘鲍血清抗氧化酶活力的影响[J].水生生物学报,2004,28(5):496-503.
Abstract: This study was conducted to investigate the effects of dietary vitamin E on growth performance,thiobarbituric acid reactive substances(TBARS),superoxide dimutase(SOD)activity and total-antioxidantcapacity(T-AOC)in liver and muscle tissue of juvenile turbot(Scophthalmus maximus).The juvenile turbot were fed with six isoenergetic and isonitrogenous experimental diets that contained 26,52, 66,132,191,339 mg of vitamin E/kg respectively.Following the 8-week feeding trial,no significant(P >0.05)diet-related differences were detected in growth and whole body proximate composition.The vitamin E concentration in liver and serum,thiobarbituric acid reactive substances(TBARS),superoxide dismutase(SOD)activity of liver and muscle,and total antioxidant capacity(T-AOC)of liver,however, were significantly affected by the dietary treatment(P<0.05).The results indicated that changes in tissue lipid peroxidation measurements precede clinical signs of sub-optimal vitamin E intake.In addition, vitamin E in diet could promote the antioxidant capacity of juvenile turbot effectively.
Key words: turbot;vitamin E;lipid peroxidation;antioxidant capacity
责任编辑 于 卫
Effect of Dietary Vitamin E on Growth,Tissue Lipid Peroxidation,and Tissue Antioxidant Capacity of Juvenile Turbot,Scophthalmus maximus
WEI Yu-Ting,WAN G Xiao-Jie,MAI Kang-Sen,AI Qing-Hui
(The Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China)
S963
A
1672-5174(2011)06-045-06
公益性行业(农业)科研专项经费(Nyhy.207-046)资助
2010-04-14;
2010-06-25
魏玉婷(1985-),女,硕士生。E-mail:yutingwei0028@sina.com
通迅作者:E-mail:xjwang@ouc.edu.cn
