老年前列腺癌去势治疗对血清脂联素及颈动脉内膜-中层厚度的影响
2011-09-12周萍富路王秋军高倩萍
周萍 富路 王秋军 高倩萍
研究表明,动脉粥样硬化(AS)和心血管疾病发病率升高与雄激素水平低下有关,睾酮可能参与了动脉粥样硬化的各个环节,如血脂代谢、凝血功能、炎症因子等[1-2],颈动脉内膜-中层厚度(IMT)是全身动脉粥样硬化的窗口,本文通过对前列腺癌去势治疗患者的横断面研究,探讨内源性睾酮缺失对AS危险因素及颈总动脉IMT的影响。
1 材料与方法
1.1 对象及分组 横断面研究,研究对象分3组:(1)2005年1月至2009年1月在我院泌尿外科明确诊断原发性局限性前列腺癌并行前列腺及睾丸全切≥1年的老年患者32例,年龄68~77岁,平均(72.5±6.62)岁。经胸部X线、腹部B超、血液生化、前列腺特异性抗原(PSA)、肿瘤抗原因子、骨扫描等检查除外其他部位恶性肿瘤及前列腺癌转移(CAS组);(2)同期单纯前列腺肥大局部前列腺切除患者32例(PH组),年龄 65~75岁,平均(69.5±5.91)岁;(3)年龄匹配的对照组30例,年龄68~75岁,平均(70.5±4.83)岁。所有入选对象均无糖尿病史,除外恶性肿瘤、急性感染、心力衰竭、创伤、肝肾功能不全及贫血等疾病。
1.2 主要试剂和实验仪器 总睾酮(TT)、游离睾酮(FT)、雌二醇(E2)、内皮素-1(ET-1)用放射免疫法(试剂盒北京华英生物公司提供),一氧化氮(NO)用硝酸还原酶法测定(试剂盒由南京建成生物工程研究所提供),脂联素(Adip)用夹心法测定(试剂盒由美国R&D公司提供);心脏彩色多普勒超声仪(VIVID FIVE US GE公司)。
1.3 血液标本采集及生化指标测定 所有对象禁食12 h后相同条件下由专人测量身高、体质量、血压、腰围(肋弓下缘和髂骨棘最高点连线的中点)、臀围(股骨大转子水平),计算体质量指数[BMI=体质量(kg)/身高2(m2)]和腰臀比[WHR=腰围(cm)/臀围(cm)];清晨6:00取空腹静脉血6 ml收集血清,送生化室检测血脂、血糖等,其余血清冻存于-80℃待测。
1.4 颈动脉检测 受试者休息15 min后平卧,头颈仰伸暴露颈总动脉,自颈动脉起始部作纵向及横向检查,依次显示颈总动脉、分叉部及分叉远端约2 cm范围内的颈内和颈外动脉,测量颈总动脉(距分叉部位下1 cm)IMT,取双侧平均值作为测量值。如颈动脉分叉部位下1~2 cm处有斑块,则在斑块近端邻近位置进行测量,取3次测量平均值。
1.5 统计学方法 所有数据用SPSS 13.0软件进行统计分析,计量资料用±s表示,组间均数比较采用单因素方差分析(One way ANOVA),相关检验用Pearson相关分析,P<0.05为有统计学意义。
2 结果
2.1 研究对象的一般资料比较 3组间平均年龄、吸烟史、BMI、血压、空腹血糖无统计学意义(P>0.05);CAS组与对照组比较血清TT、FT水平明显降低(P<0.01),PH组和对照组睾酮水平在正常范围;CAS组与对照组比较,WHR显著增高(P<0.05)、脂蛋白(a)[Lp(a)]水平增高(P<0.05)、三酰甘油(TG)水平增高(P<0.01)。见表1。
表1 3组间激素水平及代谢指标一般情况比较(±s)
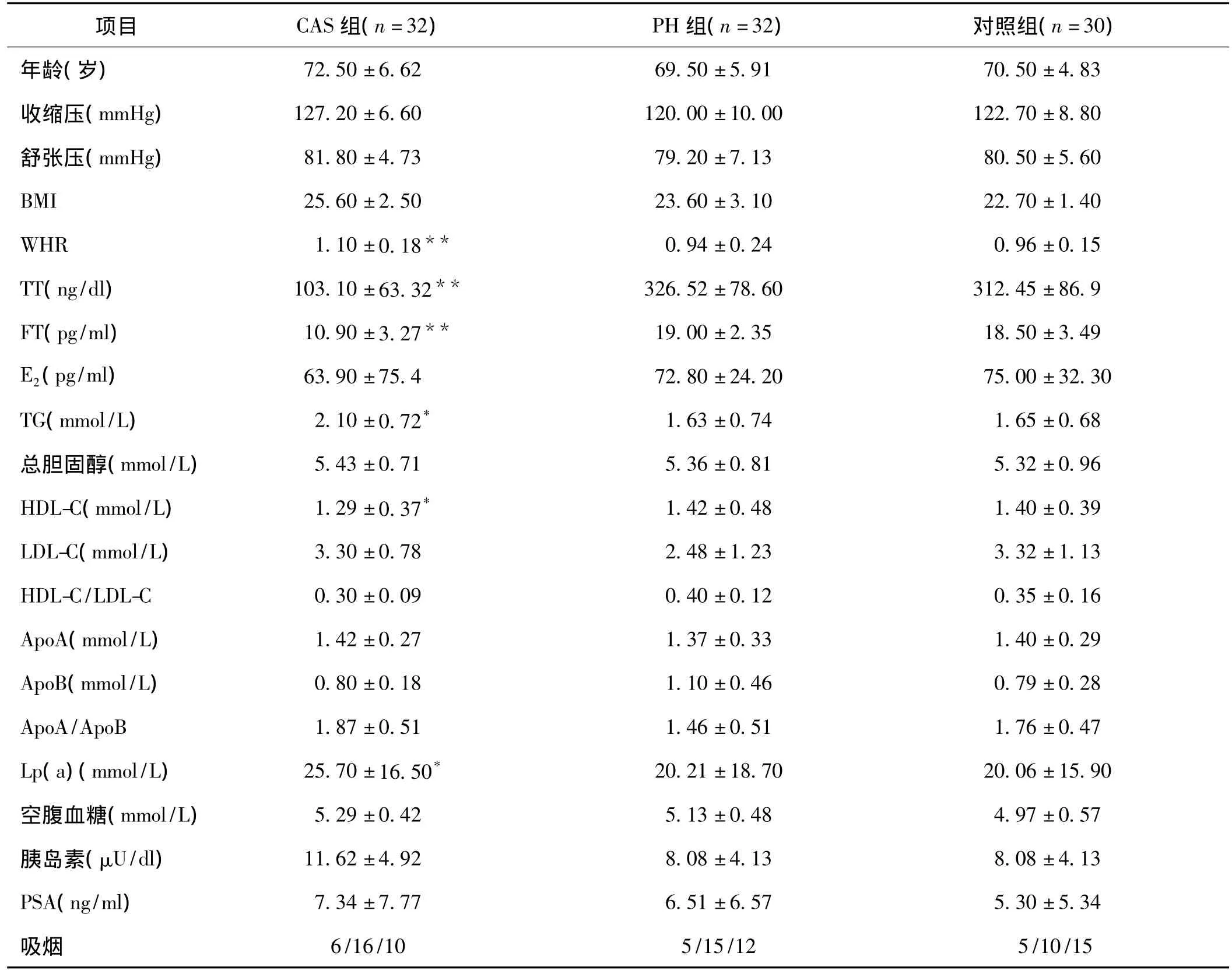
表1 3组间激素水平及代谢指标一般情况比较(±s)
注:HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;ApoA:载脂蛋白A;ApoB:载脂蛋白B;与对照组比较,*P<0.05,**P<0.01
2.2 去势对Adip、ET-1、NO及IMT的影响 CAS组与对照组比较NO水平增高[(103.70±29.90)μmol/L比(84.78±24.90)μmol/L,P <0.01],IMT 增厚[(0.94±0.09)mm比(0.84±0.08)mm,P <0.05],ET-1水平组间无明显差异(P>0.05);Adip降低[(1.43±0.59)mg/L比(2.18±0.86)mg/L,P <0.05]。见表2。
表2 3组NO、ET-1、Adip、IMT比较(±s)

表2 3组NO、ET-1、Adip、IMT比较(±s)
注:与对照组比较,*P <0.05,**P <0.01
组别 NO(μmol/L) ET-1(pg/ml) IMT(mm) Adip(mg/L)CAS组(n=32) 103.70±29.90** 63.70±20.80 0.94±0.09* 1.43±0.59*PH组(n=32) 94.76±26.80* 68.40±19.40 0.89±0.13 2.48±1.23对照组(n=30) 84.78±24.90 66.40±16.40 0.84±0.08 2.18±0.86
2.3 相关性分析 Pearson相关分析显示IMT分别与FT负相关(r=-0.382,P=0.04)、与 Adip负相关(r=-0.623,P=0.01),与 ET-1 正相关(r=0.527,P=0.036);此外,Adip分别与 TT和 FT正相关(r=0.706,P=0.002 和 r=0.535,P=0.033),与 IMT 负相关(r=-0.623,P=0.01)。
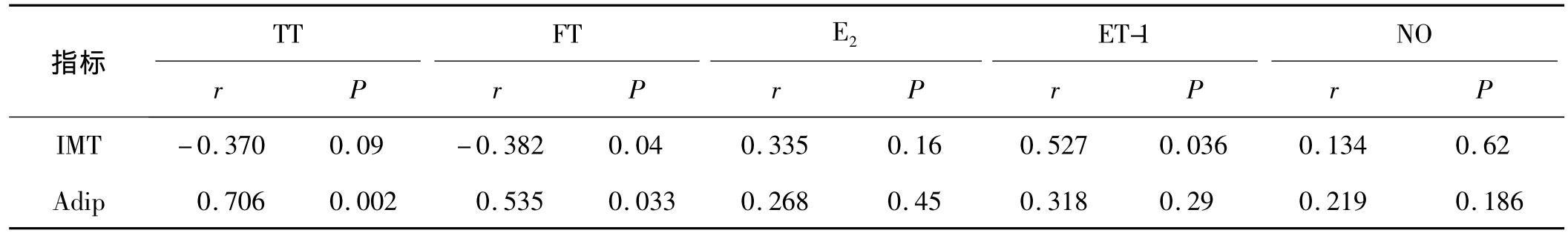
表3 IMT及Adip与性激素之间的Pearson相关分析
3 讨论
前列腺癌是老年男性常见肿瘤,去势疗法常用于治疗局限和转移性前列腺癌,是导致男性性腺功能减退的典型模型,性腺功能减退的男性具有较高的心血管疾病死亡率,不依赖于多种危险因素和若干环境条件[3-4],English 等[5]研究发现,男性冠心病患者血清生物有效性睾酮及FT指数显著低于非冠心病男性患者,推测睾酮可能参与AS的发生和发展。
颈动脉AS是全身AS的一个缩影,主要表现为颈动脉内膜增厚、不光滑、局限性隆起,颈动脉超声检测颈动脉IMT及斑块积分是临床定量评价AS严重程度的无创方法[6],关于睾酮与颈动脉IMT关系的报道不完全一致,Hak等[4]根据主动脉钙化积分判定AS程度,研究内源性激素与老年人AS关系,结果表明老年男性血清TT与AS显著独立负相关;Makinen等[7]研究显示男性更年期人群颈动脉粥样硬化程度增加;Fukui等[8]研究血清睾酮水平和2型糖尿病男性颈动脉IMT关系发现,血清FT与颈动脉IMT负相关,经多元回归分析发现,仅FT、收缩压与颈动脉IMT独立相关,TT与颈动脉IMT及前列腺炎综合征无明显相关。本研究结果显示,老年前列腺癌去势治疗后与正常对照组比较颈动脉IMT明显增厚(P<0.05),且分别与FT负相关(P<0.05)、与 Adip负相关(P<0.01),与ET正相关(P<0.05),进一步证明睾酮水平降低可能直接参与AS的发生和发展,而生理水平的睾酮对男性心血管系统有保护作用。
此外,本研究显示,去势后反应血管内皮功能的指标NO水平增高,而ET-1水平未见明显变化,去势组Adip水平较对照组明显降低,且与TT和FT水平正相关,同时,Adip与 IMT正相关。据 Kistorp等[9]报道,血清Adip可作为心血管疾病患者的独立危险预报因子之一。目前已经了解的Adip对血管结构和功能的影响有:增强内皮依赖性血管舒张;抑制动脉硬化;抑制血管黏附分子清道夫受体的表达;降低肿瘤坏死因子水平等,提高体内血浆Adip水平可抑制动脉粥样硬化的发展。Adip作为所有脂肪细胞因子中唯一负性调节激素,在血液中相对较高浓度循环,具有抗炎症、抗糖尿病、抗AS等特性,内脏肥胖患者Adip循环浓度减少,不仅引起胰岛素抵抗和高血糖,也可以导致内皮血管功能紊乱。而Adip在血液中的浓度存在性别差异,女性较男性高[10],睾酮对Adip影响的报道存在很多争议和矛盾,有正性报道[10-11],认为睾酮替代治疗可增加性功能低下患者 Adip的水平,有负性报道[12-13],认为雄激素降低血浆Adip,雄激素诱导的低Adip血症可能与男性高危险胰岛素抵抗和AS相关,原因可能与体内睾酮的基础水平不同有关,而睾酮对Adip的影响是直接作用的结果还是体内脂肪重新分布的间接影响,目前尚无定论。但无论男性还是女性,Adip都与性激素结合蛋白明显正相关[10]。因此推测,睾酮可能通过对NO及Adip等的作用参与调节AS的发生和发展。
[1]Wu FC,von Eckardstein A.Androgens and coronary artery disease[J].Endocr Rev,2003,24(2):183-217.
[2]刘俊,王洪巨,杨红,等.老年男性血清性激素水平与冠状动脉粥样硬化程度的关系[J].实用老年医学,2007,21(6):413-416.
[3]Laughlin GA,Barrett-Connor E,Bergstrom J.Low serum testosterone and mortality in older men[J].J Clin Endocrinol Metab,2008,93(1):68-75.
[4]Hak AE,Witteman JC,de Jong FH,et al.Low levels of endogenous androgens increase the risk of atherosclerosis in elderly men:the Rotterdam study[J].J Clin Endocrinol Metab,2002,87(8):3632-3639.
[5]English KM,Mandour O,Steeds RP,et al.Men with coronary artery disease have lower levels of androgens than men with normal coronary angiograms[J].Eur Heart J,2000,21(11):890-894.
[6]Bots ML,Hoes AW,Koudstaal PJ,et al.Common carotid intima-media thickness and risk of stroke and myocardial infarction:the Rotterdam Study[J].Circulation,1997,96(5):1432-1437.
[7]Makinen J,Järvisalo MJ,Pöllänen P,et al.Increased carotid atherosclerosis in andropausal middle-aged men[J].J Am Coll Cardiol,2005,45(10):1603-1608.
[8]Fukui M,Soh J,Tanaka M,et al.Low serum testosterone concentration in middle-aged men with type 2 diabetes[J].Endocr J,2007,54(6):871-877.
[9]Kistorp C,Faber J,Galatius S,et al.Plasma adiponectin,body mass index,and mortality in patients with chronic heart failure[J].Circulation,2005,112(12):1756-1762.
[10]Yasui T,Tomita J,Miyatani Y,et al.Associations of adiponectin with sex hormone-binding globulin levels in aging male and female populations[J].Clin Chim Acta,2007,386(1/2):69-75.
[11]Lanfranco F,Zitzmann M,Simoni M,et al.Serum adiponectin levels in hypogonadal males:influence of testosterone replacement therapy[J].Clin Endocrinol(Oxf),2004,60(4):500-507.
[12]Page ST,Herbst KL,Amory JK,et al.Testosterone administration suppresses adiponectin levels in men[J].J Androl,2005,26(1):85-92.
[13]Nishizawa H,Shimomura I,Kishida K,et al.Androgens decrease plasma adiponectin,an insulin-sensitizing adipocytederived protein[J].Diabetes,2002,51(9):2734-2741.
