米力农雾化吸入、静脉泵入对体外循环肺损伤的预防效果及机制探讨
2011-09-05郭宏伟王武军廖崇先单忠贵朱壮辉
郭宏伟,王武军*,廖崇先,杨 谦,单忠贵,邱 风,朱壮辉
(1南方医科大学南方医院,广州 510515;2厦门心脏中心)
体外循环所致炎症反应及缺血再灌注损伤是体外循环所致肺损伤的重要原因,临床上常导致术后肺功能障碍[1~3],特别是术前合并肺动脉高压的患者其后果更为严重,已成为患者术后死亡的重要原因。米力农是一种特异性磷酸二酯酶抑制剂,临床上认为其有扩张肺血管,增加心排量的作用。近年来,其脏器保护作用日益受到重视。2010年4~11月,我们观察了米力农对体外循环所致肺损伤的影响,并比较雾化吸入及静脉用药两种给药途径的差异。现报告如下。
1 资料与方法
1.1 临床资料 45例风湿性瓣膜病患者,男16例,女29例,年龄25~69岁,体质量43~81 kg,术前无感染性疾病史,未合并全身其他系统严重疾病,未使用糖皮质激素及其他影响免疫功能的药物,并按Jones诊断标准排除风湿活动,瓣膜重度狭窄患者不纳入本研究。本研究已经医院伦理委员会批准并取得患者或其家属知情同意。随机分为雾化吸入组(M组)、静脉组(V组)、对照组(C组),各15例。
1.2 米力农应用及观察方法 M组于术前48 h以生理盐水5 ml加米力农注射液5 mg缓慢雾化吸入,1次/8 h。V组于术前48 h每24 h静脉泵入米力农注射液15 mg,生理盐水稀释成50 ml,2 ml/h持续静脉泵入。C组术前不做药物处理。
全组均在静吸复合麻醉下手术。经右侧颈内静脉置入Swan-Ganz漂浮导管,连接Edwads Vigilance血流动力学监测仪备用。采用中度低温(鼻咽温度26~31℃)非搏动性灌注,中度血液稀释,红细胞压积(HCT)20% ~29%,灌注流量为 2.2~2.8 L/(min·m),体外循环过程中维持平均动脉压于50 ~80 mmHg。
于麻醉诱导后切皮前(T0)、主动脉开放后30 min(T1)、术毕(T2)、术后 24 h(T3)、72 h(T4)及术后7 d(T5)6个时点抽取动、静脉血各1 ml分别送检血常规,并抽取动脉血4 ml,EDTA抗凝,3000 r/min离心15 min,取上层血浆置于-75℃冰箱冻存待测。用ELISA法测定样本中肿瘤坏死因子(TNF-α)、白细胞介素-6(IL-6)、人髓过氧化物酶(MPO)、超敏C反应蛋白(HSCRP)水平;用硫代巴比妥法测定丙二醛(MDA);于前5个时点行动脉血气分析,并经Swan-Ganz导管测量平均肺动脉压(MPAP)、肺毛细血管楔压(PCWP),计算肺血管阻力(PVR)和氧合指数(OI)。PVR=80×(MPAPPCWP)/CO;OI=PaO2/FiO2。计算静脉血与动脉血白细胞计数比值(V/A)。
1.3 统计学方法 采用SPSS13.0统计软件。所测得 TNF-α、IL-6、HSCRP、MPO、MDA、WBC 值通过HCT进行校正后行统计学处理,校正值=测定值×转流前HCT/测定时HCT。计量资料以表示。组间比较采用成组t检验,组内不同时点比较采用配对t检验。P≤0.05为差异有统计学意义。
2 结果
全组手术顺利,无围术期死亡。三组患者围术期各时点 PVR 及 OI见表 1,血浆 TNF-α、IL-6、HSCRP、MDA、MPO活性及V/A见表2。
表1 三组患者各时点PVR和OI比较(n=15,)
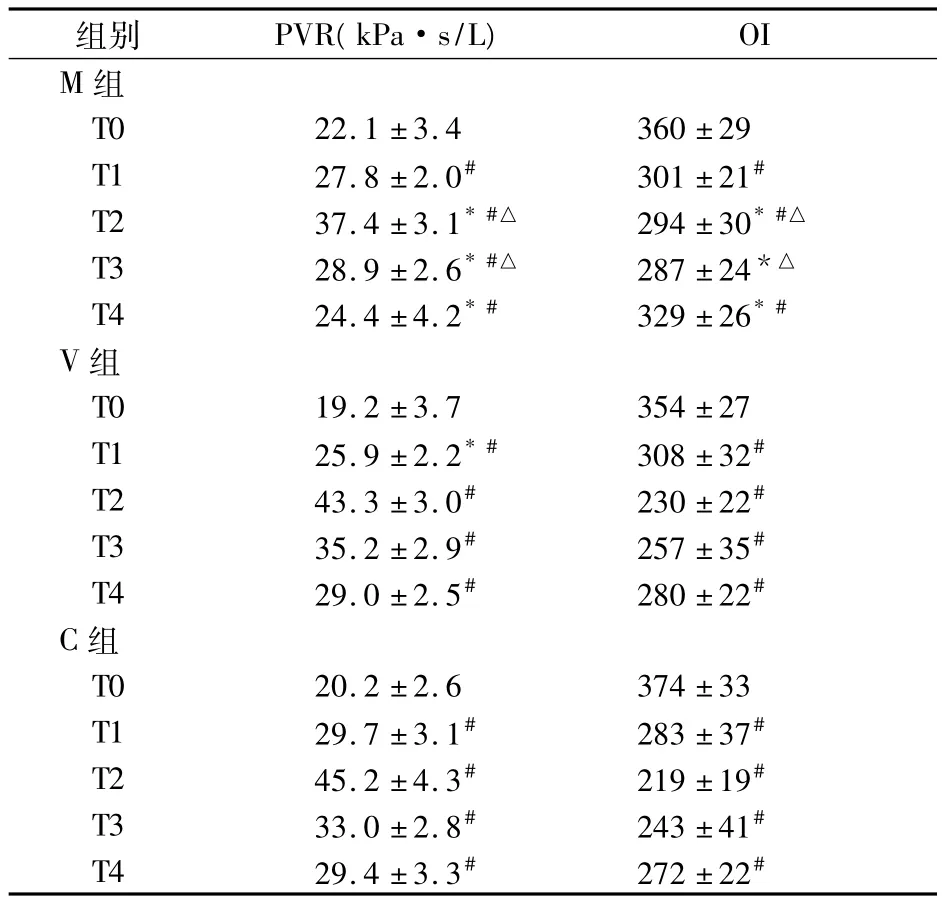
表1 三组患者各时点PVR和OI比较(n=15,)
注:与 C组相比,*P<0.05;与 T0比较,#P<0.05;与 V 组相比,△P <0.05
组别 PVR(kPa·s/L)OI M 组T0 22.1 ±3.4 360 ±29 T1 27.8 ±2.0# 301 ±21#T2 37.4 ±3.1*#△ 294 ± 30*#△T3 28.9 ±2.6*#△ 287 ±24*△T4 24.4 ±4.2*# 329 ±26*#V组T0 19.2 ±3.7 354 ±27 T1 25.9 ±2.2*# 308 ±32#T2 43.3 ±3.0# 230 ±22#T3 35.2 ±2.9# 257 ±35#T4 29.0 ±2.5# 280 ±22#C组T0 20.2 ±2.6 374 ±33 T1 29.7 ±3.1# 283 ±37#T2 45.2 ±4.3# 219 ±19#T3 33.0 ±2.8# 243 ±41#T4 29.4 ±3.3# 272 ±22#
表2 三组患者各时点 TNF-α、IL-6、HSCRP、MDA、MPO 浓度及 V/A 比较(n=15,)

表2 三组患者各时点 TNF-α、IL-6、HSCRP、MDA、MPO 浓度及 V/A 比较(n=15,)
注:与 C 组相比,*P <0.05;与 T0相比,#P <0.05;与 V 组相比,△P <0.05
组别 TNF-α(pg/ml) IL-6(pg/ml) HSCRP(mg/l) MDA(mmol/l) MPO(ng/ml)V/A M 组T0 20.2 ±7.0 175.0 ±17.7 0.90 ± 0.06 8.3 ±1.4 41.2 ± 5.5 0.98 ±0.06 T1 24.5 ±3.3 212.0 ±21.3*# 0.99 ± 0.10 10.2 ±2.6*#△ 85.1 ±11.2*△ 1.11 ±0.08#△T2 60.4 ±4.5*# 293.0 ±27.8*# 1.01 ± 0.11 18.4 ±2.2*#△ 134.4 ±19.8*#△ 1.12 ±0.11*#△T3 57.7 ±6.2# 384.0 ±34.1*#△ 82.47 ±12.10*# 17.6 ±3.1*#△ 142.0 ±28.4*#△ 1.07 ±0.07*△T4 29.0 ±5.5*# 311.0 ±40.1*#△ 33.41 ± 4.38*# 13.7 ±2.8*#△ 119.0 ±17.4# 1.01 ±0.13 T5 18.3 ±4.6* 233.0 ±28.9# 9.54 ± 3.39*# 9.0 ±2.3 65.3 ± 8.9 1.06 ±0.06 V组T0 21.2 ±5.5 177.7 ±13.9 0.93 ± 0.07 7.8 ±2.0 45.4 ± 3.2 1.03 ±0.07 T1 22.5 ±2.8* 200.5 ±17.3*# 0.90 ± 0.12 15.1 ±2.0# 95.1 ± 9.8# 1.01 ±0.06*T2 54.5 ±4.5*# 305.0 ±24.0*# 0.98 ± 0.11 22.3 ±3.0# 173.3 ±13.0# 1.28 ±0.12*#T3 47.8 ±4.9*# 442.9 ±27.1*# 77.28 ± 9.12*# 21.3 ±3.6# 177.7 ±28.1# 1.22 ±0.07#T4 32.0 ±4.4*# 372.0 ±33.1# 28.15 ± 6.22*# 17.0 ±2.7# 110.0 ±14.5# 1.08 ±0.08 T5 23.6 ±5.9* 250.6 ±34.7# 12.33 ± 4.27*# 7.9 ±2.5 66.9 ± 8.8# 1.04 ±0.05 C组T0 18.4 ±5.1 182.0 ±19.1 0.89 ± 0.11 8.9 ±2.0 44.3 ± 7.2 1.05 ±0.03 T1 27.8 ±4.5# 257.0 ±29.4# 1.06 ± 0.07 14.2 ±2.2# 92.0 ± 8.0# 1.13 ±0.12#T2 79.1 ±6.7# 346.0 ±31.0# 0.94 ± 0.07 20.9 ±1.4# 189.5 ±23.1# 1.37 ±0.09#T3 55.6 ±8.8# 526.0 ±28.8# 121.4 ±18.34# 23.8 ±2.5# 177.8 ±19.7# 1.25 ±0.07#T4 40.2 ±7.8# 398.0 ±33.7# 61.33 ± 7.93# 17.7 ±4.1# 122.4 ±26.6# 1.06 ±0.12 T5 28.3 ±6.9# 275.0 ±27.2# 20.12 ± 5.47# 8.3 ±2.8 74.5 ±11.1#1.00 ±0.07
3 讨论
体外循环所致的肺损伤主要由全身炎症反应和肺缺血再灌注损伤引起。中性粒细胞在肺内聚集、活化是体外循环所致肺损伤的中心环节[4]。可诱发肺水肿及术后呼吸功能障碍[5,6]。
文献报道,肺缺血期间血管内皮细胞中环磷酸腺苷(cAMP)含量逐渐减少,而细胞内cAMP的水平与再灌注后肺血管内皮屏障功能的完整性高度相关[7]。激活腺苷酸环化酶,抑制磷酸二酯酶(PDE)或加入cAMP的类似物,都能增加细胞—细胞、细胞—基质之间的连接,减少细胞间缝隙形成,降低血管内皮通透性[8~11]。
炎症介质是体外循环肺损伤的根源[5]。体外循环可引起炎性介质增多。TNF-α可活化多种促炎因子,可使中性粒细胞呼吸爆发产生氧自由基,引起中性粒细胞与内皮细胞黏附增加,造成肺损伤[12];IL-6可刺激 CRP、TNF-α、IL-1 的释放,还能促进中性粒细胞释放,抑制其凋亡[13],从而加重中性粒细胞的致炎作用。HSCRP是一种急性时相蛋白,其变化与炎症的发生、发展及预后密切相关[14]。本研究结果显示三组患者TNF-α、IL-6、HSCRP活性在体外循环后均有不同程度升高。M组的TNF-α在T2、T4、T5低于C组,C组的 IL-6在 T1~T4高于 M组,V组术后各时点TNF-α均较C组低,且其IL-6在T1~T3亦低于C组,表明体外循环过程中确实发生了炎症反应,而米力农具有抗炎作用。
笔者推测,米力农发挥抗炎作用的机理可能是通过增加细胞内cAMP的水平起到增强心肌收缩力、扩张肺血管的作用,使得白细胞加速通过肺循环,减少其在肺内滞留,从而减轻其局部激活并释放炎性介质所导致的肺血管内皮损伤。本研究中M组V/A显著低于C组,而V组炎症介质的浓度虽然降低,但其V/A与对照组相比并无显著差异,表明减少白细胞在肺内的聚集、释放炎症介质是米力农抗炎作用的机制之一。此外,有研究表明,炎症细胞内的cAMP浓度增加亦可抑制炎性细胞的活性从而抑制炎症反应的程度。MPO是反映组织中炎性反应的重要指标。本研究结果显示M组再灌注后MPO明显低于C组,提示雾化吸入米力农后,炎性细胞的活性明显受到抑制,组织中炎性反应减轻。而V组并未出现相似变化,这可能与雾化吸入米力农后在肺内积聚的药物继续发挥作用有关。静脉应用的米力农可能快速通过肺循环而进入体循环并迅速代谢或者可能与静脉应用米力农的剂量有关。
本研究结果显示,体外循环后三组患者PVR不同程度升高,OI不同程度降低,而M组上述两指标的变化幅度均显著低于C组,且较早恢复,说明其对围术期肺功能的保护有积极的作用。米力农对肺损伤的保护作用除与其抗炎作用有关外,尚可能与下列因素密切相关。米力农特异性地抑制磷酸二酯酶后,肺组织中cAMP的降解减少,有利于保持内皮细胞间,内皮细胞与基质间的紧密连接,抑制肺泡内水渗出,改善呼吸功能。同时,米力农尚具有抗生物氧化、保护膜结构等活性[10]。MDA是脂质过氧化产物主要成分之一,测定血浆中MDA含量可以反映脂质过氧化的程度,间接反映缺血再灌注损伤的情况。本研究结果显示M组血浆MDA显著低于C组,说明其能减少氧自由基产生,具有抗氧化作用。本研究中,我们观察到静脉应用米力农虽可显著降低血中炎症介质的浓度,但对肺血管阻力、氧合能力及脂质过氧化指标并无显著影响,其可能原因已如前述。静脉应用米力农的量—效及时—效关系尚有待于进一步研究。
[1]Holmes JH,Connolly NC,Paull DL,et al.Magnitude of the inflammatory response to cardiopulmonary bypass and its relation to adverse clinical outcomes[J].Inflamm Res,2002,51(12):579-586.
[2]Schlensak C,Doenst T,Preusser S,et al.Cardiopulmonary bypass reduction of bronchial blood flow:a potential mechanism for lung injury in a neonatal pig model[J].J Thorac Cardiovasc Surg,2002,123(6):1199-1205.
[3]张国华,侯凡凡,王武军,等.清除循环炎症因子对体外循环心脏手术患者肾、肺功能的保护作用[J].中华医学杂志,2005,85(45):3194-3198.
[4]金惠铭,卢建,殷莲花.细胞分子病理生理学[M].郑州:郑州大学出版社,2002:493-502.
[5]Wan S,LeClerc JL,Vincent JL.Inflammatory response to cardiopulmonary bypass:mechanisms involved and possible therapeutic strategies[J].Chest,1997,112(3):676-692.
[6]Chen YF,Oparil S.Endothelial dysfunction in the pulmonary vascular bed[J].Am J Med Sci,2000,320(4):223-232.
[7]Boyle EM Jr,Pohlman TH,Johnson MC,et al.Endothelial cell injury in cardiovascular surgery:the systemic inflammatory response[J].Ann Thorac Surg,1997,63(1):277-284.
[8]Siflinger-Birnboim A,Bode DC,Malik AB.Adenosine 3',5'-cyclic monophosphate attenuates neutrophil-mediated increase in endothelial permeability[J].Am J Physiol,1993,264(2Pt2):370-375.
[9]Lamarche Y,Malo O,Thorin E,et al.Inhaled but not intravenous milrinone prevents pulmonary endothelial dysfunction after cardiopulmonary bypass[J].J Thorac Cardiovasc Surg,2005,130(1):83-92.
[10]魏以桢,吴清玉.特异性磷酸二酯酶抑制剂米力农对供体肺的保护作用[J].中国新药杂志,2007,16(21):1762-1765.
[11]曹德权,陈艳平,常业恬.米力农对心肺转流促炎细胞因子反应及心肌损伤的影响[J].临床麻醉学杂志,2006,22(4):254-256.
[12]Abacilar F,Dogan OF,Duman U,et al.The changes and effects of the plasma levels of tumor necrosis factor after coronary artery bypass surgery with cardiopulmonary bypass[J].Heart Surg Forum,2006,9(4):703-709.
[13]Chello M,Mastroroberto P,Quirino A,et al.Inhibition of neutrophil apoptosis after coronary bypass operation with cardiopulmonary bypass[J].Ann Thorac Surg,2002,73(1):123-129.
[14]Bernard GR,Vincent JL,Laterre PF,et al.Efficacy and safety of recombinant human activated protein C for severe sepsis[J].NEJM,2001,344(10):699-709.
