脑卒中急性期胃肠功能障碍患者血浆VIP水平变化的相关性研究
2011-09-03杨秀丽安朋朋李玲玲姜韫赟
唐 明,杨秀丽,安朋朋,李玲玲,姜韫赟,李 倩
脑卒中急性期并发症的涉及范围很广,其中胃肠功能障碍是脑卒中的常见并发症之一[1]。随着“脑肠相关”理论的提出,脑与胃肠相关性的研究已日益深入[2]。在消化道与脑之间,可能存在着未知的反馈与负反馈的联络网[3]。消化系统的功能除了受神经系统调节外,还与胃肠激素的调控有密切关系。近年来,血管活性肠肽(vasoactive intestinal peptide,VIP)作为一种脑肠肽,对神经系统及消化系统疾病的重要作用不断被人们所认识。目前,对脑卒中胃肠功能障碍时血管活性肠肽水平及其变化研究报道较少,而且多为动物实验研究,由于动物和人的种属差异,血管活性肠肽对脑卒中急性期胃肠功能障碍的确切作用有待于更进一步的研究及探讨。
1 资料与方法
1.1 临床资料 观察2009年3月—2009年10月入院的急性脑卒中患者192例(卒中组),均为发病6 h内入院并经CT或MRI确诊。男性120例(62.5%),女性72例(37.5%),年龄25岁~96岁(69.02±0.93岁)。1周内出现胃肠症状者159例,无胃肠症状表现者33例。对照组为健康查体中老年人51名,无应激性胃肠症状表现,年龄43岁~79岁(60.41岁±1.14岁),男 30名,女 21名。
1.2 病例选择
1.2.1 诊断标准 诊断符合1995年中华医学会第四次全国脑血管病学术会议修订的脑卒中诊断标准[4]。
1.2.2 纳入标准 符合脑卒中诊断标准,观察组病例均在发病6 h内入院。
1.2.3 排除标准 未经头颅CT或M RI确诊;发病24 h后入院;入院前病史资料不详;入院前一周内服用过影响胃肠动力或胃酸分泌的药物;合并痴呆或精神异常患者;合并帕金森氏病;既往有胃肠道疾病史;有严重的心、肝、肾等脏器及系统性疾病;合并恶性肿瘤;观察期内出现病情明显改变,或中途转科、出院、不再同意参加本研究者。
1.3 检查方法 观察组于入院后翌日和1周后清晨空腹状态下抽取静脉血2 mL。注入预冷的含30 μ L 7.5%草酸钠(EDTA-2Na)和40 μ L抑肽酶的试管中,充分混匀后4℃离心20 min,吸取血浆后置-70℃冰箱内保存待测VIP;应用测量仪器美国德普公司生产的 DPC-GAM MA-C12型γ计数器测定。VIP放免试剂由北方生物技术研究所提供。
1.4 统计学处理 应用SPSS 13.0软件包进行分析,计量资料以均数±标准差(±s)表示,两样本均数比较采用成组设计的t检验,成组设计的多个样本均数比较采用单因素方差分析。
2 结 果
2.1 卒中组不同时期VIP水平变化 与对照组相比,卒中组入院24h和入院1周时空腹血浆VIP水平均显著升高(P<0.01)。卒中组患者入院1周时VIP水平较入院24 h呈降低趋势(P>0.05)。详见表 1。
表1 观察组不同时期VIP水平变化(±s)pg/mL

表1 观察组不同时期VIP水平变化(±s)pg/mL
组别 n 入院24 h 入院1周卒中组 192 206.01±9.861) 177.63±8.821)对照组 51 138.76±8.96 138.76±8.96与对照组相比,1)P<0.01
2.2 卒中组不同性别VIP水平 卒中组患者空腹血浆VIP水平男女对比无统计学意义。男性患者入院1周时VIP水平较入院24 h明显降低(P<0.05)。女性患者不同时间VIP水平相比均未见明显升高或降低。详见表2。
表2 卒中组不同性别VIP水平对比(±s)pg/mL

表2 卒中组不同性别VIP水平对比(±s)pg/mL
性别 n 入院24 h 入院1周男性 120 216.29±14.03 167.72±11.171)女性 72 188.86±11.83 185.82±14.41与入院24 h相比,1)P<0.05
2.3 胃肠症状组、无胃肠症状组及正常组VIP水平 与无胃肠症状组相比,胃肠症状组VIP水平不同时间均无统计学意义。胃肠症状组入院1周时VIP水平较入院24h明显降低(P<0.05)。与正常组相比,胃肠症状组VIP水平各时间均显著增高(P<0.01);无胃肠症状组仅入院24 h VIP水平较胃肠组显著偏高,入院1周与正常组相比无统计学意义。详见表3。
表3 3组VIP水平(±s)pg/mL
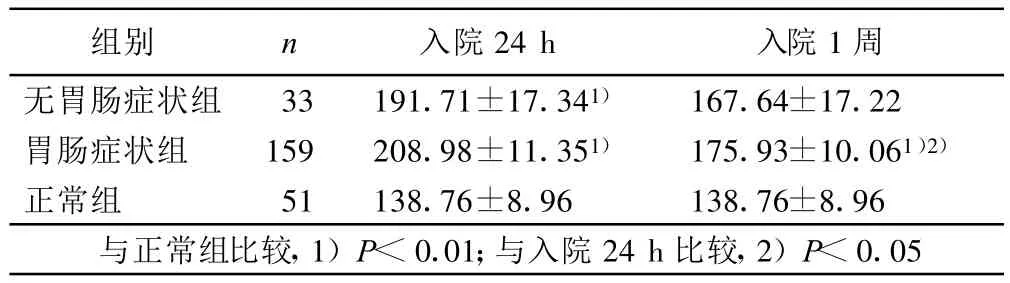
表3 3组VIP水平(±s)pg/mL
组别 n 入院24 h 入院1周无胃肠症状组 33 191.71±17.341) 167.64±17.22胃肠症状组 159 208.98±11.351) 175.93±10.061)2)正常组 51 138.76±8.96 138.76±8.96与正常组比较,1)P<0.01;与入院24 h比较,2)P<0.05
2.4 胃肠出血组、非胃肠出血组及正常组VIP水平对比 与正常组相比,非胃肠出血组入院24 h及入院1周时VIP水平均明显增高,而胃肠出血组仅入院24 h VIP水平较正常组有明显增高(P<0.01)。胃肠出血组与非胃肠出血组相比不同时间VIP水平未见明显差异;此外,胃肠出血组入院1周时较入院24 h VIP水平呈下降趋势。详见表4。
表4 3组VIP水平(±s)pg/mL

表4 3组VIP水平(±s)pg/mL
组别 n 入院24 h 入院1周胃肠出血组 19 232.85±41.521) 156.97±14.48非胃肠出血组 140 205.74±11.631) 178.50±11.251)正常组 51 138.76±8.96 138.76±8.96与正常组比较,1)P<0.01
3 讨 论
正常情况下胃肠道神经递质通过神经-免疫-内分泌网络与胃肠激素、细胞因子等相互调控,使胃肠道功能处于动态的平衡中。VIP作为一种存在于胃肠道神经元中的非胆碱能非肾上腺素能神经介质[5],在胃肠消化吸收及内分泌功能中起重要的调节作用。VIP是肠神经系统的抑制性传递介质,对胃肠动力起抑制性调节作用,可通过直接作用于胃肠平滑肌上的VIP受体发挥作用,特别是抑制肠的紧张性。它是参与肠蠕动调控的重要成分之一[6],同时亦对胃肠黏膜具有保护作用;此外,在一些氧化性损伤和细胞毒损伤中,VIP具有很强的营养神经和促进细胞存活作用[7,8],可能与其促进脑源性神经营养因子mRNA的表达有关。VIP除通过促进活性依赖性神经营养因子(ADNF)的分泌[9]、蛋白激酶 A等途径发挥作用外[10],还可提高神经细胞对应激反应的耐受性[11]。体外实验显示VIP能提高培养的星形胶质细胞(AS)摄取谷氨酸的能力,对抗谷氨酸诱导的细胞死亡[12,13],提示VIP在脑缺血性损伤中具有神经保护作用,其作用可能是通过AS的介导来实现的,但仍缺少足够的活体实验证据,具体作用机制有待阐明。
本结果显示,脑卒中急性期患者入院24 h血浆VIP水平较正常组明显升高,1周时VIP较前下降。脑卒中急性期VIP含量升高,其机制尚不清楚。脑卒中急性期在自身保护机制的启动下,VIP释放与特异受体结合发挥生理功能,可增加促肾上腺皮质激素(ACTH)分泌[14];增强舒张血管作用,参与休克、再灌注损伤、急性缺氧等病理过程的发生发展[15],以调节脑及胃肠血管压力的应激性反应;提高神经细胞对应激反应的耐受性。
无胃肠症状组1周时VIP水平与正常组无统计学意义,胃肠症状组1周时VIP水平却仍明显偏高于正常组,可推测脑卒中急性期患者胃肠功能障碍可能与VIP的高水平有关。VIP作为一种胃肠运动抑制性递质,急性脑卒中时,VIP异常分泌增多,胃的运动受到抑制,胃排空减慢,胃酸在胃内存储时间延长,增加了胃酸对胃壁的消化作用,从而相对削弱了胃黏膜防御能力,使胃酸的消化作用与胃黏膜防御能力之间失去平衡,从而加速了应激性溃疡等胃肠疾病的形成。
此外,胃肠出血组入院1周时VIP水平已降到正常水平,而非胃肠出血组入院1周时VIP水平仍高于正常组。可见胃肠出血组VIP下降趋势较非胃肠出血组明显,即不同的胃肠症状表现形式可能与VIP升降的幅度有关。
本研究表明,急性脑卒中可使VIP水平分泌增加,发病1周后,继发胃肠功能障碍患者血浆VIP仍处于高水平。提示血浆高VIP水平与脑卒中及继发胃肠功能障碍具有一定的相关性。因此,早期动态监测血浆VIP水平变化,对脑卒中急性期继发胃肠功能障碍的诊断、评估均有重要的参考价值。同时VIP影响脑与胃肠的发病机制有待进一步深入研究。
[1]Kitamura T,Ito K.Acute gastric changes in patients with acute stroke[J].Stroke,1976,7(5):464-468.
[2]Bonaz B.Brain-gut interactions[J].Rev Med Interne,2010,31(8):581-585.
[3]Lechin F,van der Dijs B.Central nervous system plus autonomic nervous system disorders responsible for gastrointestinal and pancreatobiliary diseases[J].Dig Dis Sci,2009,54(3):458-470.
[4]中华神经科学会,中华神经外科学会.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379-380.
[5]Tomita R.Regulation of vasoactive intestinal peptide and substance P in the human pyloric sphincter[J].Hepatogastroenterology,2009,56(94-95):1403-1406.
[6]Chandrasekharan B,Anitha M,Blatt R.Colonic motor dy sfunction in human diabetes is associated with enteric neuronal loss and increased oxidative stress[J].Neurogastroenterol M otil,2010,10(1111):1365.
[7]Koh SW,Waschek JA.Corneal endothelial cell survival in organ cultures under acute oxidative stress:Effect of VIP[J].Invest OphthalmoⅣis Sci,2000,41(13):4085-4092.
[8]Gressens P.VIP neuroprotection against excito toxic lesions of the developing mouse brain[J].Ann NYA Cad Sci,1999,89:7109-7124.
[9]Gozes I,Brenneman DE.A new concept in the pharmacology of neuroprotection[J].J Mol Neurosci,2000,14(1-2):61-68.
[10]Li L,She H,Yue S,et al.Vasoactive intestinal peptide induces surfactant protein A expression in ATⅡcells through activation of PKC/c-Fos pathway[J].Peptides,2010,31(11):2046-2051.
[11]Abad C,T an YV,Lopez R,et al.Vasoactive intestinal peptide loss leads to impaired CNS parenchymal T-cell infiltration and resistance to ex perimental autoimmune encephalomyelitis[J].Proc Natl Acad Sci USA,2010,107(45):19555-195560.
[12]Brown DR.Neuronal release of vasoactive intestinal peptide isimportant to astrocytic protection of neurons from glutamate toxicity[J].M ol Cell Neurosci,2000,15(5):465-475.
[13]Onoue S,Endo K,Yajima T,et al.Pituitary adenylate cyclase-activating polypeptide and vasoactive intestinal peptide attenuate glutamate-induced nNOS activation and cytotoxicity[J].Regul Pept,2002,107(1-3):43-47.
[14]Whitworth EJ,Kostio,Renshaw D,et al.Adrenal neuropeptides:Regulation and interaction with ACTH and other adrenal regulators[J].Microse Res T ech,2003,61:259.
[15]罗晓阳,张翔,王嘉军,等.纳洛酮对脑损伤大鼠血浆及海马匀浆中VIP的影响[J].中国危重病急救医学,1996,8(11):641-642.
