榄香烯对K562细胞株的体内外抑制作用
2011-08-21庄彦徐希章圣辉俞康
庄彦,徐希,章圣辉,俞康
(温州医学院附属第一医院,浙江 温州 325000,1.血液科;2.医学科学研究所)
榄香烯(elemene)是从姜科植物温郁金(温莪术,curcuma Wenyujin)中提取的半萜烯类化合物,其主要成分是为β-榄香烯(化学名:1-甲基-1-乙烯基-2,4-二异丙基环己烷;分子式:C15H24,分子量:204),是我国自行开发研制的II类非细胞毒性抗肿瘤药[1],由于其抗瘤谱广[2],疗效确切,能够逆转肿瘤多药耐药并具有镇痛[3]、放化疗增敏作用[4],且不良反应轻微,无骨髓抑制,无肝肾损害,因而越来越多的在肿瘤的临床治疗中获得应用。本实验通过榄香烯对慢性粒细胞白血病急性髓系变的K562细胞株体外和体内的抑制作用,探讨其用于髓系白血病治疗的可能性。
1 材料和方法
1.1 材料
1.1.1 主要试剂及仪器:K562细胞株由本室保存;榄香烯乳注射液由大连金港制药有限公司提供(0909251);胎牛血清、RPMI1640购自美国GIBCO公司;AnnexinV/PI购自美国invitrogen公司;Cell Counting Kit-8(CCK-8)购自日本同仁化学研究所;DAPI染液购自碧云天生物研究所;FACS Calibur流式细胞仪(美国BD公司);荧光显微镜OLYMPUS BX41;全自动酶标仪ELX400。
1.1.2 实验动物:SPF 级SCID Beige小鼠,6~8周龄,体重为16~20 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2006-0009。
1.2 方法
1.2.1 细胞培养:K562细胞接种于含10%胎牛血清的RPMI1640培养液中,37 ℃、5% CO2、饱和湿度的培养箱中培养,每2 d换液1次,取对数生长期细胞进行实验。
1.2.2 细胞生长抑制试验:K562细胞以1.0×104个/孔接种到96孔板中,使用10、20、30、40μg/mL的榄香烯处理,每孔总体积为100μL。各个浓度均设6个复孔,另设空白对照孔和调零孔。在培养箱分别培养24、48、72 h后,各取出1块96孔板,每孔加入CCK-8溶液10μL,混匀后37 ℃培养箱继续孵育3 h,酶标仪450 nm波长测吸光度(A450)。生长抑制率=(对照孔A值-实验孔A值)/对照孔A值×100%。
1.2.3 Annexin V/PI荧光标记法检测细胞凋亡:将1.0×105个/mL的细胞接种于6孔板上,使用10、20、30、40、50μg/mL的榄香烯处理48 h。收集细胞,PBS洗2次,按AnnexinV-FITC/PI 试剂盒说明书操作,采用Cellquest 3.2分析软件获取和分析结果。
1.2.4 DAPI染色分析核形态:前期处理同细胞凋亡检测,48 h后收集细胞,PBS洗2次,4%多聚甲醛固定,细胞团滴片,风干,加入10μL的DAPI染液染色15 min,封片,使用免疫荧光显微镜进行观察(波长为340~380 nm,放大倍数为1000倍)。
1.2.5 体内抑瘤实验:取16只SCID小鼠,分别标记,将一侧背部剃毛用于细胞皮下接种。K562细胞接种前2 d,每天予腹腔注射环磷酰胺2 mg/只,共2 d。调整K562细胞浓度为6×107个/mL,每只小鼠于背部皮下接种0.1 mL。接种后第4天,将小鼠随机分为正常对照组和榄香烯组,每组8只。榄香烯组每天腹腔注射榄香烯125 mg/kg(约2.5 mg/只),对照组每天腹腔注射0.9%氯化钠溶液,连续注射14 d,每隔2 d用游标卡尺测定肿瘤长短径,按下式计算肿瘤体积:肿瘤体积=(长径×短径2×0.52)。于第24天处死小鼠,剥离瘤体,称量,计算肿瘤生长抑制率IR:IR =(1-给药组平均瘤质量)/正常对照组平均瘤质量×100%。
1.3 统计学处理方法 采用SPSS17.0软件,不同药物浓度组间比较采用完全随机设计的方差分析。
2 结果
2.1 榄香烯体外抑制K562细胞增殖 结果见表1、图1,榄香烯对K562细胞具有明显的生长抑制作用,并呈量效和时效关系。40μg/mL的榄香烯作用24、48、72 h的抑制率分别为45.1%、63.1%、89.1%,与对照组相比,差异有统计学意义(P<0.01)。
表1 β-榄香烯对人髓系白血病K562细胞的增殖抑制作用(±s,n=6)
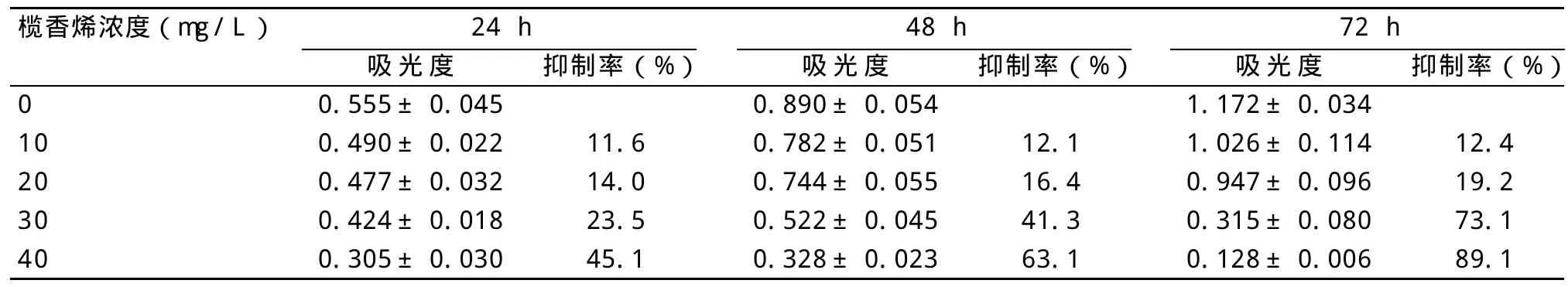
表1 β-榄香烯对人髓系白血病K562细胞的增殖抑制作用(±s,n=6)
榄香烯浓度(mg/L)24 h抑制率(%)0 10 20 30 40吸光度0.555±0.045 0.490±0.022 0.477±0.032 0.424±0.018 0.305±0.030 48 h 72 h抑制率(%) 吸光度1.172±0.034 1.026±0.114 0.947±0.096 0.315±0.080 0.128±0.006吸光度0.890±0.054 0.782±0.051 0.744±0.055 0.522±0.045 0.328±0.023 11.6 14.0 23.5 45.1抑制率(%)12.1 16.4 41.3 63.1 12.4 19.2 73.1 89.1
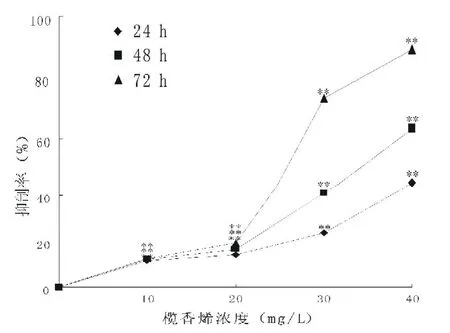
图1 不同浓度和作用时间下榄香烯对K562细胞的生长抑制作用
2.2 细胞凋亡的形态学 未经榄香烯处理的细胞,核膜光滑、核质均一;经不同浓度榄香烯处理48 h后的细胞核具有凋亡细胞核的特征性核形态,细胞核呈折缝样,染色质出现浓缩,核膜破裂,染色质固缩,细胞核裂解为碎块等。见图2。
2.3 榄香烯诱导K562细胞凋亡 榄香烯作用48 h后,Annexin V-FITC/PI双染后流式细胞仪检测结果显示,10、20、30、40、50μg/mL榄香烯早期细胞凋亡率分别为(2.38±1.04)%、(2.98±1.36)%、(4.99±1.96)%、(18.03±2.45)%、(53.58±4.34)%。与阴性对照组的(1.10±0.47)%相比,差异均有统计学意义(P<0.05),并呈剂量依赖性。见图3。

图2 经不同浓度榄香烯处理K562细胞DAPI染色结果
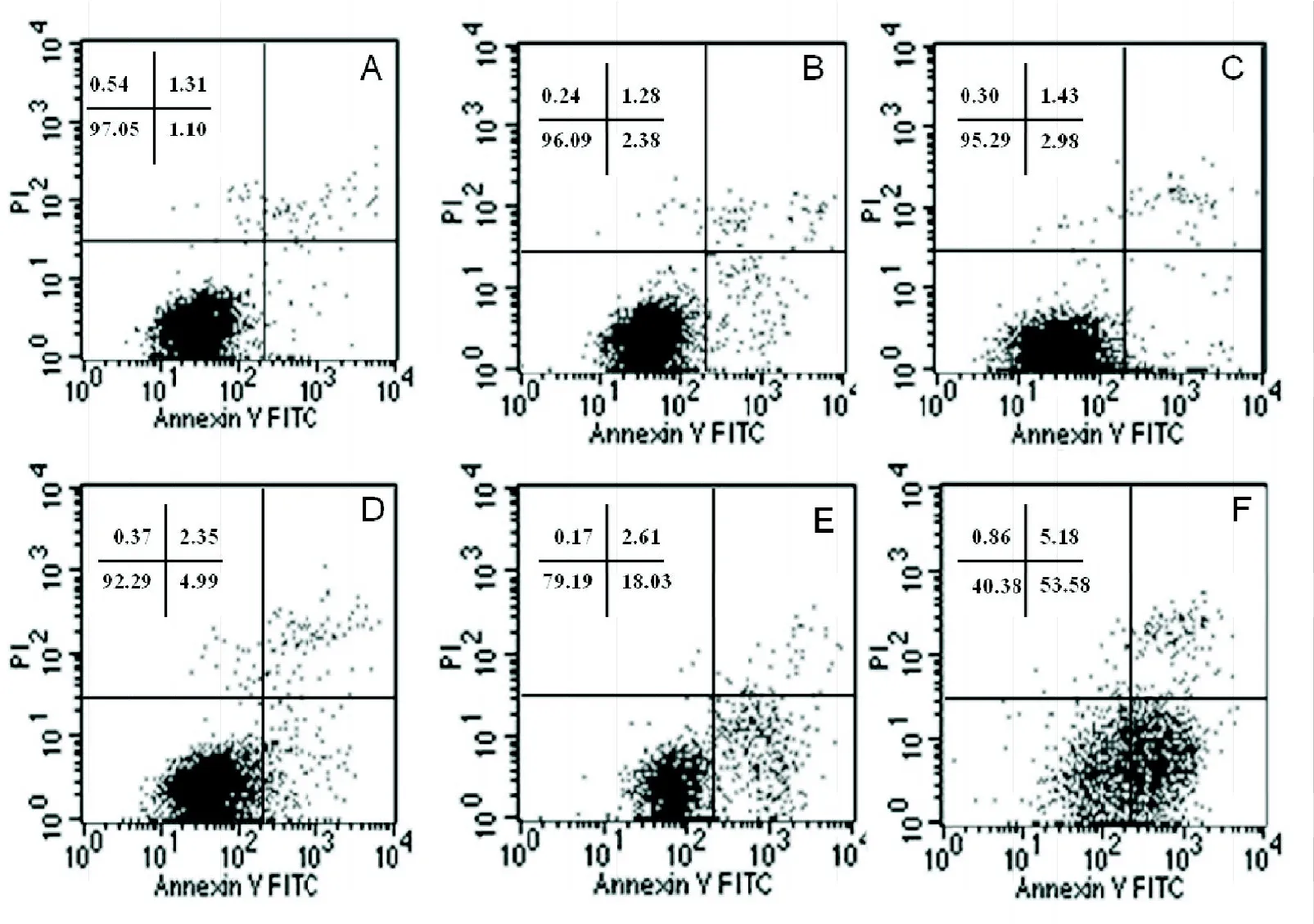
图3 榄香烯对K562细胞作用48 h的凋亡率(%)
2.4 榄香烯体内抑制K562细胞增殖 接种4 d后皮下可见较均一的瘤状突起,并随时间延长不断长大。16只SCID鼠均移植成功,经观察和测量,经125 mg/kg榄香烯处理的小鼠肿瘤生长较对照组明显减缓(见图4),至观察期末,两组均无小鼠死亡。接种24 d后将小鼠处死小鼠,将剥离的瘤体称重,对照组瘤重均值为(0.341±0.074)g,实验组瘤重(0.095±0.031)g,按公式计算的肿瘤抑制率为72.1%。
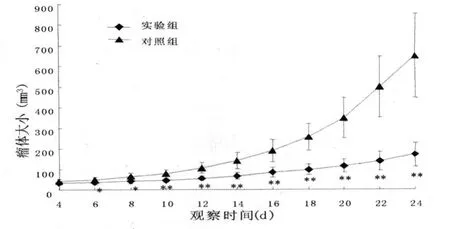
图4125 mg/kg榄香烯对K562细胞株的体内抑制作用
2.5 病理学观察 经HE染色后于光镜下观察,实验组肿瘤组织中细胞出现大量坏死,肿瘤中组织内血管分布较少,对照组中,肿瘤细胞形态清晰,坏死较少,血管丰富,两组对比差异明显。见图5-6。

图5 实验组肿瘤组织病理切片(HE,×200)
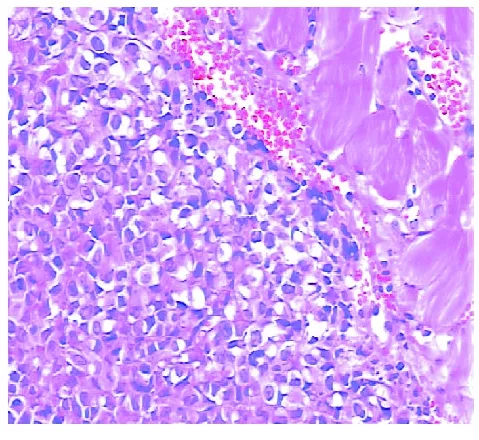
图6 对照组肿瘤组织病理切片(HE,×200)
3 讨论
目前,血液系统的恶性肿瘤治疗仍以细胞毒药物化疗为主要方式,肿瘤耐药和化疗对重要器官损伤是临床经常遇到的难题。榄香烯作为我国自主研发的二类非细胞毒性抗肿瘤新药,具有逆转肿瘤多药耐药、抑制肿瘤血管生成、放化疗增敏和调节机体免疫的功能,而且还具有骨髓抑制较轻和能透过血脑屏障的优点,具有较广阔的应用前景。
本实验表明,30μg/mL香烯对K562细胞的增殖开始出现明显的抑制作用,随着浓度的增加和作用时间的延长,增殖的抑制作用逐渐明显,显示出明显的剂量效应和时间效应依赖关系。50μg/mL榄香烯处理K562细胞48 h后,凋亡细胞数明显增多,达53.58%,并存在剂量依赖关系。DAPI染色进一步从形态学上证明了榄香烯能诱导K562细胞凋亡,经榄香烯暴露48 h后,细胞核内的染色质呈高度浓缩、边缘化,产生细胞核碎片,形成凋亡小体。对比相关文献,邹丽娟等[5]亦发现榄香烯其能诱导K562细胞凋亡,在40μg/L作用48后,凋亡发生率达58.4%,并能抑制细胞内Bcl-2表达。陆羡等[6]的研究显示了β-榄香烯能够阻滞K562细胞从G1期向S期转化,30μg/L作用48 h后,凋亡率为(34.3±2.8)%。均提示β-榄香烯对K562细胞能产生增殖抑制作用并诱导其凋亡。此外,榄香烯注射液对人白血病HL-60、NB4[7]细胞株、宫颈癌Hela细胞株、肝癌Hca-F25/CL-16A3细胞株及喉癌Hep-2、肺癌A549细胞株等增殖均有显著的抑制作用,且对多药耐药(MDR)的细胞株如K562/ADM、乳腺癌MCF-7/ADM、胃癌SGC7901/VCR、脑胶质瘤U251/ADM能够逆转其耐药性[8],显示其具有不但具有较广的抗瘤谱、良好的抑瘤效果,还具有逆转肿瘤多药耐药的作用。
本研究同时通过腹腔给药,对皮下荷瘤的SCID小鼠的进行处理后发现, 腹腔注射125 mg/kg榄香烯的实验组小鼠肿瘤生长较注射0.9%氯化钠溶液的空白对照组明显减缓,且给药的耐受性较好,连续14 d未引起小鼠死亡,但注射后能观察到小鼠萎靡少动,排便增多,便溏,于数小时内恢复,对摄食影响不明显,考虑与榄香烯对腹膜的刺激有关。在观察期内,两组小鼠体重均有增加,但无明显差异。两组在实验终点剥离瘤体,瘤重差异明显,肿瘤抑制率达72.1%。HE染色也证明经实验组小鼠瘤体坏死程度、纤维化程度均高于对照组,两者相比差异有统计学意义。与曹忠胜等[9]将榄香烯作用于人喉鳞癌Hep-2细胞株的裸鼠皮下移植模型,抑瘤率达52.24%,且无明显不良反应的结果相符。通过动物实验,进一步证明了榄香烯对K562白血病细胞在体内也具有较强抑制作用,且药物安全性和耐受性较好。
在榄香烯的安全性方面,杨骅等[10]研究了其对正常人外周血白细胞的体外抑制作用,结果显示其IC50为254.3μg/mL,王茜莎等[11]的研究亦显示榄香烯对小鼠骨髓和人正常肝胚胎细胞无抑制,故显示其具有较低的细胞毒性。在临床治疗白血病方面,亦有一些尝试,如陈洁等[12]用榄香烯联合化疗治疗难治性老年白血病23例,结果显示总有效率为65.2%,感染、心血管事件、肝肾功能损害及出血的发生率均较低,与对照组相比差异有统计学意义。余惠[13]研究7例急性白血病患者,以单用或先单用榄香烯,再予原先已无效的化疗方案治疗后,其骨髓及外周血原始细胞均有不同程度的下降,总有效率达57%,耐受性好且不良反应轻微,显示了榄香烯在临床治疗白血病的可行性及有效性。
综上所述,本研究评价了榄香烯单药对K562细胞的体内外作用,显示其在体外具有明显的促进肿瘤细胞凋亡和抑制肿瘤细胞增殖的作用,且在体内能够抑制K562荷瘤小鼠的瘤体生长,抑瘤率达72.1%,在连续给腹腔给药下未出现小鼠死亡,显示其有较好的安全性。通过研习相关文献,显示出榄香烯逆转多药耐药、放化疗增敏、骨髓抑制轻微等诸多优点,预示榄香烯在治疗髓系白血病,特别是老年白血病以及难治性白血病方面有良好前景。
[1] 汤秀红, 秦叔逵, 谢恬. 榄香烯注射液抗肿瘤作用基础研究的现状和进展[J]. 临床肿瘤学杂志, 2010,15(3):266-273.
[2] Li QQ, Wang G, Huang F, et al. Antineoplastic effect of beta-elemene on prostate cancer cells and other types of solid tumour cells[J]. J Pharm Pharmacol, 2010,62(8):1018-1027.
[3] 邓力, 黎壮伟. 榄香烯注射液治疗骨转移癌疼痛临床观察[J].中医药临床杂志, 2008,20(4):420-421.
[4] 杨道科, 宋一帆. β-榄香烯对人肝癌细胞株的体外放射增敏作用[J]. 中国现代药物应用, 2008,2(17):47-49.
[5] 邹丽娟,于丽敏.β-榄香烯诱导K562白血病细胞凋亡[J]. 中华肿瘤杂志, 2001,23(3):196-198.
[6] 陆羡, 向金峰. β-榄香烯对K562细胞周期与细胞凋亡的影响及其机制探讨[J]. 中国小儿血液与肿瘤杂志, 2008,13(4):149-152.
[7] Yu Z, Wang R, Xu L, et al. N-(beta-Elemene-13-yl)tryptophan methyl ester induces apoptosis in human leukemia cells and synergizes with arsenic trioxide through a hydrogen peroxide dependent pathway[J]. Cancer Lett, 2008,269(1):165-173.
[8] 汤秀红, 秦叔逵, 谢恬. 榄香烯注射液抗肿瘤作用基础研究的现状和进展[J]. 临床肿瘤学杂志, 2010,15(3):266-273.
[9] 曹忠胜, 季文樾. 榄香烯治疗人喉癌裸鼠模型的实验研究[J].临床耳鼻咽喉头颈外科杂志, 2007,15(9):417-420.
[10] 杨骅, 郁琳琳. 榄香烯抗癌作用与诱发肿瘤细胞凋亡[J]. 中华肿瘤杂志, 1996,18(3):169-172.
[11] 王茜莎, 杨威, 李明, 等. δ-榄香烯体内外抗肿瘤作用研究[J]. 中国药房, 2009,(9):650-653.
[12] 陈洁, 董戴玉. 榄香烯乳在难治性老年白血病中的应用[J]. 中国中西医结合杂志, 2004,24(10):935-936.
[13] 余惠. 榄香烯治疗白血病初步观察[J]. 中华现代内科学杂志,2008,5(3):250-252.
