广西畜禽大肠杆菌O157∶H7流行病学调查*
2011-08-21禤雄标谢宇舟谢永平陈泽祥马春霞许力干
李 军,禤雄标,谢宇舟,谢永平,彭 昊,陈泽祥,胡 帅,马春霞,杨 威,许力干,潘 艳
大肠杆菌O157∶H7(E.coliOl57:H7)是一种与公共卫生密切相关的肠出血性大肠杆菌血清型,感染后可引起动物腹泻、出血性结肠炎,溶血性尿毒综合症及血栓性血小板减少等,严重者可导致死亡。1982年大肠杆菌O157∶H7在美国首次被确认为食物中毒新型致病菌,现已成为一个全球性的公共卫生问题,引起全世界广泛的关注[1]。1986年我国首次发现由大肠杆菌O157∶H7引起的散发感染,随后的检测表明该菌广泛地分布于我国各地区[2-4]。大肠杆菌O157∶H7作为一种人兽共患病原菌,可以在畜禽中流行和传播,并通过动物源性食品传染给人,目前已有众多种动物和动物源性食品分离出大肠杆菌 O157∶H7的报道[5-6]。王红等(2005)[7]在2002-2004年对广西食品中大肠杆菌O157∶H7的监测结果显示从市售生牛肉和生猪肉中检测到大肠杆菌O157∶H7。广西是农业大省,省内有较多的畜禽养殖场,对畜禽大肠杆菌O157∶H7进行流行病学调查,了解其致病性和耐药情况,有助于控制大肠杆菌O157∶H7在畜禽中的流行和传播,防止其经动物源性食品在人间传播。为此,本研究对广西13个市41个县(区)200多个养殖场进行大肠杆菌O157∶H7流行病学调查,采集2 915份样本进行大肠杆菌O157∶H7的分离鉴定和生物学特性研究,获得的广西大肠杆菌O157∶H7流行病学信息将对预防和控制广西大肠杆菌O157∶H7在畜禽中的流行和传播具有重要的兽医公共卫生意义。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 营养肉汤、营养琼脂培养基、麦康凯培养基、山梨醇麦康凯培养基、伊红美蓝培养基购自北京陆桥技术有限责任公司,新生霉素EC肉汤、O157显色培养基购自郑州安图生物工程有限公司,兔血琼脂培养基为本实验室自制。O157和H7单因子血清购自浙江宁波天润生物药业有限公司;细菌基因组DNA提取试剂盒购于天根生化科技(北京)有限公司。PCRTaqMix、DNA Marker 1购自广东东盛生物科技有限公司;微量生化鉴定管和药物敏感试验纸片购自杭州天和微生物试剂有限公司。PCR仪购自日本Ta KaRa公司;凝胶成像系统购自美国Alpha Inotech公司。
1.1.2 实验动物 健康昆明小白鼠(20 g/只左右),购自广西医科大学实验动物中心。
1.2 方法
1.2.1 调查方法 2007年1月至2010年9月,对广西南宁、桂林、贺州、柳州、梧州、来宾、玉林、贵港、钦州、防城港市、北海、河池、崇左13个市41个县(区)200多个养猪、养鸡、养鸭场和养牛场采取询问、现场调查、临床观察、实验室检查和数据统计等方法,进行畜禽大肠杆菌O157∶H7的流行病学调查。共采集畜禽粪便样本2 915份,其中猪985份,鸡772份,鸭718份,牛440份。
1.2.2 细菌分离 将采集的畜禽粪便样本用无菌PBS稀释,800 r/min离心5 min,取上清接种于新生霉素EC肉汤,37℃培养6 h后划线接种到O157显色培养基,37℃培养18 h。
1.2.3 细菌形态和培养特性观察 取O157显色培养基37℃18 h培养形成的紫色菌落涂片,革兰氏染色,光学显微镜下观察细菌形态和染色特征。同时将该菌分别接种于营养肉汤、兔血琼脂培养基、麦康凯培养基、山梨醇麦康凯培养基、伊红美蓝培养基上,37℃培养24 h,观察其培养特性。
1.2.4 生化特性 将细菌接种于微量生化管内,置37℃培养24 h,进行细菌的生化特性检测。
1.2.5 血清型鉴定 应用O157和H7单因子血清与待检细菌在玻片上进行凝集反应,测定细菌的血清型。
1.2.6 大肠杆菌O157∶H7的PCR鉴定 采用大肠杆菌O157∶H7双重PCR方法对待检细菌进行PCR检测,确定待检细菌是否有rfb E(O157)和Flic(H7)基因。引物序列为rfb E-F:5′-TGT CCA TTT ATA CGG ACA TCC ATG-3′;rfb E-R:5′-CCT ATA ACG TCA TGC CAA ATT GCC-3′和Flic-F:5′-GCG AAG TTA AAC ACC ACG AC-3′;Flic-R:5′-ACC CGT ACC AGC AGT AGA TT-3′,扩增片段长度分别为291 bp和180 bp。引物由上海英骏生物技术有限公司合成。
1.2.7 致病性试验 18只健康小白鼠随机分成6组,每组3只。分离的大肠杆菌O157∶H7在营养肉汤培养基培养18 h后,调整细菌浓度为1×1010CFU/m L。试验组小白鼠腹腔注射相应分离株的菌悬液,每只0.3 m L;对照组小白鼠腹腔注射灭菌生理盐水,每只0.3 m L。每天观察记录小白鼠发病和死亡情况,取死亡小白鼠心、肝和脾等组织作细菌分离鉴定。连续观察6 d,第7 d对未死小白鼠进行解剖观察病变情况。
1.2.8 毒力基因的检测 针对大肠杆菌O157∶H7的4个毒力基因,溶血素基因(Hly A)、紧密黏附素基因(Eae A)、志贺样毒素1(Stx1A)、志贺样毒素2(Stx2A)分别合成引物[8-9],进行 PCR 扩增,观察大肠杆菌O157∶H7分离株携带毒力基因的情况。1.2.9 药物敏感试验 药敏试验采用纸片法,将培养好的菌株用生理盐水稀释为1×1010CFU/m L后,吸取0.1 m L菌液均匀涂布于营养琼脂培养基上;用无菌镊子夹取药敏纸片贴于平板(6张/板,相隔不少于3 cm),置于5%CO2环境中37℃培养24 h后观察结果,用游标卡尺测量抑菌圈大小。
2 结 果
2.1 广西大肠杆菌O157∶H7流行病学调查结果利用O157显色培养基对采集的2 915份畜禽粪便样本进行大肠杆菌O157∶H7的初步分离筛选,分别从3份鸡样本、20份猪样本和1份牛样本中分离到24株疑似大肠杆菌O157∶H7菌株,细菌的生化特性和血清凝集反应符合大肠杆菌O157∶H7特征。应用大肠杆菌O157∶H7双重PCR方法进行细菌的O157和H7基因鉴定,在检测的24份疑似样本中,有5份细菌经PCR鉴定为大肠杆菌O157∶H7,样本细菌分离率为0.17%。这5份细菌来自2009年7月融水县和防城港市的小规模猪场腹泻断奶仔猪的粪便样本。使用Flci(H)通用型引物[10]对余下的19株细菌的Flic基因进行扩增、克隆和测序,测序结果表明这19株细菌的血清型是O157∶H9、O157∶H19、O157∶H25和 O157∶H30。
本次大肠杆菌O157∶H7在畜禽中的流行病学调查结果显示,大肠杆菌O157∶H7主要在猪流行,当猪群健康时有可能呈隐性感染状态,一旦猪处于应激状态或免疫功能下降时,该菌可大量繁殖,引起断奶仔猪发生腹泻。病猪临床表现为突然发生腹泻,排出灰白色浆状、糊状粪便,腥臭,黏腻,腹泻次数不等,病程4~5 d,若治疗不及时可导致死亡。剖检尸体外表苍白、消瘦、肠黏膜有卡他性炎症变化,肠系膜淋巴结轻度肿胀。本病发病季节主要在夏季。此次调查数据将为广西兽医公共卫生防治大肠杆菌O157∶H7提供依据。
2.2 细菌形态和培养特性观察 大肠杆菌O157∶H7在O157显色培养基上形成紫红色菌落,随着时间延长菌落逐渐变为紫黑色;其他大肠埃希氏菌落为淡粉红色,肠炎沙门氏菌为淡蓝绿色。大肠杆菌O157∶H7在光学显微镜下镜检为两端钝圆的革兰阴性杆菌;在营养肉汤上无菌膜生成但试管底有粘丝状沉淀物;在兔血琼脂培养基上形成白色菌落,中等大小、圆形、稍突起、表面光滑湿润、边缘整齐,无溶血;在麦康凯培养基上形成粉红色菌落;在山梨醇麦康凯培养基上形成白色半透明菌落;在伊红美蓝培养基上形成呈黑色带金属光泽菌落。
2.3 生化特性 将纯化的细菌接种于微量生化管(杭州天和微生物试剂有限公司)内,置37℃培养24 h,细菌的各项生化结果见表1,与《常见细菌系统鉴定手册》中的大肠杆菌O157∶H7的生化特性相符合[11]。

表1 大肠杆菌O157:H7广西分离株的生化特性Tab.1 Biochemical characteristics of E.coli O157∶H7 strains isolated from Guangxi
2.4 血清型鉴定 挑取O157显色培养基上紫色菌落与大肠杆菌O157和H7单因子血清在玻片上进行凝集反应,凝集效价在“+++”以上的菌落共有24株,将这24株细菌继续纯化培养,进行PCR鉴定。
2.5 大肠杆菌O157∶H7的基因鉴定 应用大肠杆菌O157∶H7双重PCR方法对细菌进行PCR鉴定,确定细菌是否有rfb E(O157)和Flic(H7)基因。PCR产物电泳显示在检测的24份疑似大肠杆菌O157∶H7的DNA中有5份细菌DNA扩增出291 bp和180 bp的目的片段(图1),表明这5份疑似大肠杆菌O157∶H7细菌含有O157和H7基因,证实为大肠杆菌O157∶H7。
2.6 大肠杆菌O157∶H7分离株的致病性试验攻毒6 h后,大部分小白鼠精神沉郁、食欲不振、被毛粗乱、呼吸困难,对刺激反应降低。12 h后FC1和RS1菌株引起全部小白鼠死亡,死亡率100%。其余3株细菌在24 h内引起部分小白鼠死亡,RS2和FC3菌株对小白鼠的死亡率为66.7%;FC2菌株对小白鼠的死亡率为33.4%。死亡小白鼠病理变化为肠壁菲薄,出血充血、肠腔内充满黄色液体,以十二指肠病变最严重;肝脏、心、肺、脾和肾有少量出血点。取死亡小白鼠心血和脾脏划线培养,均获得原感染菌株。攻毒后第7 d,攻毒未死小鼠解剖发现肠壁变薄,内含多量气泡;肝脏表面、心、肺、脾等有不同程度的出血。对照组小白鼠在试验期间精神、食欲和对条件刺激反应都无异常。

图1 大肠杆菌O157∶H7广西分离株的双重PCR检测Fig.1 Results of duplex PCR assay of E.coli O157∶H7 strains isolated from GuangxiM:Marker 1;1:RS1;2:RS2;3:FC1;4:FC2;5:FC3
2.7 大肠杆菌O157∶H7分离株的毒力基因检测5株大肠杆菌O157∶H7广西分离株毒力基因的PCR检测结果表明,5株大肠杆菌O157∶H7携带的毒力基因略有差异,具体情况见表2。

表2 大肠杆菌O157∶H7广西分离株毒力情况Tab.2 Virulence of E.coli O157∶H7 strains isolated from Guangxi
2.8 大肠杆菌O157∶H7分离株的药物敏感试验
选用氨基糖苷类抗生素、四环素类抗生素、β-内酰胺类抗生素、氟喹诺酮类药物、磺胺类抗菌药、多肽类抗生素、大环内酯类抗生素、林可胺类抗生素、氯霉素类抗生素和利福霉素类抗菌药共10类26种抗菌药物对分离得到的5株大肠杆菌O157∶H7进行药敏试验,药敏结果见表3和表4。
药敏结果表明大肠杆菌O157∶H7广西分离株对阿莫西林、氨苄西林、多粘菌素B、罗红霉素、利福平和林可霉素不敏感;对卡那霉素、庆大霉素、链霉素等氨基糖苷类抗生素、复方新诺明和多西环素中度敏感;对头孢西丁、头孢曲松钠、头孢噻肟等β-内酰胺类抗生素、左氧氟沙星、环丙沙星、恩诺沙星等氟喹诺酮类药物、和氟苯尼考高度敏感。
3 讨 论
家畜家禽是大肠杆菌O157∶H7的主要动物宿主和传染源[5-6],本研究对广西985份猪样本、772份鸡样本、718份鸭样本和440份牛样本进行大肠杆菌O157∶H7的细菌分离和鉴定,最终从5份断奶腹泻仔猪的粪便样本中分离鉴定出大肠杆菌O157∶H7,样本细菌分离率为0.17%。在采集的样本中以猪的样本最多,这可能是导致大肠杆菌O157∶H7都分离自猪样本的主要原因。虽然未能从鸡、鸭和牛的样本中检出大肠杆菌O157∶H7,但不代表广西的鸡、鸭和牛未携带大肠杆菌O157∶H7,在今后仍需继续加强对鸡、鸭、牛携带大肠杆菌O157∶H7的监测。
传统的大肠杆菌O157∶H7分离鉴定方法是将待检样本接种到山梨醇麦康凯培养基进行培养后,再挑取培养基上白色半透明菌落进行O157和H7单因子血清凝集反应。由于赫尔曼埃希菌、小肠结肠炎耶尔森氏菌O9血清型、N群沙门氏菌、弗劳地和塞氏枸橼酸杆菌、流产布鲁氏菌、大肠杆菌O157非H7血清型细菌和大肠杆菌O157∶H7的菌体脂多糖的O特异性多糖都含有同样的4-氨基-4,6双脱氢-α-D甘露糖残基,在使用山梨醇麦康凯培养基进行培养时都不能利用培养基的山梨醇,形成的菌落为白色,在形态上不能和大肠杆菌O157∶H7区别[12]。流产布鲁氏菌、大肠杆菌O157非H7血清型细菌与O157∶H7存在着部分相同的抗原,在进行单因子血清凝集试验时,会出现交叉反应[13],从而影响结果的判定。因此使用山梨醇麦康凯培养基和血清凝集反应不能正确鉴定大肠杆菌O157∶H7,必须应用PCR技术对其基因进行鉴定。
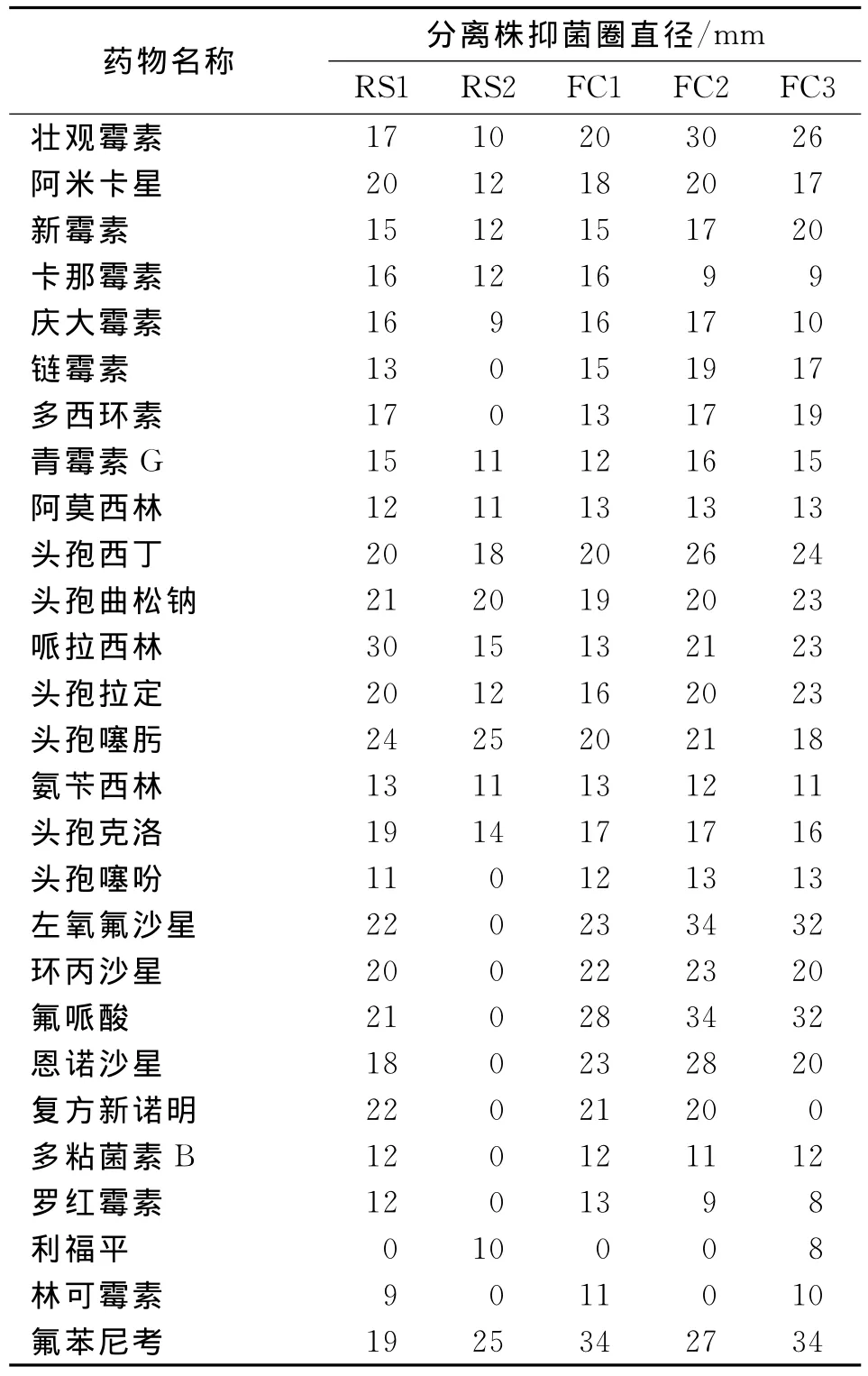
表3 大肠杆菌O157∶H7广西分离株药敏试验结果Tab.3 Drug susceptibility test of E.coli O157∶H7 strains isolated from Guangxi)
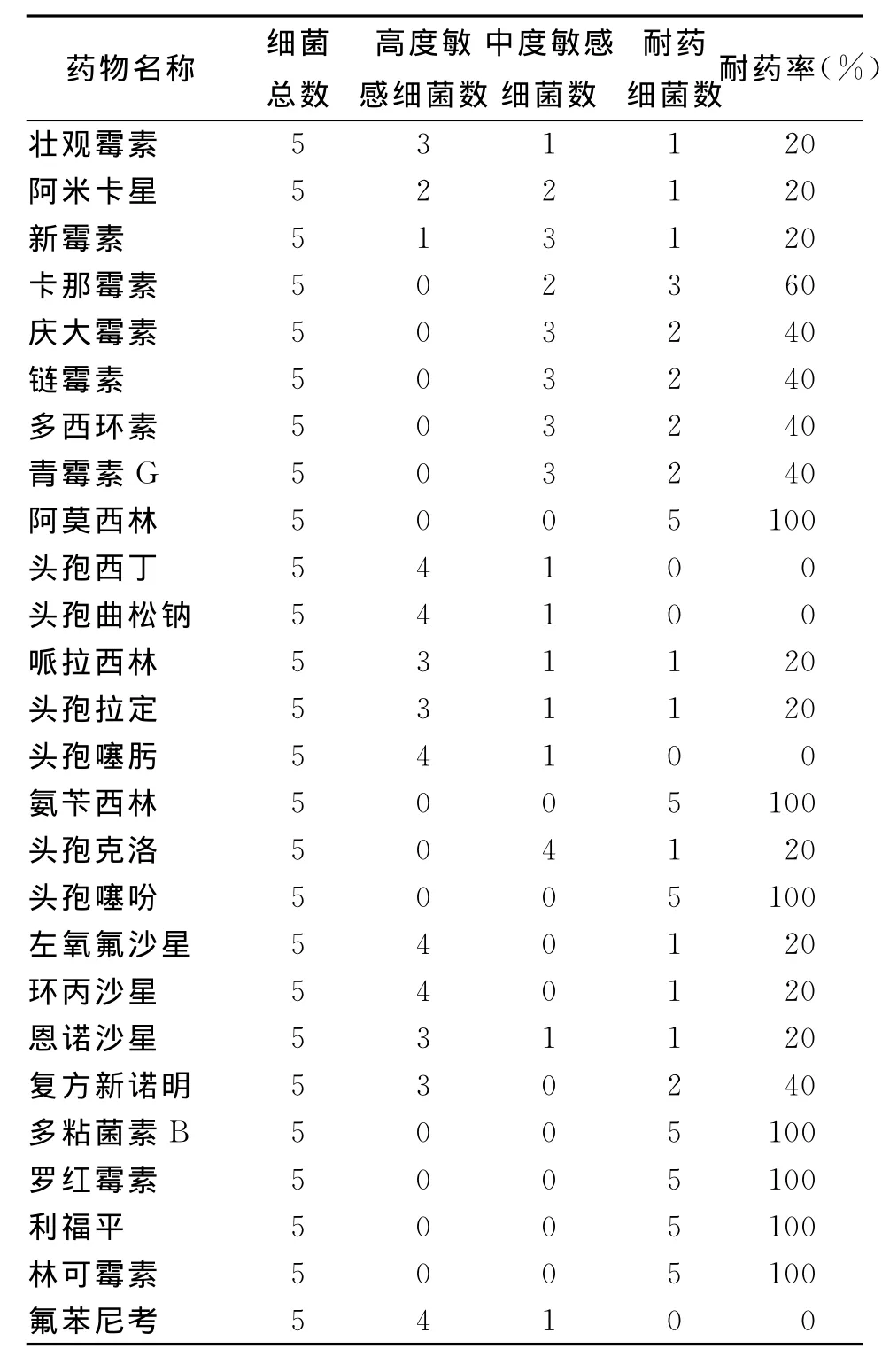
表4 大肠杆菌O157∶H7广西分离株对抗菌药物的耐药率Tab.4 Drug resistance rate of E.coli O157∶H7 strains isolated from Guangxi
大肠杆菌的紧密黏附素介导大肠杆菌与宿主上皮细胞的紧密黏附,是细菌表现其毒性所必需的[14]。志贺样毒素分为志贺样毒素1和志贺样毒素2,它不仅有助于细菌对细胞的黏附和定植,还具有RNA N-糖苷酶作用,可特异性裂解细胞28S r RNA,导致细胞蛋白合成受阻,肠黏膜和血管内皮细胞破坏,引起血液释放到肠腔。多数情况下,只产生志贺样毒素2的菌株毒力较只产生贺样毒素1或产生志贺样毒素1和志贺样毒素2混合型的菌株强[15-16]。在本研究中,有2株分离株携带紧密黏附素基因和志贺样毒素2基因;有3株分离株携带了紧密黏附素基因、志贺样毒素1基因和志贺样毒素2基因。分离株对小白鼠的致病性试验表明分离株携带的毒力基因与其对小白鼠的致死率存在着一定的相关性。
本研究分离的大肠杆菌O157∶H7菌株对目前兽医临床上常用的一些抗菌药物不敏感,如阿莫西林、氨苄西林、多粘菌素B、罗红霉素、利福平和林可霉素;甚至是在同一猪场分离的不同菌株,对同一药物的敏感性也有差异。分离菌株多重耐药性的出现是兽医临床上滥用抗菌药物的结果,由于细菌耐药性可以水平传播,因此,应加强普及基层兽医人员的药物应用知识,避免长期单一使用药物或低剂量使用,防止耐药细菌的产生和扩大。
[1]Su C,Brandt L J.EscherichiacoliO157∶H7 infection in humans[J].Ann Intern Med,1995,123(9):698-714.
[2]孟冬梅,潘劲草,张蔚,等.浙江省首株产志贺毒素大肠埃希菌O157∶H7的分子生物学特性研究 [J].中国卫生检验杂志,2006,16(4):407-409.
[3]武恩平,刘灵芝,张燕.郑州市2005年肠出血性大肠杆菌O157∶H7感染状况调查 [J].现代预防医学,2006,33(12):2455-2456.
[4]张淑红,申志新,关文英,等.河北省食品中大肠杆菌O157∶H7分布及毒力研究 [J].中国卫生检验杂志,2007,17(7):120-122.
[5]唐惠英,何泗新,罗静雯,等.广东省首次从市售家禽家畜中检出 O157大肠杆菌 [J].疾病监测,2000,15(4):131-132.
[6]王建,沈莉萍,刘佩红,等.上海市动物及其产品中大肠埃希菌O157∶H7带菌情况调查 [J].动物医学进展,2005,26(4):87-90.
[7]王红,李秀桂,唐振柱,等.2002-2004年广西食品中肠出血性大肠杆菌O157∶H7的检测分析 [J].广西预防医学,2005,11(5):286-287.
[8]杨冰,王建,王洪敏,等.广东省食品中O157∶H7大肠杆菌分离株的生化特征、毒力因子与耐药性的探讨 [J].中国卫生检验杂志,2006,16(8):971-1002.
[9]Sharma VK,Dean-Nystrom EA.Detection of enterohemorrhagicEscherichiacoliO157∶H7 by using a multiplex real-time PCR assay for genes encoding intimin and Shiga toxins[J].Vet Microbiol,2003,93(3):247-260.
[10]禤雄标,陈泽祥,谢永平,等.猪源大肠杆菌O157∶H7广西分离株的鉴定 [J].中国动物检疫,2010,27(3):52-53.
[11]东秀珠.常见细菌系统鉴定手册 [M].北京:科学出版社,2001:77.
[12]Lior H,Borczyk AA.False positive identification ofEscherichiacoliO157[J].Lancet,1987,1(8528):333.
[13]Stuart FA,Corbel MJ.Identification of a serological cross-reaction betweenBrucellaabortusandEscherichiacoliO157 [J].Vet Rec,1982,110(9):202-203.
[14]Tzipori S,Gunzer F,Donnenberg MS,et al.The role of the eae A gene in diarrhea and neurological complications in a gnotobiotic piglet model of enterohemorrhagicEscherichiacoliinfection[J].Infect Immun,1995,63(9):3621-3627.
[15]O'Brien AD,Newland JW,Miller SF,et al.Shiga-like toxinconverting phages fromEcherichiacolistrains that cause haemorrhagic colitis or infantile diarrhea[J].Science,1984,226(4675):694-696.
[16]Boerlin P,McEwen SA,Boerlin-Petzold F,et al.Associations between virulence factors of Shiga toxin-producingEscherichia coliand disease in humans[J].J Clin Microbiol,1999,37(3):497-503.
