莱姆病螺旋体鞭毛平截性蛋白的表达及其诊断潜力研究
2011-08-21仝彩玲吴银娟周勇志李培英周金林
仝彩玲,吴银娟,周勇志,曹 杰,李培英,周金林
虫学重点开放实验室,上海 200241;
2.安徽农业大学动物科技学院,合肥 230036
莱姆病(Lyme disease)是经硬蜱传播的由若干不同基因型的伯氏疏螺旋体(Borreliaburgdorferi,Bb)引起的一种多个器官系统发生病理损伤的人兽共患病[1]。1982年,Burgdorferi等首先从莱姆病疫区的肩突硬蜱中分离出该病病原体,后被命名为伯氏疏螺旋体[2]。该病主要分布于美国、欧洲和亚洲地区。全球每年发病30万人左右,且不断增长[3]。目前血清学调查证实我国黑龙江、内蒙古、湖北、贵州、吉林、四川、重庆等29个省(市、自治区)的人群中存在莱姆病的感染;病原学研究证实黑龙江、吉林、辽宁、内蒙古、新疆等19个省(市、自治区)存在莱姆病的自然疫源地[4]。不同性别、年龄及种族的人对莱姆病普遍易感[5],人感染莱姆病后,主要引起的症状是慢性游走性红斑、莱姆病性关节炎、脑炎、心肌炎、慢性肢皮炎等。莱姆病发展的不同感染阶段、不同基因型螺旋体引起的临床症状不同[6]。莱姆病临床表现多样,很难仅仅从临床表现诊断该病,因此实验室诊断方法成为莱姆病诊断研究的重点。目前,诊断莱姆病的实验室方法主要是病原体分离培养、免疫学检测方法和分子生物学检测方法。各种方法都存在着一定的优势和不足之处,伯氏疏螺旋体的分离培养条件要求高、时间长;PCR技术对某些组织和体液的灵敏性低,费用相对高;常规的免疫血清学诊断方法,以螺旋体全细胞的超声裂解混合物为抗原,特异性低。另外,由于伯氏疏螺旋体在传播媒介和宿主中,抗原的表达量是不同的,某些抗原只在受感染的哺乳动物宿主体内特定表达的[7],且莱姆病螺旋体的亚种之间存在抗原差异[8-9],给莱姆病血清学诊断抗原的筛选带来了困难。从而使筛选一个特异性强和敏感性高的莱姆病诊断抗原成为莱姆病实验室诊断研究的一个重点。研究表明[10]在莱姆病螺旋体众多的蛋白成分中,其外膜的蛋白Flagellin A鞭毛蛋白具有很强的免疫原性,可在感染后最早检测到其抗体,其编码基因位于染色体上,在传代中不易丢失,其异源性较质粒编码的外膜蛋白小,经基因核苷酸序列和编码蛋白的氨基酸序列的比较发现莱姆病螺旋体鞭毛蛋白同梅毒螺旋体、大肠杆菌的鞭毛蛋白在N、C端有很高的同源性,而在中心区域则变异较大,该区域不与梅毒及正常人血清反应,可作为莱姆病早期血清学诊断的抗原标志。依据Flagelline A的这些作为诊断抗原的潜质,我们用基因工程的方法获取螺旋体鞭毛蛋白的特异性区段的重组“平截型蛋白”,作为莱姆病的诊断抗原。由于动物莱姆病流行学调查缺少血清学方法,人用莱姆病检测试剂盒多为国外产品,且价格昂贵。重组伯氏属螺旋体为中国莱姆病的诊断试剂盒的开发奠定基础。
1 材 料
1.1 基因克隆、测序、表达所用的菌株和质粒 克隆载体为PGEM-T easy Vector,购自Promega公司;受体菌为E.coliDH5ɑ感受态细胞,购自天更生化科技有限公司;表达载体为PGEX-4T-1,受体菌为BL21,购自北京天根生物有限公司。
1.2 主要试剂 树脂型TM基因组DNA快速提取试剂盒、树脂型质粒DNA小量抽取试剂盒、PCR产物纯化及胶回收试剂盒、d NTP、琼脂糖、琼脂粉均购自上海赛百胜基因技术有限公司;DNAMarker DL2000、DNAMarker DL15000购自上海皓嘉科技发展有限公司;蛋白Marker购自Fermentas公司;工具酶、试剂、Premix TaqDNA聚合酶、限制性内切酶EcoR I、限制性内切酶XhoI、T4DNA连接酶、为Promega公司产品,BSK培养基购自Sigma公司;Goat anti human IgG购自Jackson公司;蛋白胨、酵母提取物购自OXOID公司。
1.3 引物合成 根据已知的BorreliaGarinii株编码鞭毛蛋白质的基因序列(序列号:CP000013.1)。设计一对引物。编码鞭毛蛋白的基因全长共1 008 bp,选取自第5′端394-415为引物序列。第783-799为下游引物序列,5′端均加有限制性内切酶EcoR I识别的位点,3′端加有限制性内切酶x HoI识别的位点。
上游引物∶5′-CGGAATTCCAAATGCACATGTTGTCAAAC-3′
下 游 引 物 ∶ 5′-GGCTCGAGATTTGCTCTTTGATCAC-3′
引物由上海赛百胜基因技术有限公司合成。
1.4 PCR反应体系及反应条件 反应总体系为25 μL,其中premix TaqDNA酶12.5μL、上游引物1 μL、下游引物1μL,伯氏疏螺旋体基因组DNA模板2μL,水8.5μL。反应条件:94℃预变性5 min,94℃45 s,57℃45 s,72℃1 min,30个循环,72℃延伸7 min。
2 方 法
2.1 螺旋体菌株及培养 伯氏疏螺旋体Borrelia Garinii由本实验室分离自新疆亚洲璃眼蜱并由本室保存。螺旋体培养条件:BSK培养基,微需氧,32℃,10~14 d,暗视野下可见螺旋体。
2.2 螺旋体DNA的提取 参照赛百盛公司的基因组DNA提取试剂盒使用说明进行。
2.3 目的片段的克隆
2.3.1 PCR产物的纯化与PGEM-T easy Vctor载体的连接和转化 PCR产物首先在含有溴化乙锭的1%的琼脂糖凝胶上电泳,确定目标条带后在紫外灯下切下目的条带用柱式DNA琼脂糖回收试剂盒回收PCR产物,然后连接到克隆质粒载体试剂盒PGEM-T easy,4℃连接过夜。连接产物转化大肠杆菌DH5α中,转化方法参考天更感受态细胞的使用说明。涂布于含AMP的LB琼脂平板上,37℃培养过夜后,挑取阳性克隆。
2.3.2 菌落PCR鉴定 用灭菌的干净牙签随机各挑取10个拟为阳性的菌落,接种于一新的Amp的LB固体培养板上,再洗脱于加有20μL无菌水的1.5 m L灭菌离心管中,在沸水中煮10 min,做为PCR的模板,进行PCR,PCR结果电泳,有目的条带的为阳性克隆。培养板上的编号与离心管上的编号相一致,培养板在37℃恒温箱中培养。
2.3.3 质粒酶切鉴定 把经过测序证实的阳性单克隆接种到AMP的LB液体培养基,过夜培养。按树脂型质粒DNA小量抽取试剂盒试剂盒说明书提取质粒并纯化,再经EcoRI、XhoI切割(37℃,3 h),在1% 琼脂糖凝胶中电泳,紫外灯下观察结果。2.4 目的片段重组表达质粒的构建 将插有目的片段的T-载体经EcoRI、XhoI双酶切,用1%琼脂糖凝胶电泳回收目的片段,将回收的目的片段与经Eco RI、XhoI酶切的PGEX-4T-1连接,连接产物转化到DH5a中,挑取拟阳性克隆,经菌落PCR、质粒酶切及阳性克隆用Sangers双脱氧核酸末端终止法测序,由上海美季生物技术有限公司完成,以鉴定阳性克隆。把经测序证实的阳性菌落在含有Amp+的LB液体培养基中37℃培养,抽提质粒,质粒转化BL21受体菌进行表达。
2.5 “平截型”鞭毛蛋白的表达
2.5.1 重组表达质粒转化E.coliBL 21(DE3)受体菌,方法同前。
2.5.2 诱导 转化的菌种接种Amp+LB液体培养基,过夜培养。菌液按照1∶100的比例重新接种到Amp+LB液体培养基培养2~3h,待其OD值达到0.6左右加入诱导剂IPTG,使其终浓度为1 mmol/L,经37℃200 r/min振摇6~8 h,,分别于1、3、5、7、9 h收集菌液1 m L 13 000 r/min,离心2 min,收集菌体。
2.5.3 聚丙烯酰胺凝胶电泳鉴定 参照标准方法进行。
2.6 “平截型”鞭毛蛋白的纯化 利用GST标签蛋白和固定在Resin的谷胱甘肽特异性相结合,最后用谷胱甘肽转移酶置换出目的蛋白,从而使带有标签蛋白的目的蛋白得到纯化。培养诱导400 m L的细菌培养液,超声裂解细胞,离心后取上清液制备纯化样品,进行纯化。纯化步骤按照说明书方法进行。
2.7 ELISA检测研究
2.7.1 抗体的制备 400μL螺旋体单克隆培养物腹腔接种25只小白鼠,5只小白鼠作为对照组不接种螺旋体。3 w后小鼠眼球采血,分离阳性血清。
2.7.2 ELISA方法抗原的包被 分别以空载体诱导的GST标签纯化蛋白做阴性对照,PBST溶液做空白对照,纯化的重组蛋白做抗原,包被96孔板,4℃,湿盒内包被过夜;倾去抗原液,用PBST洗涤3次,每次5 min,纸巾上拍干;加封闭液,200μL/孔,37℃,湿盒内封闭1 h;倾去封闭液,用PBST洗涤,方法同上;制备好的抗血清按一定浓度倍比稀释后,100μL/孔加入96孔板中,37℃作用2 h;加入100 μL按一定浓度稀释的辣根过氧化物酶标记的二抗。37℃温育10 min;倾去二抗,用PBST洗涤,方法同上;加入底物ABTS避光,37℃避光温育,半小时内用酶标仪在波长410 nm处测OD值。
2.7.3 结果判定 依次测得各反应孔OD值,取复孔的OD平均值,P是小鼠接种螺旋体后采集的阳性血清的OD平均值,N是阴性复孔的OD平均值,计算同一工作条件下,P/N值,当P/N值大于等于2为阳性结果,小于2为阴性结果。
3 结 果
3.1 目的基因的扩增与鉴定 PCR扩增出的基因片段,分子量大小约421 bp,符合预期值(结果见图1)。将此片段克隆入T载体,经蓝白斑、菌落PCR及质粒酶切鉴定,可筛出阳性克隆,酶切鉴定结果见图2。
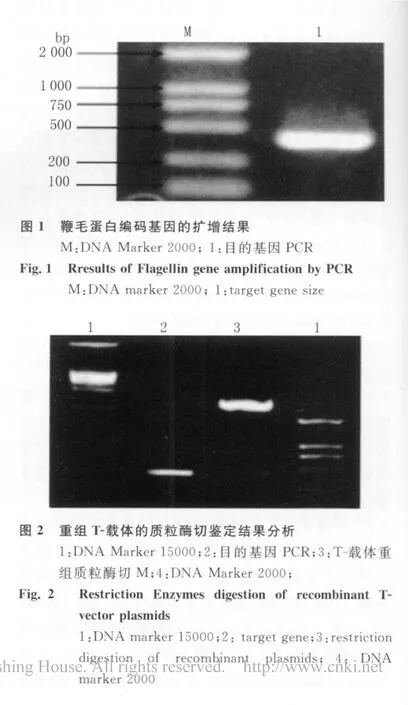
3.2 目的基因表达载体的构建与鉴定 克隆有目的基因的T-载体用EcoRI、XhoI切下的目的基因克隆入PGEX-4T-1,转化入BL21受体菌,挑取10个克隆做菌落PCR,有8个阳性转化率80%。取阳性克隆做质粒的酶切鉴定,经EcoR I、XhoI酶切后,可见从重组的PGEX-4T-1切下一片段,与原始PCR产物长度一致,约421 bp(见图3)。通过以上结果证实,目的基因表达载体构建成功。
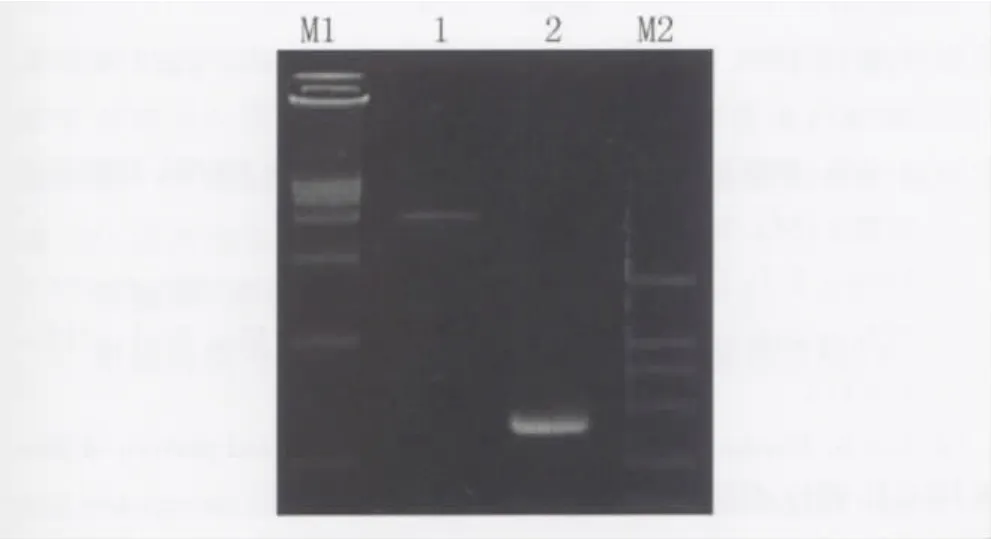
图3 重组表达载体的质粒酶切鉴定结果分析M1:DNA Marker 15000;1:重组表达质粒酶切;M2:DNA Marker 2000;2:鞭毛蛋白保守区段基因PCRFig.3 Identification of the recombinant expressed plasmid M1:DNA marker 15000;1:restriction digestion of recombinant expressed vector;2:target gene size;M2:DNA marker 2000
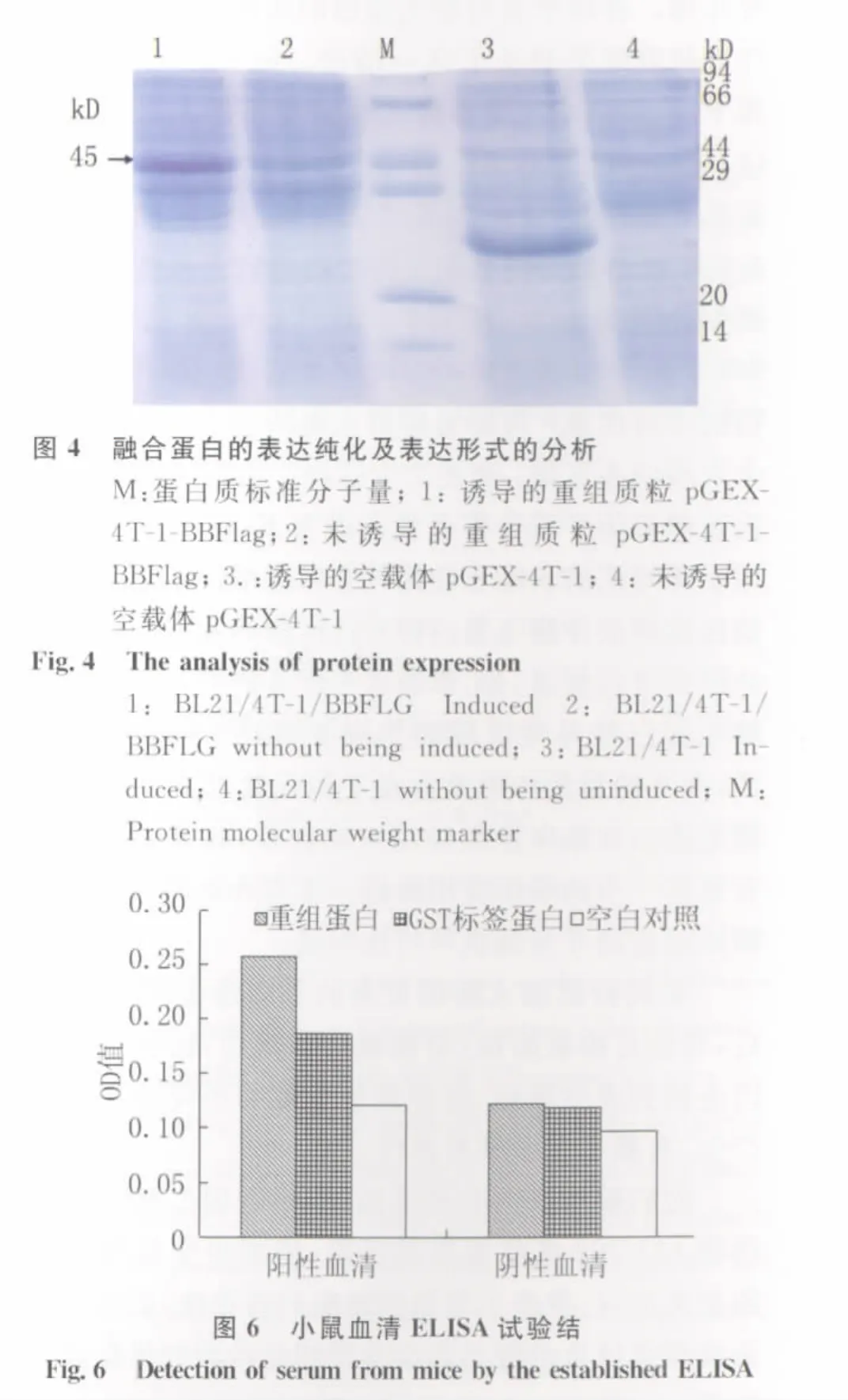
3.3 “平截型”鞭毛蛋白表达、鉴定与复性 将阳性克隆的质粒转化入BL21(DE3)受体菌,BL21(DE3)为溶原菌,带有SP6、T7强启动子,故用IPTG诱导目的基因的表达。挑取阳性克隆诱导后经SDS-PAGE电泳,可见有表达的蛋白带(分子量介于45~50 k D),未诱导者无此带,同时可见空白载体转化的BL21(DE3)经诱导后有一条26 k D的表达带,此蛋白为标签蛋白表达产物。根据计算,目的基因与标签蛋白表达的融合蛋白的分子量应为40 k D左右,电泳结果如图4。诱导结果表明,在细菌培养至OD值0.4~0.6时,加IPTG诱导7 h后蛋白表达量较大。以包涵体和可溶性2种形式存在于受体菌内,蛋白在以包涵体为主要的表达形式,可溶性蛋白也有小量表达。
3.4 ELISA结果 取400μL螺旋体单克隆培养物腹腔接种25只小白鼠,5只小白鼠作为对照组不接种螺旋体。3 w后小鼠眼球采血,25只感染动物的血清作为一抗,测得的ELISA试验结果OD值平均数作为其阳性血清的OD值;5只未感染动物的血清作为一抗,测得的ELISA试验结果的OD值平均数作为阴性血清OD值,结果见图6,从图6可以看出,阳性血清与重组蛋白反应,其OD值-空白对照OD值/阴性血清OD值-空白对照OD值>2,可明显区分出阴性和阳性样品,同时GST标签蛋白不与阳性血清发生较强的反应,同时不影响检测结果。
4 讨 论
选择莱姆病螺旋体鞭毛基因的中央区段作为血清学检测莱姆病的抗原有以下几个方面的优点:1.由于编码鞭毛蛋白的基因位于螺旋体染色体上,较编码在质粒上的蛋白相对稳定;2.莱姆病螺旋体鞭毛蛋白的中心区段是其种内的保守区域,在莱姆病螺旋体种属内不同地理株高度同源(99%左右);3.机体感染后,此抗原特异性的抗体出现最早,故是理想的全抗原替代者。另外,DNA序列分析表明,Bb与其它种属菌如梅毒螺旋体的同源性主要集中在氨基端与羧基端。其氨基端(1-137)与梅毒螺旋体同源性为52%,羧基端(262-366)为54%,而中央区段(137-262)仅13%。X-射线衍射分析结果显示[11],在鞭毛蛋白的二级结构中,其氨基端与羧基端位于蛋白的疏水内核,而中央区段则构成蛋白质的外表面,在免疫应答过程中起重要作用,其氨基端与羧基端则在维持蛋白质稳定的空间构象上起重要作用。各国学者对鞭毛蛋白的各区段的抗原特异性的研究结果验证了这一结论。如Robinson[12]发现P137-262不与梅毒病人血清和正常人血清起反应,P64-311则有微小的交叉反应性,而54% 的梅毒病人血清及17% 的正常人血清与全区段抗原起反应,氨基端与羧基端区段与梅毒病人血清的反应性则分别为46% 和15%。Berland[9]发现P165—261、P197—241、P197—273 3个区段(位于鞭毛蛋白的中央区域)与莱姆病病人血清的反应性强于2个末端的各区段,稍差于全区段。由以上可见用伯氏疏螺旋体平截性鞭毛蛋白做为ELSIA诊断抗原用于莱姆病的诊断有较强的临床应用价值。有人对伯氏疏螺旋体鞭毛蛋白特异性区段的基因克隆和表达研究进行报道,如:李新民等作者的伯氏疏螺旋体鞭毛蛋白特异性区段的克隆和表达[13],相比于本文,本文的目的和侧重点在于伯氏疏螺旋体平截性鞭毛蛋白在临床诊断应用性的探索,其克隆和表达有更进一步的临床应用价值。该文为莱姆病临床诊断试剂盒的开发提供可行性借鉴。
本试验把加入酶切位点的基因连接到T载体后,转化后提取质粒,对质粒进行酶切,回收目的基因连接到表达质粒,这样避免了酶切不完全产物的产生,有利于试验顺利进行。
我们根据以上的研究结果,用基因工程的方法获得131-266氨基酸残基区段,能减少全抗原引起的交叉反应,提高了莱姆病诊断的特异性,证实了伯氏疏落旋体重组鞭毛蛋白是莱姆病诊断的优良候选抗原。
[1]仝彩玲,李培英,周金林.莱姆病诊断技术研究进展[J].中国动物传染病学报,2009,17(3):76.
[2]Steere AC,Malawista SE,Snydman DR,et al.Lyme arthritis:anepidemic ofoligoarticular arthritis in children and adults in three conneticut communities[J].Arthritis Rheum,1977,20(1):7-11.
[3]Vander FK.Everything you need to know about Lyme disease and other tick-borne disorders [J]. New York.NY John Wiley&Sons Inc,1997:20-47
[4]万康林,张哲夫,张金声,等.中国20个省、区、市动物莱姆病初步调查研究[J].中国媒介生物学及控制杂志,1998,9 (5):366-371.
[5]刘敏,王树声.莱姆病研究进展[J].广西预防医学报,2001,7:311-314.
[6]仝彩玲.蜱体伯氏疏螺旋体分离鉴定及莱姆病ELISA检测方法的建立[M].安徽:安徽农业大学,2010:3.
[7]Molloy P J,D H Persing,V PBerardi.False-positive results of PCR testing for Lyme disease[J].Clin Infect Dis,2001,33(3):412-413.
[8]Das S,Barthold S W,Giles S S,et al.Temporal pattern of Borrelia burgdorferi p21 expression in ticks and the mammalian host[J].J Clin Investig,1997,99(5):987-995.
[9]Roessler D,U Hauser,B Wilske.Heterogeneity of Bmp A(P39)among European isolates of Borrelia burgdorferi sensu lato and influence of interspecies variability on serodiagnosis[J].J Clin Microbiol,1997,35(11):2752-2758.
[10]Bruckbauer HR,Preac-Mursic V,Fuchs R,et al.Cross-reactive proteins of Borrelia burgdorferi.Eur J Clin Microbiol Infect Dis,1992:224-232.
[11]Namba K.structure of core and central channel bacteria flagella[J].Nature,1989,342:648.
[12]Robinson,et al.Analysis of Humoral response to the Flageline Protein of Borrelia burgdorferi:Cloneing of Regions Capable of different differentiating Lyme Disease from syphilis.J Cline Microbiology,1993,31:629.
[13]李新民,张启恩,张泮河,等,伯氏疏螺旋体鞭毛蛋白特异性区段的基因克隆和表达[J].中国人兽共患病杂志,1999,15(4):24-26.
