肝切除术中肝血流阻断技术的合理应用
2011-08-17胡智明邹寿椿赵大建
胡智明 邹寿椿 赵大建
浙江省人民医院肝胆外科,浙江杭州310014
血流阻断是肝肿瘤切除术中减少及控制出血的重要手段,但血流阻断也会在不同程度上影响血流动力学的变化,因此,在肝切除手术中必须合理、灵活地运用肝血流控制方法。第一肝门入肝血流阻断法( Pringle法)是目前肝脏切除中最常用的肝血流阻断方法,其优点为可以完全阻断肝动脉和门静脉的入肝血流,无需解剖肝门,具有控制出血确切,简便易行,安全易于推广等优点。但位于肝静脉主干和(或)肝腔静脉结合部的病变,经阻断第一肝门有发生逆流性出血或空气栓塞的可能,其后果常常是致命的;另一方面, 随着临床上术后肝功能衰竭而死亡病例不时出现,人们对肝血流阻断造成的肝缺血与再灌注损伤也日益重视。因此, 如何合理应用肝血流阻断技术, 使术中失血减少又不加重肝脏损伤是肝外科医师极为关注的问题。理想的控制肝创面出血和保证术中、术后安全的血流阻断方法应具备以下条件:①能有效控制肝创面出血和空气栓塞;②残肝无缺血和再灌注损伤;③不影响其他脏器的血液循环;④保持全身血液动力学稳定;⑤减少恶性肿瘤医源性转移的发生率。目前,肝血流阻断技术主要分为入肝血流阻断、全肝血流阻断、区域性肝血流阻断三类,现根据笔者所在医院肝切除术中应用不同肝血流阻断技术的体会, 分别对各种不同血流阻断技术应注意的问题结合文献逐一讨论。
1 入肝血流阻断方法
1.1 Pringle法
自1908年Pringle开始应用暂时阻断入肝血流切肝以来,作为一种应用最广泛的控制切肝时出血的措施,由于只需阻断肝十二肠韧带即可达到阻断入肝血流的目的,因此操作简便易行,常温下肝血流阻断仍以Pringle 法阻断为首选。Pringle 法阻断主要用于未累及肝静脉主干和(或)肝腔静脉结合部的病变的肝切除术,一般认为持续阻断安全的极限是30 min,一次不超过15 min。有肝硬化者以<10 min为宜,阻断开放3~5 min后视需要再作第2或3、4次血流阻断。但对未切除残留的肝组织因缺血再灌注造成不同程度的损害严重者可引起不可逆转的肝功能衰竭而死亡,故其阻断时限必须严格控制。目前对位于肝静脉主干和(或)肝腔静脉结合部的病变,有时会发生肝静脉损伤逆流性出血或空气栓塞,故此类患者宜采用全肝血流阻断或区域性肝血流阻断技术[1]。
1.2 半肝血流阻断法
虽然Pringle法在大多数切除手术中止血效果明显,但根据传统观点常温下阻断入肝血流的安全时限是有限制的,尤其在合并肝硬化的肝切除,时间更应控制在10 min之内,如超过这一时限就可能导致术后残留肝组织的缺血损害,因此 1987年Makuuchi提出了半肝血流阻断方法[2]。半肝入肝血流阻断有两种解剖肝门的方法:①经肝门板途径:不解剖肝十二指肠韧带,沿肝总管行经向肝门寻找左右肝管汇合部,打开肝门板,于其上方肝网膜处或在肝周韧带下方横突处插入直角钳,在肝实质中格氏鞘(Glisson)外轻轻钝性分离,在无阻力的情况下向肝十二指肠韧带后方、门静脉分叉部与尾状叶交界处穿出,导入8号导尿管。切肝时此导尿管缩紧即可阻断患侧半肝的入肝血流(图1)。②肝门解剖途径:分别游离出患侧肝动脉和门静脉支,可以同时阻断或结扎患者入肝血管,行半肝切除时结扎患侧肝动脉和门静脉。因为阻断的仅是单侧入肝血流,不影响健侧半肝的正常血供,避免了其缺血再灌注损伤, 全身血液流动力学平稳,对阻断时间无严格限制,为从容进行手术创造了条件,术中出血少,术后肝功能损害轻,有利于保护合并肝硬化的肝肿瘤患者的肝功能。同时保证了胃肠道血流通畅,避免了可能发生的细菌移位和内毒素血症[3]。半肝血流阻断适用于位于半肝或半肝内肿瘤的切除。对于较大的中肝叶肿瘤切除可采用交替半肝血流阻断,行肿瘤左侧缘切除时阻断左肝门,保持右肝门通畅,,切断中肝静脉后改行肿瘤右侧缘切除时阻断右肝门,松开左肝门,这样保证每侧肝门仅阻断1次[4],但不适用于肿瘤侵犯第二肝门、肝静脉和下腔静脉结合部肿瘤, 或合并肝静脉、下腔静脉癌栓等复杂情况下的肝切除术。

图1 右肝入肝血流阻断 (RHP:右肝蒂,LHP:左肝蒂)
2 全肝血流控制技术
1966年,Heaney 等首先提出全肝血流阻断(total hepatic vascular exclusion,THVE)下施行肝切除这一概念。需先行游离腹腔动脉出口腹主动脉段、肝下腔静脉、肝上腔静脉,其阻断顺序是腹主动脉→第一肝门→肝下下腔静脉→肝上下腔静脉。开放阻断的顺序与阻断相反, 阻断时间可达30 min。但阻断腹主动脉会导致下肢和腹内脏器缺血、缺氧及酸性代谢产物和肠道内毒素产生,这些物质进入体循环会造成机体损害。低温下全肝血流阻断的无血切肝技术,是由Fortner等[5]在1974年报道,手术中冰盐水灌注肝脏,低温状态下肝脏可以耐受较长时间的缺血和缺氧过程。在体外静脉转流和内脏静脉循环转流的情况下,可持续耐受缺氧达120 min。但该方法对血流动力学的影响较重,易出现电解质紊乱,同时低温灌注可造成凝血机制异常,故已很少应用。
Huguet等[6]在1978年报道了常温下改良式全肝血流阻断法(hepatic vascular exclusion,HVE),他认为阻断腹主动脉和肝脏低温灌注是没有必要的,他的阻断次序为肝蒂→肝下下腔静脉→肝上下腔静脉,开放时次序相反。该法减小了对血流动力学的影响, 但阻断后仍然可使收缩压增加80%, 肺动脉压下降25%,心脏指数下降40%,手术死亡率高达28%(主要为肝硬化患者)。HVE通过对下腔静脉和肝蒂的控制来达到对全肝血流的阻断,能达到肝脏的完全无血状态,适用于:肿瘤巨大,紧邻或侵犯第二、三肝门,肝静脉和下腔静脉,或合并肝静脉、下腔静脉癌栓等复杂情况下的肝切除术。其优点是扩大了手术切除的适应证,可有效避免肝后下腔静脉或肝静脉意外损伤所引起的大出血、空气栓塞等并发症。缺点是由于对全肝血流的阻断,对全身血流动力学的影响和肝缺血再灌注损伤较Pringle法严重, Belghiti等[7]的随机对照研究表明HVE 较Pringle 法术后并发症发生率高2.5倍 。
3 区域性肝血流阻断方法
1982年Bismuth首先报道创伤相对较小的区域性血流阻断技术,它对术中出血的控制与全肝门血流阻断的疗效相同,对非病变肝脏几乎没有缺血、再灌注损伤及血流动力学影响。肝区域性血流阻断通常是指肝入肝血流区域性阻断也就是半肝血流阻断或肝段血流阻断,1999年Chan等[8]提出选择性出入肝血流阻断法(selective hepatic vascular exclusion,SHVE),此后,国内也相继出现报道[9]。
入肝血流阻断的方法与前已提及的半肝血流阻断相同,出肝血流阻断也就是肝静脉阻断,是根据切除范围单独或联合阻断三支肝静脉主干来实现对离肝血流的控制,由于保证了下腔静脉血流通畅,对全身血流动力学影响大大减小。该法根据肝静脉的解剖特点在肝实质内壁薄,呈筛网状,其根部移行于肝外的下腔静脉处的壁较厚,易分离,不易捅破,并有腔静脉韧带包绕,这就为肝静脉的肝外分离打下了基础。一般先打开肝镰状韧带与左、右冠状韧带,一直分离到第二肝门处。右肝静脉分离要首先辨认两个重要的解剖标志:下腔静脉韧带、腔静脉窝。分离肝顶部裸区至肝后腔静脉右侧壁,根据需要分离结扎肝短静脉, 有一束(片)增厚的纤维结缔组织覆盖于肝后下腔静脉的上段称为下腔静脉韧带(又称肝背侧韧带、Dorsal Ligament 或Makuuchi韧带)。附在右肝静脉表面,一般情况下没有粘连,是一薄的纤维鞘。在肝上下腔静脉的右缘小心离断下腔静脉韧带以后, 显露右肝静脉根部右侧壁及下缘, 右肝静脉汇入下腔静脉右缘的部位就得以显露下腔静脉窝,又称肝静脉裂隙,是位于下腔静脉前方,右肝静脉与左、中肝静脉合干的右侧之间形成的一个倒三角形间隙。把腔静脉窝表面的腹膜分离干净,可显露右、中肝静脉内侧壁,沿腔静脉窝向下分离,顺着右肝静脉走行,向右分离则可分出右肝静脉,顺此通道绕过一根血管悬吊带可用来控制右肝静脉(图2)。左、中肝静脉大多以共干汇入肝后下腔静脉,共干平均长度为1.2 cm, 最长可达3.5 cm。常规游离左肝外侧叶后将肝左叶向右翻转,显露下腔静脉左缘。在下腔静脉左缘仔细寻找共干与腔静脉之间的间隙,沿此间隙探入直角钳向右上方分离,左手食指在肝静脉间隙处与钳尖相对作为引导[10-11],或沿腔静脉窝共干右侧壁腔静脉前壁向左下方分离,再将左外叶向右上方翻起,于尾状叶顶部,静脉韧带后缘、腔静脉前缘之间向右上方分离,使分离钳经共干与腔静脉之间通过,至腔静脉窝,预置阻断带[12](图3、4)。术前肝静脉血管成像(CT或MRI)可以帮助观察肝静脉的位置、角度、合干及分干的情况,对于术中指导手术入路、避免肝静脉的损伤及肝静脉的分离、结扎,具有重要意义。
选择性出入肝血流阻断:术中,行半肝血流阻断时,应先阻断同侧入肝血流再阻断肝静脉,必要时分离结扎肝短静脉使半肝处于相对无血状态,适用于靠近第二肝门区的肿瘤切除。
交替选择性出入肝血流阻断方法:分离双侧肝门和双侧肝静脉后按需左右交替进行,阻断适用于较大的且靠近第二肝门区的中肝叶肿瘤切除[5]。该技术的优点:使肝切除区域的门静脉、肝动脉及肝静脉血流全部阻断,能较单独阻断第一肝门血流进一步减少切肝时的出血量。尤其是可减少肝静脉返流创面出血;可防止肝静脉破裂引起的大出血和空气栓塞。肿瘤完整切除后先放开入肝的阻断带,查看肝静脉有无破损,有损伤时可采用5-0或6-0 Prolene 线妥善修补(图5),再放开阻断的肝静脉,肝断面处理时也不会发生肝静脉大出血和空气栓塞。笔者研究结果发现:SHVE组术中出血及输血量明显少于HVE组(P<0.05);术后第1天谷丙转氨酶,术后第3天总胆红素SHVE组均低于HVE组(P<0.05);术后2 d平均引流量SHVE组明显少于HVE组(P<0.05);治疗总费用SHVE组低于HVE组(P<0.05)。选用选择性出入肝血流阻断后可使得肿瘤切除时间从容,分离血管时花费时间虽稍长,肝断面的处理相对简单,总的手术时间并不延长。术后继发性出血、胸水、腹水、胆漏等并发症明显减少[1],是一种止血效果更为确切使手术平稳安全的血流阻断方法。
近20年来肝切除技术得到了进一步扩展和提高,但Pringle第一肝门血流阻断法仍然适用于大部分肝肿瘤切除术,对肿瘤巨大需行半肝切除术或合并严重肝硬化或肝储备功能严重不足者可考虑用半肝血流阻断法,以避免残留肝脏因血流阻断缺血和再灌注受到伤害;对位于肝静脉主干,如肝、腔静脉结合部病变切除,各种全肝血流阻断方法因对血流动力学的严重影响而被逐渐慎用,目前以选择性血流性出入血流阻断法为首选。SHVE方法的应用完全改变了以往因害怕损伤肝、腔静脉而放弃手术切除的消极局面。
笔者认为只要熟练掌握肝静脉和腔静脉的解剖特点,分离阻断右肝静脉及左、中静脉干并非难事,采用SHVE血流阻断技术对于第二、三肝门部肝肿瘤的手术切除是安全可行的血流阻断方法。

图2 右肝静脉阻断 (RHV:右肝静脉)

图3 右肝静脉、中肝左肝静脉共干分别阻 (LHV:左肝静脉, MHV:中肝静脉)
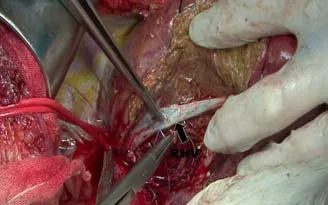
图5 肿瘤完整切除后先放开阻断的第一肝门,查看肝静脉有无破损,有损伤需要采用5-0 或6-0 Prolene 线妥善修补(IVC:下腔静脉)
[1]胡智明,吴伟顶,张成武,等.选择性出入肝血流阻断在肝脏巨大肿瘤切除术中的应用[J].中华肿瘤杂志,2008,30(8):620-622.
[2]Makuuchi M, Mori T, Gunven P, et al. Multiple system organ damage resulting from prolonged hepatic inflow interruption[J]. Arch Surg, 1987,164(4): 155-158.
[3]张宇华,赵大建,胡智明,等.区域性肝血流阻断切肝术53例临床分析[J].浙江医学,2008,30(10):1092-1093.
[4]周伟平,李爱军,傅思源,等.选择性肝血流阻断切肝术(附213例报道)[J].肝胆胰外科杂志,2006,18(1):10-12.
[5]Fortner JG, Shiu MH, Kinne DW, et al. Major hepatic resection using vascular isolation and hypothermic perfusion [J]. Ann Surg, 1974, 180(4): 644-652.
[6]Huguet C, Nordlinger B, Galopin JJ, et al . Normothermic hepatic vascular exclusion for extensive hepatectomy [J]. Surg Gynecol Obstet, 1978, 147(5): 689-693.
[7]Belghiti J, Noun R, Zante E, et al. Portal triad clamping or hepatic vascular exclusion for major liver resection. A controlled study [J]. Ann Surg, 1996,224(2): 155-161.
[8]张宇华,胡智明,赵大建,等.肝静脉阻断技术在近第二肝门巨大血管瘤切除术中的应用[J].中华普通外科杂志,2011,26(1):89-93.
[9]胡智明,赵大建,张宇华,等.选择性出入肝血流阻断运用肝脏肿瘤切除[J].中华普通外科杂志,2011,26(2):123-126.
[10]Chan MK, Kwork PC, Chan SC, et al. PEI as a possible curative treatment for malignant portal vein thrombosis in hepatocellular carcinoma[J]. Cardiovasc Intervent Radiol, 1999, 22(4): 3261.
[11]Yantamoto K, Masuzawa H, Kato M, et al. Evaluation of combined therapy with chemoembolization and ethanol injection for advanced hepatocellular carcinoma[J]. Semin Oncol, 1997, 24(suppl 6): 50-55.
[12]Yamakado K, Tanaka N, Nakatsuka A, et al. Clinical efficacy of portal vein stent placement in patients with hepatocellular carcinoma invading the main portal vein[J]. J Hepatol, 1999, 30(4): 660-668.

胡智明,男,1966年生人。浙江省人民医院肝胆外科主任医师,浙江省人民医院海宁医院大外科主任。中国抗癌协会胆道肿瘤专业委员会委员,浙江省医学会医学鉴定专家库成员。从事普外科临床、科研、教育工作20年,2007~2008年公派日本留学,学习消化道肿瘤外科治疗,对肝脏肿瘤、胆胰系结石、胰腺肿瘤、胰腺炎、门脉高压、胃癌等疾病的诊断和治疗有较深的造诣。参与多项国家级课题,目前承担两项省级重要课题,参编《外科临床思维》,为多个杂志的特邀审稿专家,发表专业论文30余篇,其中国家一级杂志20余篇。
