多重荧光定量PCR技术快速诊断唐氏综合征方法的建立及临床应用
2011-08-13钟泽艳万均辉田佩玲韦相才张清健李铭臻黄立英邓文国
钟泽艳 万均辉 田佩玲 韦相才* 张清健 李铭臻 黄立英 邓文国
1.南方医科大学医学遗传教研室(广州,510515);2.广东省计划生育科学技术研究所;3.中山大学达安基因诊断中心
唐氏综合征(又称21-三体综合征或先天愚型)属常染色体疾病,是最常见的一种严重的先天性智力发育不全性遗传疾病。在新生儿中的发生率为1/600~1/800,全国每年大约有2.6万唐氏综合征患儿出生,给患儿家庭及社会带来沉重的经济和精神负担[1]。该病目前还缺乏有效的治疗手段,通过产前筛查或产前诊断预防唐氏综合征患儿出生是防治该病的重要措施。目前临床上采用的筛查方法是孕妇血清标志物非特异性筛查,特异度低,假阳性率高;而传统的产前诊断方法则需取羊水标本,创伤较大,且程序繁琐,检验周期长。因此,如何建立快速有效、简便、准确,易于推广的诊断方法是研究的热点之一。近年来,唐氏综合征产前诊断在取材方式、遗传标记的选择和分子生物学检测方法方面取得广泛的进展。本文选择21号染色体杂合度较高的短串联重复序列(STR)位标,通过应用多重荧光定量聚合酶链反应(QF-PCR),对106例正常人外周血DNA进行分析,结果用遗传数理统计方法进行统计,计算出21号染色体的3个STR位标的多态性信息含量(PIC),并用该方法对25例唐氏综合征患儿外周血和10例孕妇羊水进行分析,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 研究对象106例无亲缘关系个体的外周抗凝静脉血来自本所优生遗传门诊,外周抗凝静脉血采集于广州智灵学校,羊水标本由中山大学达安基因诊断中心提供。
1.1.2仪器和试剂主要仪器有DNA热循环仪、ABI3100遗传分析仪、凝胶电泳图像系统。主要试剂有Taq DNA酶、dNTP(上海博亚生物工程公司产品);溴化十六烷三甲基胺(CTAB)及溴化十二烷三甲基胺(DTAB)(美国Sigma公司产品);毛细管电泳试剂(美国 ABI公司产品);FAM、VIC标记D21S1411、D21S1412、DS21S1270(上海博亚生物技术有限公司合成和纯化)。
1.2 方法
1.2.1 基因组DNA的提取外周静脉血2ml,利用CTAB、DTAB快速提取乙二胺四乙酸(EDTA)抗凝的外周血DNA,羊水DNA由改进的传统方法提取。
1.2.2 引物设计美国国立生物技术信息中心(http://www.ncbi.nlm.nih.gov/)数据库中查取,3个多态位点均为四核苷酸重复序列,在21号染色体上的位置分别是:D21S1411位于21q22.3,D21S1412位于21q22.2,D21S1270位于21q22.1,根据其基本情况设计引物,在引物的5’端标记荧光,见表1。
1.2.3 QF-PCR扩增反应总体积25μl,扩增体系包含:10 ×Gold PCR Buffer、Taq DNA polymerase(5U/μl,上海生工生物工程公司)、dNTPs(10mM)、cDNA(50~100ng)、Primer mix(FAM、VIC 标记)和超纯水。反应条件:94℃热启动5min,94℃变性30s,56℃退火1min,72℃ 延伸 1min,28 个循环,最后 72℃ 延伸10min,4℃保存。
1.2.4 PCR产物结果分析采用琼脂糖凝胶电泳分析产物纯度,通过ABI 3100遗传分析仪进行毛细管电泳,收集软件(Collection)收集电泳信息,基因扫描软件(GeneScan3.7)分析扩增片段大小和基因型分析模板(Genotyper 2.1)检测各位点的基因型。
1.2.5 细胞核型分析常规方法进行外周血淋巴细胞无菌培养,定期观察细胞生长情况和染色体制备。采用原位法进行羊水细胞培养,染色体核型制备,染色体G显带方法进行染色体核型分析。
1.3 统计学处理
采用SPSS 13.0软件进行χ2检验,结果以±s表示,进行Hardy-Weinberg平衡检验。通过Power StatsV12 Software进行统计分析,计算3个STR基因座的观察杂合度(Ho)、个体识别率(DP)、非父排除(PE)、多态信息量(PIC)。
2 结果
2.1 STR位点分析结果
106例正常无亲缘关系标本的外周血DNA,通过QF-PCR分析21号染色体上的3个STR:D21S1411、D21S1412、D21S1270 的 PIC 分 别 为0.913、0.835、0.856,确立了 QF-PCR 产前诊断唐氏综合征的方法。产物经ABI 3100遗传分析仪分析,分析所得数据结果见表2。对3个STR位点的基因型分布进行χ2检验,差异无统计学意义,说明基因型分布符合Hardy-Weinberg平衡,是一组理想的遗传标记。在美国国立生物技术信息中心(http://www.ncbi.nlm.nih.gov/)数据库中查询,可得D21S1411的染色体位置为44160692:44160948(bp),D21S1412的染色体位置为40750293(bp),D21S1270的染色体位置为31706781:31706930(bp),通过计算绘制物理比例距离见图1。

表2 106例外周血DNA的21号染色体特异STR位标的遗传分析结果
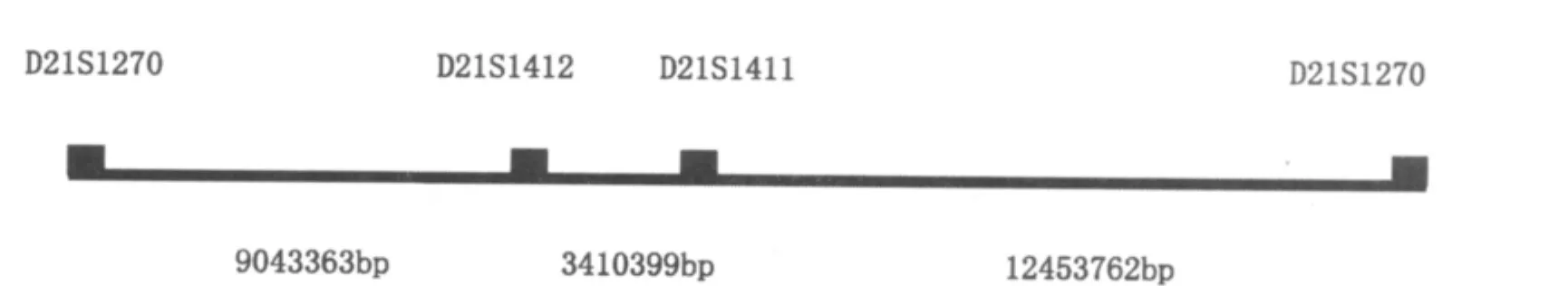
图1 21号染色体特异的STR位标染色体定位距离
2.2 核型分析结果
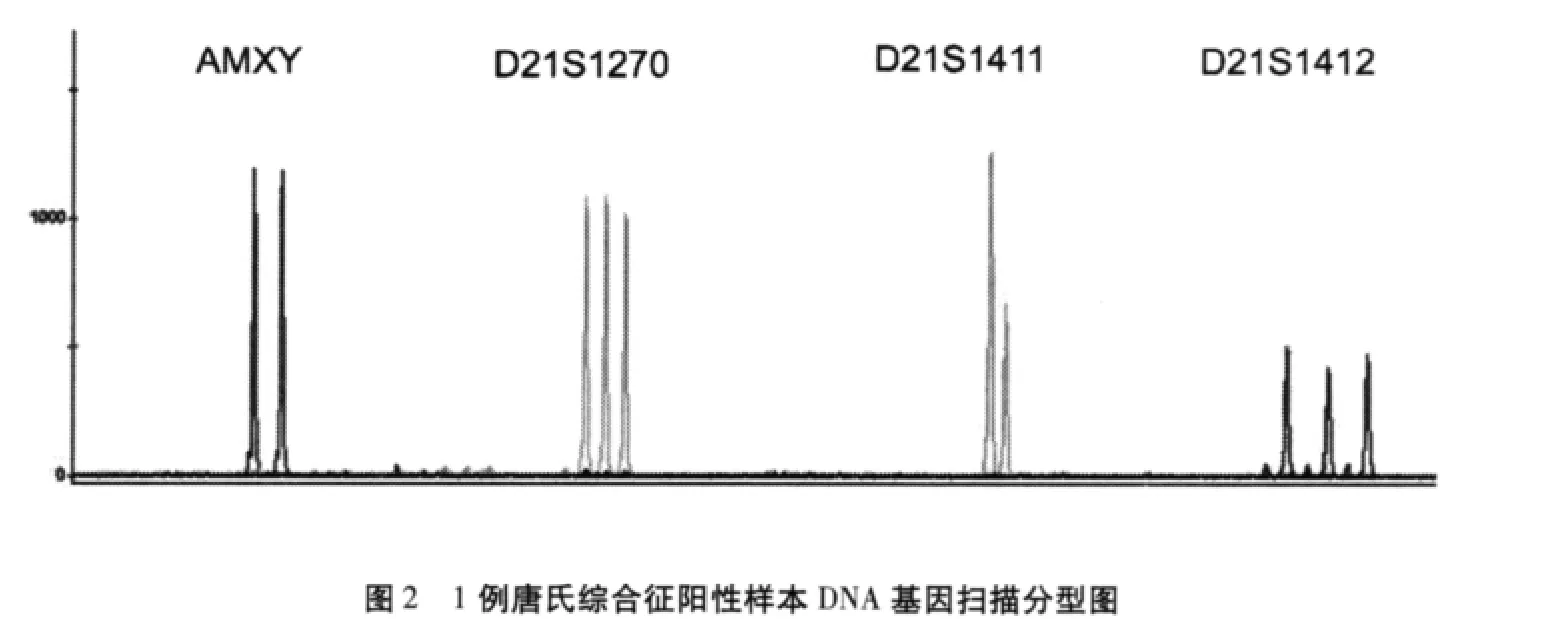
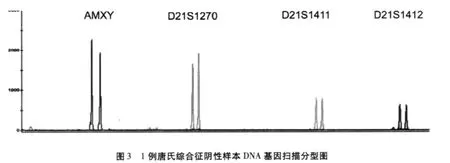
QF-PCR方法对25例唐氏综合征患儿外周血和10例正常孕妇羊水(其中2例血清筛查阳性)DNA样本的3个位标扩增分析结果见表3。对10例正常孕妇羊水中2例血清生化指标筛查阳性者通过该方法分析,检测到2例唐氏综合征患儿。所有25例标本均经核型分析确证,QF-PCR诊断结果与染色体核型分析结果一致。结果判定:21号染色体上的任意遗传位点出现3个等位基因荧光峰,峰值面积比值为1∶1∶1时,或者21号染色体上的任意遗传位点出现两个等位基因荧光峰,峰值面积比为2∶1或1∶2或出现峰值面积未达到2∶1/1∶2,但<0.65或者>1.8时,预测患有唐氏综合征。AMX与AMY面积比值接近1∶1提示该胎儿为男性。其中1例唐氏综合征男性胎儿阳性样本的基因扫描图像见图2,经染色体核型分析结果为:47,XY,+21,核型图见图4;1例阴性样本的检测结果见图3,经染色体核型分析结果为:46,XY,核型图见图5。两种方法诊断结果一致。

表3 27例唐氏综合征患儿外周血和羊水DNA STR位标扩增分析结果
3 讨论


迄今为止,医学上对唐氏综合征尚无有效的预防和治疗措施,唯一可以采取的手段就是进行产前和移植前遗传学诊断,以决定是否放弃胚胎移植或终止妊娠[2],临床主要采用常规染色体核型分析技术进行诊断,但该法所需周期长、繁琐,专业技术要求高,尤其在产前诊断中由于羊水、脐血细胞不易培养,不便于大规模的产前普查,另外长周期等待诊断结果给孕妇造成巨大的心理负担,有导致流产的可能[3]。20世纪90年代初,Mansfield等应用定量荧光PCR扩增STR进行非整倍体快速检测,现该方法在国外已得到广泛应用[4,5],被多个实验室确认为快速诊断染色体非整倍体畸变的可靠方法[6,7]。目前国内也有很多相关研究[8~11],证明了该法快速诊断染色体非整倍体的可行性。此外还有生物素标记的多重PCR、荧光原位杂交技术(FISH),及引物介导的原位标记技术(PRINS)和荧光定量等方法,而主要筛查方法有血清学三联试验(AFP、β-HCG、uE2),PAPPA、inhibin-A标记,B超检查等,以上方法各有优缺点[1]。
STR是单位长度为2~6bp的重复序列,被称为人类第二类遗传标记,其在人类基因组中分布广泛、均匀,有高度的多态性和遗传稳定性,人群中杂合度高、能提供较高信息含量,是定量检测人类染色体数目异常最有力的遗传标记,目前应用非常广泛[11,12]。相对于正常人,患者的体细胞会出现染色体数目增加或减少,因此染色体上相应的STR位点的量也会随之增加或减少,通过对这些STR位点进行扩增,用银染或者荧光标记的方法即可根据PCR产物的量推断染色体量的改变。
本研究对广东地区人群21号染色体特异的3个STR位点遗传多态性的研究结果,结合已发表的广东地区STR资料进行群体遗传学研究,发现广东人群3个STR位点基因型频率分布符合Hardy—Weinberg平衡定律。一个STR基因座的Ho应至少在0.7以上才能满足作为鉴定标志的要求。本研究选择21号染色体的三个 STR位点 D21S1411、D21S1412及D21S1270作为扩增靶点,其 Ho分别0.93、0.80、0.86。表明这3个多态位点在中国汉族人群中有较好的多态性,这对连锁分析、基因诊断和个体鉴别等都有很重要的意义。通过这3个STR位点在染色体的定位以及物理距离的计算,可知均位于唐氏综合征诊断特定关键区(21q22.1~21q22.3)内,因而该法不仅可以诊断游离型21-三体,还可用于易位型21-三体的诊断。通过QF-PCR方法结合毛细管电泳进行扩增以及遗传分析,对所选择的STR位点在不同人群中的遗传学指标的计算,结果显示这些STR位点具有高度的PIC和Ho。
本研究中采用的QF-PCR方法,在同一反应体系中同时扩增多条目的片段,一次性通过毛细管电泳激光扫描,大大地提高诊断的时效性并减少了误差。所采用QF-PCR对唐氏综合征进行产前诊断具有明显的优点:简便、快速,节省时间。其次,所需细胞数量少,敏感性高,外周血、绒毛、羊水、单细胞均可检测[13]。对25例唐氏综合征患儿外周血和2例血清筛查阳性孕妇羊水DNA进行诊断,与染色体核型分析一致,验证了该方法的可行性、准确性。QF-PCR与传统的染色体核型分析方法相比:无需细胞培养,避免了培养过程中污染事件的发生;所需样本量少;操作过程自动化,减少人为因素的干扰;检测周期短,只需1~2d就可以出结果,检测时间缩短可减少孕妇因心理压力增加导致的流产事件发生;所需费用低。并且QF-PCR在敏感性、特异性和准确性,以及可重复性等方面有独特的优势,可同时对多个样本进行分析,因此QF-PCR更适于大规模检测。
综上所述,QF-PCR具有无创伤、简单、快速、特异性高等优点,是较为理想的快速筛查唐氏综合征的产前诊断技术。该技术的应用有望提高唐氏综合征的筛查确诊率,弥补既往技术的不足,具有较好的实用价值和市场前景。但是,对于易位型和嵌合型染色体三体的诊断可能出现漏诊,并且当异常核型细胞数较少时,无法进行准确判断[14],因此还不能完全替代传统的染色体核型分析,需要进一步完善以降低漏诊率和假阴性率。相信随着技术的完善,QF-PCR能发挥其检测优势,将成为大人群筛查的优良方法,在临床产前快速诊断中发挥重大作用。
1 王希玲,蒋秀蓉,王仁礼.定量荧光PCR在唐氏综合征快速产前诊断中的应用研究[J].生殖与避孕,2003,23(4):214-219.
2 鲁芬芬.10316名孕妇产前筛查与诊断结果分析[J].浙江预防医学,2010,22(9):64-70.
3 Pertl B,Kopp S,Kroisel PM,et al.Rapid detection of chromosome aneuploidies by quantitative fluorescence PCR:first application on 247 chorionic villus samples[J].Journal of Medical Genetics,1999,(36):300-303.
4 Kriventsova NV,Shokarev RA,Avrutskaia VV,et al.Use of quantitative fluorescence polymerase chain reaction in the invasive prenatal diagnosis of Down's syndrome[J].Klin Lab Diagn,2010,(8):27-30.
5 Jain S,Agarwal S,Panigrahi I,et al.Diagnosis of Down syndrome and detection of origin of nondisjunction by short tandem repeat analysis[J].Genet Test Mol Biomarkers,2010,14(4):489-491.
6 Donaghue C,Roberts A,Mann K,et al.Development and targeted application of a rapid QF-PCR test for sex chromosome imbalance[J].Prenat Diagn,2003,23:201-210.
7 Cirigliano V,Voglino G,Cañadas MP,et al.Rapid prenatal diagnosis of common chromosome aneuploidies by QF-PCR Assessment on 18,000 consecutive clinical samples[J].Mol Hum Reprod,2004,10(11):839-846.
8 徐爱群,边旭明,刘俊涛,等.多重荧光定量PCR方法的建立及其在快速产前诊断中的应用[J].中华妇产科杂志,2010,45(7):481-487.
9 陈宝江,陈华云,陈敏铃,等.应用短串联重复序列定量荧光多重扩增技术快速检测常见染色体病[J].中华医学遗传学杂志,2008,25(4):483-485.
10 邓玉清,肖晓素,刘晓翌,等.多重定量荧光PCR快速产前诊断常见染色体非整倍体疾病[J].华中科技大学学报(医学版),2009,38(3):347-350.
11 卢彦平,程静,姜淑芳,等.多重荧光定量PCR技术快速诊断21三体及18三体方法的建立及临床应用[J].遗传,2010,32(11):1141-1146.
12 Taylor MJ,Denbow ML,Duncan KR,et al.Antenatal factors at diagnosis that predict outcome in twin-twin transfusion syndrome [J].Am J Obstet Gynecol,2000,183:1023-1028.
13 Sherlock J,Cirigliano V,Petrou M,et al.Assessment of Quantitative Fluorescent Multiplex PCR performed on single cells[J].Annals Hum Gen,1998,62(1):9-23.
14 Waters JJ,Mann K,Grimsley L,et al.Complete discrepancy between QF-PCR analysis of uncultured villi and karyotyping of cultured cells in the prenatal diagnosis of trisomy 21 in three CVS[J].Prenat Diagn,2007,27(4):332-339.
