白细胞免疫球蛋白样受体家族及其与免疫相关疾病的关系
2011-08-09赵阳孙晨鸣赵勇
赵阳,孙晨鸣,赵勇
当病原体感染时,机体天然免疫系统依赖于不同受体分子介导的免疫反应。天然免疫细胞的免疫反应程度可能是通过细胞多种激活和抑制性受体分子介导的信号通路来整合调控的。免疫球蛋白超家族在免疫反应中作为抗原受体、共刺激蛋白、黏附分子、免疫调节分子发挥重要作用。其中一组被称作白细胞免疫球蛋白样受体[leukocyte immunoglobulin(Ig)-like receptors,LILRs]或免疫球蛋白样转录物(ILTs)的分子家族既参与先天性免疫,也参与适应性免疫。该受体的研究起始于 1997 年[1],在研究细胞表面的巨细胞病毒主要组织相容性复合体(MHC)-I 类分子同源物 UL18 的受体时发现的一个新的免疫球蛋白超家族的MHC-I 类分子受体 LILR,在克隆 LILR-1 的 cDNA 时,应用白细胞免疫球蛋白样受体 1(leukocyte Ig-like receptor,LIR-1)探针在 southern 印迹上得到多条杂交带,证明 LIR多基因家族的存在。此后,人们对该家族的研究发现其成员结构的多样性,在免疫应答中既有负性调节作用,亦有正性调节作用,并与某些疾病的病程、病情有关。本文拟对该受体家族的研究进展做如下简要综述。
1 LILRs 分子的基因及命名
人 LILRs 基因定位于染色体 19q13.4 的白细胞受体复合物(leukocyte receptor cluster,LRC)区域,至少有13 个成员组成[2]。这些受体包含 2 个或4 个免疫球蛋白结构域,并且在结构上与杀伤细胞免疫球蛋白受体相关。LILR、KIR、LAIR 和FcRα 等都位于 19q13.4 的 LRC 区域内(图 1),提示它们可能存在共同的祖先基因。在小鼠中,与人类 LILRs 同源的受体为成对的免疫球蛋白样受体(paired immunoglobulin-like receptors,PIRs),PIRs 基因定位于相当于人 LRC 区域的第 7 号染色体近端着丝粒区域中,分为活化性 PIR(PIRA)和抑制性 PIR(PIRB)两类。
LILRs 又称作免疫球蛋白样转录物(ILTs)或单核细胞免疫球蛋白样受体或 CD85(a-h)[3]。并不是LILR 家族的所有成员都以 LILR 形式命名(表 1)。
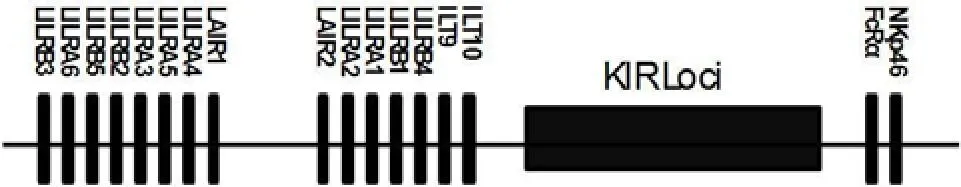
图1 白细胞受体复合物区域(LRC)定位示意图
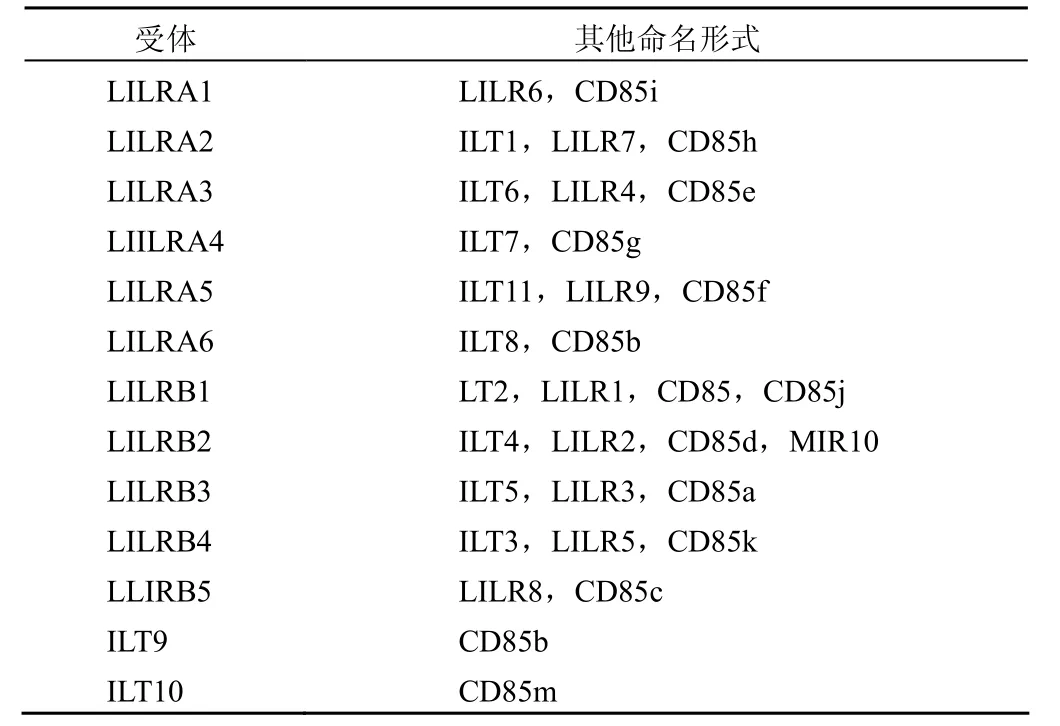
表1 LILRs 的不同命名汇总
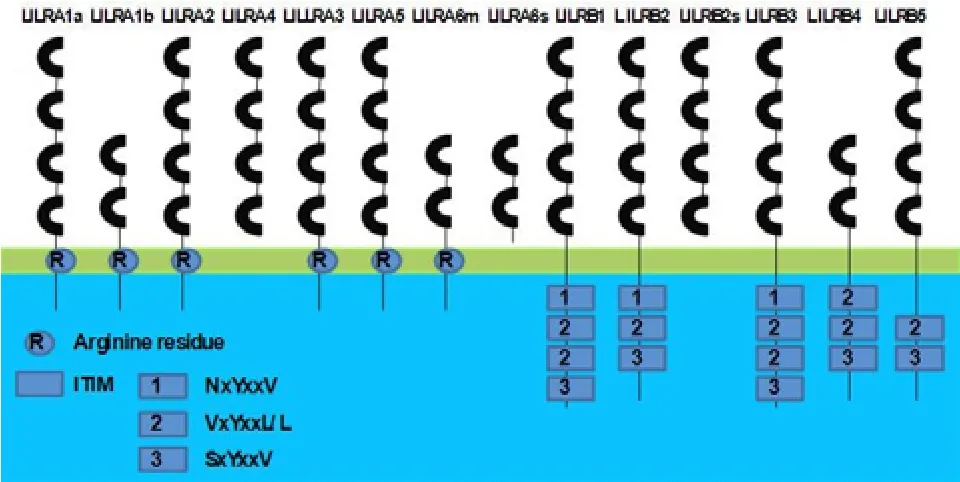
图2 LILRs 的简单结构示意图
2 LILRs 分子的结构特点、信号传导及配体
如图 2 所示,根据 LILRs 的结构特点,可将 LILRs分为三类:具有很长胞质区并带有 2、3 或 4 个免疫受体Thy 抑制性基序(ITIMs)的跨膜分子(LILRB1、LILRB2、LILRB3、LILRB4、LILRB5);带有很短胞质区和携带正电荷 Arg 残基的跨膜区(LILRA1a、LILRA1b、LILRA2、LILRA4、LILRA6);缺乏跨膜区域的可溶性分子(LILRA3和LILRA5)。LILRs 分子胞外区主要是由 2 个或 4个 C型免疫球蛋白区域组成,用来连接配体。而小鼠的 PIR-B 和PIR-A 有高度同源的胞外区域,但是他们的跨膜和胞质区域不同。PIR-A 和PIR-B 的胞外区域都有 6 个氨基酸序列相似的免疫球蛋白样结构域[4]。PIR-A 有一个包含 Arg 的极性跨膜区域,该结构对于它与 FcRγ 链的作用是必需的。包含有酪氨酸活化性基序 ITAM 的 FcRγ 对 PIR-A 的细胞表面表达和信号转导是必需的。相反,PIR-B 没有带电荷的跨膜区域,但有一个包含酪氨酸抑制性基序 ITIM 的长的胞质尾,该基序可以募集 SHP-1 酪氨酸磷酸酶来传递抑制性信号。稳定的 PIR-B 分子是由一个基因编码的,而PIR-A 有 6 个或更多的分子,每一个的胞外氨基酸序列都有少许的差异,是由多基因家族编码的[4]。PIR-B 的基因由15 个外显子和大约 8000 个碱基组成。第一个外显子由 5’非翻译区、ATG翻译起始位点和大约一半的前导肽序列组成;剩下的前导肽序列被第 2 个外显子编码;第 3~8 个外显子编码 6 个胞外免疫球蛋白结构域;第 9 个和第10 个外显子编码胞外近膜区域和跨膜区域;最后 5 个外显子(11-15)编码胞质尾和3’ 非翻译区[5]。PIR-B 的内显子和外显子界限遵循 GT-AG 原则[5]。而对于活化性受体PIR-A6 来说,它由 9 个外显子组成,大约 8.2 kb 长。第1 个外显子编码 5’ 非翻译区、翻译起始位点和大约一半的信号序列;第 2 个外显子编码剩余的信号序列;第 3~8 个外显子各自编码一个单独的胞外免疫球蛋白结构域;第9 个外显子编码跨膜区域、胞质尾以及编码带有 4 个多腺苷酸信号的 3’UTP 和6 个 mRNA 稳定序列[6]。
抑制性 LILRs(LILRB1-5)是通过作用胞浆内的 ITIMs来传递抑制信号的。当细胞受到刺激时,抑制性受体中的ITIM 基序中的 Thy 被活化受体募集来的蛋白酪氨酸激酶(Syk)磷酸化,磷酸化的酪氨酸残基为具有 SH2 结构域的酪氨酸磷酸酶 SHP1 提供了结合位点[7]。随后通过使下游酪氨酸激酶去磷酸化失活而传递抑制性信号,抑制免疫细胞活化及 Ca2+的动员等细胞内的活动。对 LILR 功能的大多数研究都集中在抑制性 LILR 施加的控制机制上,相比较而言对活化性 LILR 的研究仅限于对与嗜碱性粒细胞有关的 LILRA2 和专表达于骨髓来源的单核细胞上的LILRA5 的研究[8-9]。由于活化性的 LILR(LILRA1,-2,-3,-4,-5 和-6)缺乏自身的信号结构域,其依赖于一个相关的适应性蛋白,例如 FcεR Igγ 的胞内活化性基序ITAMs 来传递活化信号。LILRA 与 FcR 的 γ 链连接配对可以形成一个活化受体复合物。细胞表面成簇的活化性受体可以快速地引起 ITAM 基序的 Thy 残基磷酸化。随后带有SH2 结构域的蛋白酪氨酸激酶可以结合磷酸化的酪氨酸残基,从而引起下游信号及基因调控。
LILRs 除能与经典的人类白细胞抗原(HLA)-I 类抗原 HLA-A,-B 结合外,还可与非经典的 HLA-I 类抗原HLA-C,-E,-F 及病毒 UL18 蛋白结合[10]。随后用免疫沉淀证明 UL18 的配体是LILRB1。LILRB1 和LILRB2 可与经典的 MHC-I 类分子相连,研究表明 LILRB1 和LILRB2 亦可与非经典的 HLA-F 和HLA-G 相连,并且在LILRB1 和LILRB2 与 HLA-G 的亲和性上有一个相反的结果[11]。但大多数 LILR 家族成员的配体仍未知。
3 LILRs 在免疫细胞上的分布特点及功能
LILRs 分布十分广泛,主要表达于髓样单核细胞和一些淋巴细胞表面,在多形核白细胞、NK 细胞、树突状细胞(DC)等细胞表面也有表达,不同细胞表面表达不同类型的 LILR 分子(表 2)[10]。小鼠的 PIR 受体主要分布在髓系细胞如巨噬细胞、DC 和中性粒细胞等以及 B 细胞表面,但胸腺细胞、成熟的 T 细胞和NK 细胞均不表达 PIR 受体[12]。实验证明,在小鼠中,相比较活化性受体 PIR-A 而言,细胞表面更倾向于表达 PIR-B[13]。下面将对不同类型细胞上 LILR 的表达做一阐述。
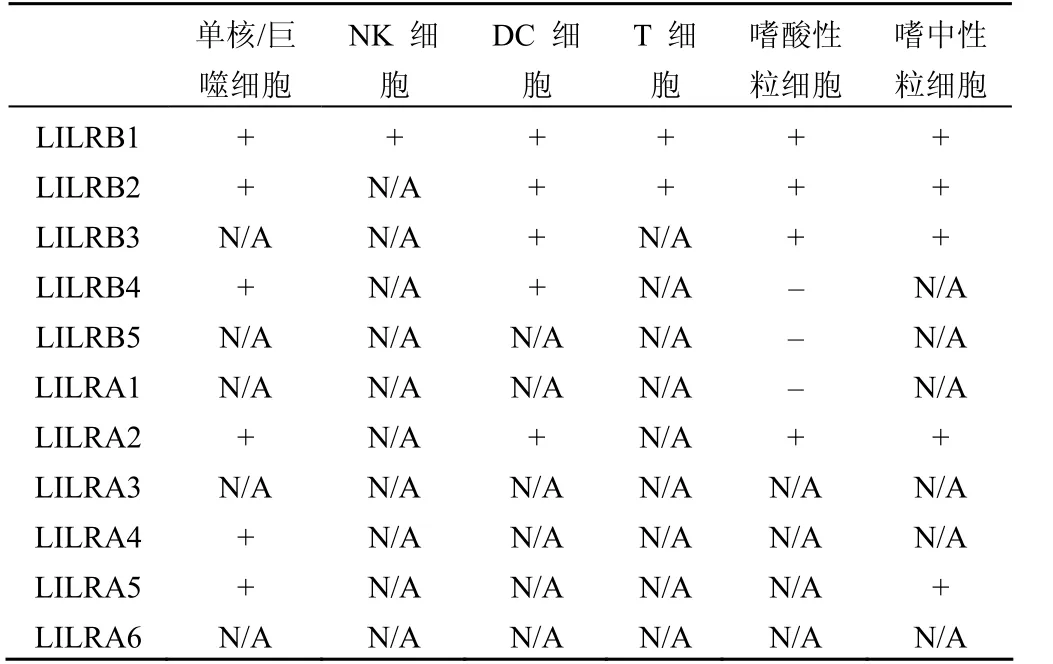
表2 LILRs 受体在各种免疫细胞上的表达情况
3.1 多形核白细胞
粒细胞或多形核白细胞包括嗜中性粒细胞(neutrophils)、嗜酸性粒细胞(eosinophils)和嗜碱性粒细胞(basophils),主要功能是通过分泌颗粒对早期的免疫反应做出快速的应答。人嗜酸性粒细胞和嗜中性粒细胞表面都有 LILR的限制性表达形式 LILRB3 和LILRA2,偶尔也会出现 LILRB1和(或)LILRB2,但无 LILRA1、LILRB4、LILRB5 的表达[8]。嗜酸性粒细胞也许是通过 LILRA2 介导的嗜酸性粒细胞派生的神经毒素(eosinophil-derived neurotoxin,EDN)的释放,白三烯 C4(leukotriene,LTC4)的外周合成以及以囊泡运输形式进行的 IL-12 的分泌等方式活化的[8]。交联活化性受体 LILRA2 可以引起嗜酸性粒细胞脱颗粒,并伴有 IL-12 的分泌[9]。而嗜中性粒细胞高度表达 LILRA5(LIR9/ILT11)转录物,可以导致一些能够引起炎症反应的细胞因子的释放[9]。PIR 的活化亚型和抑制亚型均表达于鼠的肥大细胞表面。在细胞未活化状态,PIR-B亚型占优势并形成结构磷酸化,并且这种抑制性受体与 Fcε受体的连接抑制肥大细胞的活化。有研究显示,在人的肥大细胞前体表面表达抑制性的 LILRB1、LILRB2、LILRB3、LILRB4 和活化性的 LILRA1,然而尽管在成熟脐带血中分离的肥大细胞中检测到 mRNA 编码多种 LILRs,但并未检测出 LILR 家族成员在细胞表面上的表达情况[3],并且用不同的细胞因子联合刺激肥大细胞前体或脐带血中分离的肥大细胞都不能诱导 LILR 的表达。有趣的是,脐带血中分离的肥大细胞在胞质颗粒和交联高亲和力 IgE 受体的细胞上表达 LILRB5,并在培养基中释放可溶性 LILRB5[3]。亦有研究报道,在小鼠中,有效地交联 PIR-B 和FcRI 受体可以抑制 IgE 介导的肥大细胞活化和血清素的释放。PIR-B和肝细胞生长因子(stem cell growth factor,SCF)受体的连接会抑制 SCF 介导的肥大细胞的反应[14],这提示我们PIR-B 控制肥大细胞的活动。
3.2 单核/巨噬细胞
单核细胞由骨髓粒-单系祖细胞分化发育而成,单核细胞进入结缔组织,可分化为巨噬细胞。其吞噬和清除病原微生物的能力很强,在机体的免疫防御中发挥重要作用。在IFN 等作用下,其发挥专职性 APC 的功能。通过HLA-DR、FcγRI 和FcεRI 活化单核细胞表面 LILRB1、LILRB2 和LILRB4 抑制该细胞功能[15]。最近有报道称,单核细胞表面模式识别受体 Toll 样受体(TLR)活化后,单核细胞下调 LILRA2、LILRA4、LILRB1 和LILRB4,提示 LILR 也许影响天然免疫反应[16]。在功能学的研究中发现,LILRA2 可以通过将单核细胞的产物从 IL-12 转变成 IL-10 和通过阻滞由 Toll 样受体介导的抗菌作用来抑制天然宿主防御机制[17]。交联单核细胞表面的 LILRA5 引起 Ca2+动员,而 Ca2+动员作为一种已知信号介质在细胞活化时被释放[9],因此 LILRA5 引起单核细胞的活化及IL-1β、TNF-α、IL-6 分泌,提示 LILRA5 在炎症反应阶段调节单核细胞功能方面有重要作用[9]。还有研究显示,从妊娠早期子宫蜕膜中分离的巨噬细胞表面高度表达 LILRB1和LILRB2,这些抑制性受体传递的抑制性信号可能抑制巨噬细胞活化,从而避免母体对胚胎的排斥和攻击[18]。
3.3 NK 细胞
自然杀伤细胞(natural killer,NK)来源于骨髓淋巴样干细胞,主要分布于外周血和脾脏。NK 细胞表面受其表面多种调节性受体的调控。抑制性受体识别自身组织细胞表面的 HLA-I 类分子后,可启动抑制性信号转导,而使活化性受体的功能受到抑制,表现为 NK 细胞不能杀伤自身正常组织细胞。抑制性 LILRB1 可以抑制 NK 的杀伤作用,并且增强 NK细胞表面的杀伤免疫球蛋白受体(killer Ig receptor,KIR)的抑制效应[19]。除此之外,LILRB1 可以在初识别过程中抑制 NK 细胞对靶细胞的黏附,从而影响NK 对靶细胞的杀伤[20]。
3.4 树突状细胞
DC 广泛分布于全身组织和脏器。近年发现,成熟的DC 可分为两个亚群:髓样树突状细胞(myeloid dendritic,mDC)和浆细胞样树突状细胞(plasmacytoid dendritic cell,pDC)。有研究报道,根据 LILR 表达情况,可将 DC 分为LILRB4+/LILRB2+ 和LILRB4+/LILRB2– 两个亚群,前者代表了髓系 DC(mDC)亚群;后者显示的细胞特征与淋巴系(pDC)亚群相似[21]。正常情况下绝大多数 DC 处于非成熟状态,具有很强的抗原摄取和加工处理的能力。成熟状态的 DC 具有很强的抗原提呈能力。有研究报道,小鼠缺乏 PIR-B 导致 DC 发育缺陷[22]。LILR 家族成员也可以影响 DC 的抗原提呈功能。在抗原提呈过程中,DC 除需要为 T 细胞提供抗原肽-MHC 分子复合物这一抗原信号(第一信号)外,还通过高表达 CD80、CD86 等共刺激分子,为 T 细胞活化提供第二信号。效应性 T 细胞的增殖与分化需要专职性 APC 表面的 B7 分子传递的共刺激信号,如果没有受体分子的共刺激作用,将会导致 T 细胞无反应。抑制性的 LILR 参与 T 细胞的无反应,高表达 LILRB2或 LILRB4 抑制 DC 的 CD80、CD86 等共刺激分子的表达,从而影响 CD4+T 细胞的繁殖。IL-10 可能参与了 T 细胞的无反应应答,并且导致单核细胞和由 LPS 刺激成熟的DC 细胞表面的 LILRB2 的上调[23]。DC 可使未致敏的 T细胞增殖分化成效应性 T 细胞,然而也可以抑制 T细胞的活化,在中枢和外周免疫耐受中发挥重要作用。体外实验证明,IL-10 具有明显上调抑制性受体 LILRB2 在人成熟的DC 表达的能力[24]。这些结果提示,LILRB2 可能与 IL-10有关,可以调节 APCs 的共刺激分子表达及控制 T 细胞增殖。还有研究显示,HIV-1 感染控制者可以控制 HIV-1 病毒血症到不可检测的水平,而在其体内循环 mDC 具有独特的抗原呈递相关蛋白和细胞因子等。mDC 这种特殊的功能与 LILRB1 和LILRB3 的独特表型上调有关[25]。LILRA2 活化的单核细胞分泌 TNF-α、IL-6、IL-8、IL-12 和IL-10 增加,而对 TGF-β 几乎无影响。通过改变 GM-CSF,LILRA2 的活化引起单核细胞向成熟 DC 的分化[26]。在小鼠中 PIR-B 缺陷型的 DCs 诱导 CTLs 更有效率,引起移植和肿瘤排斥加速。在体外研究中,PIR-B 阳性的 DC比PIR-B 阴性的细胞作为 APC 的效率低[27]。人类的 HLA-G在妊娠期间调节免疫反应具有重要作用,并且其中一种调节机制可能与 ILT 家族有关。有研究报道,HLA-G 通过与PIR-B(与人类的 LILRB2 同源)的相互作用来调节小鼠DC 功能。这种抑制性受体的触发会导致同种移植物存活的延长[28]。
3.5 B、T 细胞
B 细胞表面抑制性受体可能控制细胞的增殖[29]。敲除抑制性受体 PIR-B 基因的小鼠表现为组成性 B 细胞的活化[30],提示 PIR-B 对小鼠 B 细胞具有重要负调控作用。
LILRB1 是LILR 家族唯一一个表达于 T 细胞表面的成员,并且存在于所有 T 细胞的胞质和细胞表面[31]。LILRB1通过使 TCRζITAM 去磷酸化来抑制通过 TCR 的信号,降低 ZAP70 和与 T 细胞活化相关的连接体的活力[32]。交联 T 细胞表面的 LILRB1 会降低 T 细胞的增殖,并伴随 IL-2 和TNF-γ 产生降低,但IL-10 和TGF-β产量增加[33]。除此之外,LILR 可以通过影响其他类型的细胞来间接影响 T 细胞。例如,单核细胞表面 LILRB2 的触发可以影响细胞因子的分泌,从而上调 IL-10/IL-2 的比例,从而促进 Th2 介导的体液免疫反应[17]。PIR-B 作为一种MHC-I 类分子的受体表达于抗原提呈细胞上,通过阻滞CD8 分子与 MHC-I 类分子的结合来调节 CTL 激活[27]。
4 LILRs 的疾病相关性
LILRs 在免疫细胞反应方面的重要调控作用提示LILRs 可能与某些疾病的发病机制相关,为治疗及预防某些疾病提供了新的研究线索。
4.1 LILRs 与自身免疫性疾病
风湿性关节炎(rheumatoid arthritis,RA)是由于炎症细胞的大量活化而引起的一种异质性慢性炎症性关节疾病。占主导的炎症细胞是巨噬细胞和成纤维样细胞,滑膜组织中的巨噬细胞主要分泌 IL-1β 和TNF-α,这些都是造成 RA的关键因子。单核细胞表面 ILT11 的活化会造成 Ga2+的动员及 IL-1β 和TNF-α的分泌,这提示 ILT11 的信号通路可能与 RA 的病理机制有关[33]。有研究报道,活化性LILRA2、LILRA5 及抑制性 LILRB2、LILRB3 在多于 75%的 RA患者的滑膜组织中大量表达,而在骨性关节炎(osteoarthritis,OA)中只有微量的表达,在正常个体组织中无表达。LILRA2 和LILRA5 主要在滑膜组织中的巨噬细胞和内皮细胞中表达,而 LILRB2 和LILRB3 主要在巨噬细胞和淋巴细胞上表达[34]。表达活化性 LILRs 的巨噬细胞和表达抑制性 LILRs 的巨噬细胞和淋巴细胞的增加提示,这些细胞间的相互作用也许调节了细胞的活化及疾病严重性的水平,并且表达的差异与疾病的异质性有关[35]。研究发现,这些受体在患 RA 病初期表达量高,随着患病时间变长,组织纤维化程度增高,LILRs 的受体表达量降低。实验证明,LILRA2、LILRA5、LILRB3 与疾病的活动有关,并且不依赖于患者的年龄及患病时间[34]。与配体选择性配对表达、活化性 LILR 与抑制性 LILR 间的平衡将影响疾病的严重性和进程,决定疾病的临床行为[34]。一种与关节炎疾病相关的疾病——脊椎性关节炎被证明与 HLA-B27相关,而膜表面HLA-B27 分子及其游离重链形式均可作为LILRB1、LILRB2 和LILRA4 的配体[33]。尽管 LILRs 受体参与 RA 的发病,但调控 LILRs 表达的因子及分子机制还不太清楚。
有研究证明,LILRA2 与系统性红斑狼疮(systemic lupus erythematosus,SLE)及显微镜下多血管炎(microscopic polyangiitis,MPA)有关[36]。多态性筛选检测出 LILRA2 SNP可以扰乱内含子 6 的剪接受体位点。并且在一些病例中发现 A/A 基因型的升高,可引起隐藏剪接受体位点的活化,产生一个在连接区缺乏三个氨基酸的新 LILRA2 亚型——Delta 419-421。这个新的 LILRA2 的 Delta 419-421亚型表达在单核细胞表面,可能在 SLE 和MPA 中有重要作用。有研究发现,在 B 细胞或 B-1 细胞中 PIR-B 受体通过抑制布鲁顿酪氨酸位点(Btk)来抑制 TLR-9 介导的自体反应性抗体的产生。因此,PIR-B 是B-1 细胞中TLR-9 介导的先天免疫的重要调节子,过度的活化会引起自身免疫病[13]。PIR-B 缺陷型小鼠比野生小鼠更易感染沙门杆菌[37]。
4.2 LILRs 与妊娠免疫调控
妊娠过程相当于一次半同种异体移植,而胎儿在子宫内免受母体的排斥,即母胎免疫耐受。一旦母胎间的相互作用失去平衡,就会造成病理性妊娠,如反复自然流产等。这些病理性妊娠都是由一些效应细胞活性增强及其分泌细胞因子紊乱造成的。这些病理性妊娠疾病的发生可能与胎盘滋养层上 LIRB1 的表达下降和缺失有关。HLA-G 被推测在母胎免疫耐受中发挥重要作用。其局限性表达于母胎界面的绒毛外滋养细胞(EVT),像经典 HLA-I 类分子一样,可与NK 细胞表面的抑制受体结合,导致 NK 细胞活性抑制。目前已知的妊娠免疫耐受机制主要表现为滋养细胞膜抗原——HLA-G 表达上调,CD56+CD16–NK 细胞亚群占优势,Th1/Th2 平衡动态变化,Th2 细胞因子升高等。NK 细胞上的抑制性受体 LILRB1 与 EVT 上的 HLA-G 特异性结合传递抑制信号,抑制细胞杀伤作用。LILRB1 使 Th1 细胞因子分泌下降,而 Th2 型细胞因子分泌增加,使妊娠期间细胞因子向“Th2 偏离”[38]。妊娠早期子宫内膜中高表达 LILRB1,抑制效应细胞对胚胎的排斥[18]。LILRB1 降低APC 特别是DC 的抗原提呈作用,传导负性信号抑制效应细胞对胎物的反应[39]。因此,LILRB1 在妊娠中发挥重要作用,其表达降低或缺失将会引起流产的发生。进一步研究LILRB1 在妊娠免疫中的作用及其作用机制,不仅可以丰富母胎耐受的理论,加深对其的认识,也为探索妊娠免疫疾病的发病机制提供新的线索,为疾病防治提供依据。
4.3 LILRs 与肿瘤发生
HLA-G 主要表达在滋养层细胞中,但在某些部位也会出现异位表达,如在肿瘤细胞中。这种表达可作为一种潜在的免疫逃离机制,并已在黑色素瘤、肺癌、肾癌和乳腺癌中发现[33]。研究发现,在升高的 HLA-G 表达与损害的炎症程度间有明显的关联。在乳腺癌 CD8+ 和CD56+ 淋巴瘤中已检测出有作为 HLA-G 受体的 LILRB1 表达[40]。LILRB1 通常表达于 CD8+ 细胞毒性 T 细胞和CD56+NK细胞表面,所以现在还未知 LILRB1 的表达是否对肿瘤的形成及逃离细胞裂解有作用。而单核细胞和NK 细胞上HLA-G 和LILRB1 间的相互作用很可能导致细胞杀伤作用降低。
5 LILRs 与抗类风湿性药物
有研究报道,用缓解病情的抗类风湿药物治疗的风湿性关节炎患者的滑膜组织与未用药物的患者的滑膜组织中的 LILRs 表达量具有差异[34]。其中,用甲氨蝶呤治疗的患者与未用此药治疗的患者相比,活化性受体 LILRA2 和LILRA5 的表达量升高,但抑制性受体 LILRB2 和LILRB3的表达量无显著差异。用甾体类抗炎药(例如泼尼松)治疗的患者与未用该类药物治疗的患者的滑膜组织中,抑制性受体 LILRB2 阳性的细胞数量显著增加,并且也观察到活化性受体 LILRA2 和LILRA5 升高,但LILRB3 无变化。因此,推测 LILRs 表达量的改变与药物的抗炎功能有关,其可能对药物缓解疾病的能力及预后有重要影响。
6 结语
激活性和抑制性 LILR 家族受体在维持机体免疫应答的平衡中发挥重要调节作用。其基本功能已得到部分的证实,但大部分成员的配体还未可知,需进一步研究。虽然已检测出该家族在某些疾病中有表达,但其在疾病中确切的机理及病理机制还未清楚。因此在 LILRs 的基础生物学及临床疾病发生中的作用机制等方面仍有大量工作尚待开展。深入研究 LILR 在母胎免疫耐受、风湿性关节炎及肿瘤疾病中的作用,诠释其作用机制,不仅可进一步丰富母胎免疫耐受、自身免疫疾病调控及肿瘤发生理论,加深对其发生过程的认识,也将为这些疾病的防治及药物的研发提供新思路。
[1]Borges L, Hsu ML, Fanger N, et al.A family of human lymphoid and myeloid Ig-like receptors, some of which bind to MHC class I molecules.J Immunol, 1997, 159(11):5192-5196.
[2]Thomas R, Matthias T, Witte T.Leukocyte immunoglobulin-like receptors as new players in autoimmunity.Clin Rev Allergy Immunol,2010, 38(2-3):159-162.
[3]Tedla N, Lee CW, Borges L, et al.Differential expression of leukocyte immunoglobulin-like receptors on cord-blood-derived human mast cell progenitors and mature mast cells.J Leukoc Biol, 2008,83(2):334-343.
[4]Kubagawa H, Chen CC, Ho LH, et al.Biochemical nature and cellular distribution of the paired immunoglobulin-like receptors, PIR-A and PIR-B.J Exp Med, 1999, 189(2):309-318.
[5]Alley TL, Cooper MD, Chen M, et al.Genomic structure of PIR-B,the inhibitory member of the paired immunoglobulin-like receptor genes in mice.Tissue Antigens, 1998, 51(3):224-231.
[6]Tun T, Kubagawa Y, Dennis G, et al.Genomic structure of mouse PIR-A6, an activating member of the paired immunoglobulin-like receptor gene family.Tissue Antigens, 2003, 61(3):220-230.
[7]Burshtyn DN, Yang W, Yi T, et al.A novel phosphotyrosine motif with a critical amino acid at position -2 for the SH2 domain-mediated activation of the tyrosine phosphatase SHP-1.J Biol Chem, 1997,272(20):13066-13072.
[8]Tedla N, Bandeira-Melo C, Tassinari P, et al.Activation of human eosinophils through leukocyte immunoglobulin-like receptor 7.Proc Natl Acad Sci U S A, 2003, 100(3):1174-1179.
[9]Borges L, Kubin M, Kuhlman T.LIR9, an immunoglobulinsuperfamily-activating receptor, is expressed as a transmembrane and as a secreted molecule.Blood, 2003, 101(4):1484-1486.
[10]Hoelsbrekken SE, Fossum S, Dissen E.Molecular cloning of LILRC1 and LILRC2 in the mouse and the rat, two novel immunoglobulin-like receptors encoded by the leukocyte receptor gene complex.Immunogenetics, 2005, 57(7):479-486.
[11]Chapman TL, Heikeman AP, Bjorkman PJ.The inhibitory receptor LIR-1 uses a common binding interaction to recognize class I MHC molecules and the viral homolog UL18.Immunity, 1999, 11(5):603-613.
[12]Mori Y, Tsuji S, Inui M, et al.Inhibitory immunoglobulin-like receptors LILRB and PIR-B negatively regulate osteoclast development.J Immunol, 2008, 181(7):4742-4751.
[13]Takai T, Nakamura A, Endo S.Role of PIR-B in autoimmune glomerulonephritis.J Biomed Biotechnol, 2011, 2011:275302.
[14]Chen CC, Kong DW, Cooper MD, et al.Mast cell regulation via paired immunoglobulin-like receptor PIR-B.Immunol Res, 2002,26(1-3):191-197.
[15]Cella M, Döhring C, Samaridis J, et al.A novel inhibitory receptor(ILT3) expressed on monocytes, macrophages, and dendritic cells involved in antigen processing.J Exp Med, 1997, 185(10):1743-1751.
[16]Ju XS, Hacker C, Scherer B, et al.Immunoglobulin-like transcripts ILT2, ILT3 and ILT7 are expressed by human dendritic cells and down-regulated following activation.Gene, 2004, 331:159-164.
[17]Bleharski JR, Li H, Meinken C, et al.Use of genetic profiling in leprosy to discriminate clinical forms of the disease.Science, 2003,301:1527-1530.
[18]Petroff MG, Sedlmayr P, Azzola D, et al.Decidual macrophages are potentially susceptible to inhibition by class Ia and class Ib HLA molecules.J Reprod Immunol, 2002, 56(1-2):3-17.
[19]Navarro F, Llano M, Bellón T, et al.The ILT2(LIR1) and CD94/NKG2A NK cell receptors respectively recognize HLA-G1 and HLA-E molecules co-expressed on target cells.Eur J Immunol, 1999,29(1):277-283.
[20]Forte P, Pazmany L, Matter-Reissmann UB, et al.HLA-G inhibits rolling adhesion of activated human NK cells on porcine endothelial cells.J Immunol, 2001, 167(10):6002-6008.
[21]Cella M, Jarrossay D, Facchetti F, et al.Plasmacytoid monocytes migrate to inflamed lymph nodes and produce large amounts of type I interferon.Nat Med, 1999, 5(8):919-923.
[22]Penna G, Vulcano M, Sozzani S, et al.Differential migration behavior and chemokine production by myeloid and plasmacytoid dendritic cells.Hum Immunol, 2002, 63(12):1164-1171.
[23]Vlad G, Piazza F, Colovai A, et al.Interleukin-10 induces the upregulation of the inhibitory receptor ILT4 in monocytes from HIV positive individuals.Hum Immunol, 2003, 64(5):483-489.
[24]Beinhauer BG, McBride JM, Graf P, et al.Interleukin 10 regulates cell surface and soluble LIR-2 (CD85d) expression on dendritic cells resulting in T cell hyporesponsiveness in vitro.Eur J Immunol, 2004,34(1):74-80.
[25]Huang J, Burke PS, Cung TD, et al.Leukocyte immunoglobulin-like receptors maintain unique antigen-presenting properties of circulating myeloid dendritic cells in HIV-1-infected elite controllers.J Virol,2010, 84(18):9463-9471.
[26]Lee DJ, Sieling PA, Ochoa MT, et al.LILRA2 activation inhibits dendritic cell differentiation and antigen presentation to T cells.J Immunol, 2007, 179(12):8128-8136.
[27]Endo S, Sakamoto Y, Kobayashi E, et al.Regulation of cytotoxic T lymphocyte triggering by PIR-B on dendritic cells.Proc Natl Acad Sci U S A, 2008, 105(38):14515-14520.
[28]Liang S, Baibakov B, Horuzsko A.HLA-G inhibits the functions of murine dendritic cells via the PIR-B immune inhibitory receptor.Eur J Immunol, 2002, 32(9):2418-2426.
[29]Maeda A, Scharenberg AM, Tsukada S, et al.Paired immunoglobulin-like receptor B (PIR-B) inhibits BCR-induced activation of Syk and Btk by SHP-1.Oncogene, 1999, 18(14):2291-2297.
[30]Ujike A, Takeda K, Nakamura A, et al.Impaired dendritic cell maturation and increased T(H)2 responses in PIR-B(-/-) mice.Nat Immunol, 2002, 3(6):542-548.
[31]Saverino D, Fabbi M, Ghiotto F, et al.The CD85/LIR-1/ILT2 inhibitory receptor is expressed by all human T lymphocytes and down-regulates their functions.J Immunol, 2000, 165(7):3742-3755.
[32]Dietrich J, Cella M, Colonna M.Ig-like transcript 2 (ILT2)/leukocyte Ig-like receptor 1 (LIR1) inhibits TCR signaling and actin cytoskeleton reorganization.J Immunol, 2001, 166(4):2514-2521.
[33]Brown D, Trowsdale J, Allen R.The LILR family: modulators of innate and adaptive immune pathways in health and disease.Tissue Antigens, 2004, 64(3):215-225.
[34]Tedla N, An H, Borges L, et al.Expression of activating and inhibitory leukocyte immunoglobulin-like receptors in rheumatoid synovium:correlations to disease activity.Tissue Antigens, 2011, 77(4):305-316.[35]Tedla N, Gibson K, McNeil HP, et al.The co-expression of activatingand inhibitory leukocyte immunoglobulin-like receptors in rheumatoid synovium.Am J Pathol, 2002, 160(2):425-431.
[36]Mamegano K, Kuroki K, Miyashita R, et al.Association of LILRA2(ILT1, LIR7) splice site polymorphism with systemic lupus erythematosus and microscopic polyangiitis.Genes Immun, 2008,9(3):214-223.
[37]Torii I, Oka S, Hotomi M, et al.PIR-B-deficient mice are susceptible to Salmonella infection.J Immunol, 2008, 181(6):4229-4239.
[38]Clements CS, Kjer-Nielsen L, Kostenko L, et al.Crystal structure of HLA-G: a nonclassical MHC class I molecule expressed at the fetal-maternal interface.Proc Natl Acad Sci U S A, 2005, 102(9):3360-3365.
[39]Tenca C, Merlo A, Merck E, et al.CD85j (leukocyte Ig-like receptor-1/Ig-like transcript 2) inhibits human osteoclast-associated receptor-mediated activation of human dendritic cells.J Immunol,2005, 174(11):6757-6763.
[40]Lefebvre S, Antoine M, Uzan S, et al.Specific activation of the non-classical class I histocompatibility HLA-G antigen and expression of the ILT2 inhibitory receptor in human breast cancer.J Pathol, 2002,196(3):266-274.
