Exenatide对软脂酸诱导RINm5f细胞凋亡的保护作用
2011-08-02安丽萍刘晓梅王春梅詹巾卓杜培革孙志伟
安丽萍 刘晓梅 王春梅 詹巾卓 孙 汇 李 娜 王 拓 杜培革 孙志伟
(吉林大学公共卫生学院,吉林 长春 130021)
胰岛β细胞的凋亡与糖尿病发病机制有密切关系。在2型糖尿病(T2DM)自然病程中,不管采用目前的何种治疗方案,β细胞功能都呈进行性受损〔1〕。保护β细胞、缓解β细胞功能减退是T2DM治疗的关键。胰高血糖素样肽-1(GLP-1)是T2DM的作用靶点。天然GLP-1很不稳定,可迅速被二肽基肽酶Ⅳ(DPPⅣ)剪切掉N末端氨基酸而降解,半衰期很短,仅1~2 min,这限制了其临床应用。艾塞那肽(Exenatide)是GLP-1的类似物,与GLP-1有53%同源性,但不易被DPPⅣ降解,可延长作用时间以适应治疗的需要。研究证明:Exenatide不但能明显改善T2DM动物模型血糖的控制情况,还可刺激胰岛β细胞数增加量〔2〕。但其具体的机制尚不清楚。本研究从凋亡的角度,利用体外培养的胰岛细胞RINm5f,探讨Exenatide对于游离脂肪酸诱导的胰岛β细胞凋亡是否具有抑制作用及其机制。
1 材料与方法
1.1 材料 大鼠胰岛细胞株RINm5f购自于中国科学院上海细胞所。Exenatide购于吉林大学第一临床医院。软脂酸、MTT为Sigma公司产品。凋亡试剂盒为BD公司产品。
1.2 方法
1.2.1 细胞培养 RINm5f细胞用含10%胎牛血清的RPMI-1640培养液在37℃、5%CO2孵育箱内培养,以0.25%胰酶消化传代,每2天换液一次。
1.2.2 软脂酸损伤大鼠胰岛细胞株RINm5f模型的建立 取对数生长期细胞,调整细胞数为5×104/ml,每孔200 μl接种于96孔培养板,每组设6个平行孔。将软脂酸储存液用1640培养基稀释成250、500 μmol/L 浓度,培养细胞 24 ~48 h,MTT 检测细胞存活率,建立软脂酸损伤RINm5f模型。为除外不含游离脂肪酸的牛血清白蛋白对细胞生长的影响,各组细胞培养液中牛血清白蛋白的最终浓度均为0.45%。
1.2.3 MTT法检测细胞增殖率 将细胞悬液按每孔1×104个细胞接种于96孔细胞培养板,在37℃、5%CO2的二氧化碳培养箱中培养数小时使细胞贴壁。换含不同浓度软脂酸培养基或含不同浓度软脂酸+Exenatide培养基(软脂酸及Exenatide储存液分别用培养基稀释至所需浓度)。根据实验目的进行分组。每组设6个平行孔,每孔加培养液200 μl,置于CO2培养箱中,37℃继续培养24~48 h。每孔加入 MTT溶液20 μl,37℃继续孵育4 h,小心吸出上清液,每孔加入150 μl DMSO,振荡10 min,使蓝色结晶物充分融解。选择490 nm波长,在酶标仪上测定吸光值(OD),取其平均值,计算细胞存活率。每项实验至少重复3次。
1.2.4 AO/EB双染检测细胞凋亡 取对数生长期细胞,用0.25%胰酶消化,制成单个细胞悬液,计数,调细胞浓度为6×104/ml,每孔1 ml接种于24孔培养板,待细胞完全贴壁后,弃去培养液,换成含不同浓度Exenatide与250 μmol/L软脂酸的培养液,使Exenatide的终浓度分别为0.1、1、10 nmol/L,每个浓度组3个平行样,分别培养24 h后,收集细胞,0.01 mol/L PBS洗细胞,1 500 r/min离心 10 min,弃上清,100 μl PBS悬浮细胞,加4 μl AO/EB混合染液(1%AO,以生理盐水配制;5 mg/ml EB,以蒸馏水配制。用时 AO∶EB∶PBS=1∶2∶97),轻轻混匀,染色1 min后,取细胞悬液10 μl滴在洁净的玻片上,盖玻片封固后于激光共聚焦显微镜下观察。
1.2.5 流式细胞术检测细胞凋亡 采用FITC-AnnexinV/PI双荧光标记,流式细胞术(FCM)检测细胞凋亡的变化。取对数生长期细胞,用0.25%胰酶消化,制成单个细胞悬液,计数,调细胞浓度为1.5×105/ml,每孔3.0×105接种6孔板中,细胞贴壁后换成含不同浓度 Exenatide(0.1、1、10 nmol/L)与 250 μmol/L软脂酸的培养液,每个浓度3个平行样,37℃,5%CO2培养箱内培养24 h,收集细胞,用 PBS洗2次,调细胞浓度为1×105/ml,取 1 ml,离心弃上清,加入 Binding Buffer 195 μl、FITC标记的Annexin V抗体5 μl,常温避光放置20 min,PBS洗2次,加入 Binding Buffer 190 μl、PI 10 μl,4℃、15 min 避光保存,用流式细胞仪收集1×104个细胞,Cellquest软件分析结果,结果以凋亡细胞的百分率表示。
2 结果
2.1 Exenatide对大鼠胰岛细胞株RINm5f细胞存活率影响采用MTT法检测Exenatide处理24、48 h对 RINm5f存活率的影响。结果如图1所示,24 h对照组吸光度值为0.895±0.03,而 Exenatide组(Exenatide浓度分别为 0.1、1、10 nmol/L)吸光度值分别为0.89±0.05,0.90±1.1,0.97±0.06。48 h对照组吸光度值为1.11±0.08,而各浓度Exenatide组分别为0.97±0.07,1.1±0.02,1.38 ±0.08。可见,Exenatide对大鼠胰岛细胞株RINm5f的促增殖作用呈时间和剂量依赖性。
2.2 Exenatide对软脂酸培养的RINm5f存活率的影响 采用0.25 mmol/L软脂酸处理RINm5f 24 h建立RINm5f损伤模型。Exenatide 0.1、1、10 nmol/L 预处理24 h,MTT 法检测Exenatide对RINm5f存活率的影响。结果发现,软脂酸0.25 mmol/L培养RINm5f 48 h,与对照组比较细胞存活率降至(53.83±7.6)%;同时应用 Exenatide 0.1、1、10 nmol/L治疗,细胞存活率分别为(63.31±5.26)%,(65.03±5.13)%,(66.7±3.1)%。
2.3 胰岛细胞凋亡形态学观察 在激光共聚焦显微镜下,正常胰岛细胞核DNA呈黄色或黄绿色的均匀荧光,细胞质和核仁的RNA为橘黄色或橘红色荧光。凋亡早期细胞,细胞核较小,固缩呈较浓的黄绿色,或呈半月形,甚至为黄绿色碎块,可见凋亡小体。而凋亡晚期已死亡的细胞,具有凋亡细胞的形态特征,DNA被EB染成红色。坏死细胞无凋亡细胞的形态变化,但胞核染成红色,并且胞浆也染成红色,部分细胞结构不清或溶解。本实验发现,对照组很少见到凋亡细胞;0.25 mol/L软脂酸组见较多凋亡细胞,还可见到较多坏死细胞;而在Exenatide组与单纯软脂酸组比较较少见凋亡细胞。见图1。
2.4 流式细胞术 采用FITC-AnnexinV/PI双荧光标记,流式细胞术观察RINm5f细胞凋亡变化。Exenatide治疗组凋亡率明显低于软脂酸组,并呈剂量依赖性。见表1。
表1 软脂酸诱导的RINm5f细胞凋亡率(,%,n=3)
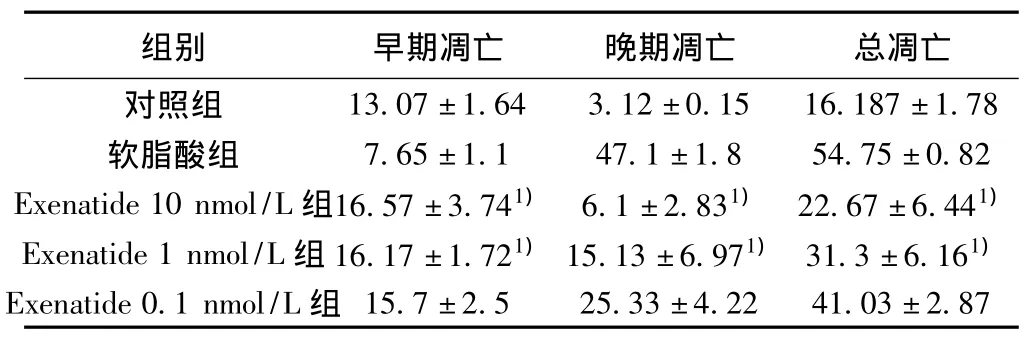
表1 软脂酸诱导的RINm5f细胞凋亡率(,%,n=3)
与软脂酸组比较:1)P<0.05
13.07±1.64 3.12±0.15 16.187±1.78软脂酸组 7.65±1.1 47.1±1.8 54.75±0.82 Exenatide 10 nmol/L组16.57±3.741) 6.1±2.831) 22.67±6.441)Exenatide 1 nmol/L组16.17±1.721)15.13±6.971) 31.3±6.161)Exenatide 0.1 nmol/L组________组别 早期凋亡 晚期凋亡 总凋亡对照组15.7±2.5_______25.33±4.22 41.03±2.87

图1 胰岛细胞凋亡形态学观察
3 讨论
糖尿病与非糖尿病患者的β细胞复制和新生并没有显著差异,只是凋亡率显著升高〔3〕。凋亡在糖尿病的发病机制中显得尤为重要。软脂酸是一种16-碳饱和脂肪酸,是脂肪酸的主要成分,在高脂肪酸损伤胰岛细胞功能过程中扮演重要角色。软脂酸可以自由出入胰岛细胞膜,导致胰岛细胞功能障碍和凋亡。
本研究可见胰岛细胞存活率下降,凋亡率升高,大部分细胞凋亡,还有部分坏死细胞。有研究证明了软脂酸诱导的这种“脂性凋亡”是由氧化应激诱导的。而Exenatide治疗组与对照组比较,可促进细胞增殖,抑制软脂酸刺激的胰岛细胞的凋亡,并随着剂量的增加总凋亡率下降,尤其是晚期凋亡率,可以阻止早期凋亡细胞进入晚期凋亡,从而对细胞起到保护作用。
Exenatide是GLP-1受体激动剂,具有与GLP-1相似的生物学活性,与GLP-1受体具有高度亲和力;其与GLP-1受体结合后可引起胞内cAMP升高,激活下游信号传导通路〔4〕,从而发挥抗凋亡作用,但其具体机制还有待进一步研究。
1 Butler AE,Janson J,Bonner-Weir S,et al.Beta-cell deficit and increased beta-cell apoptosis in humans with type 2 diabetes〔J〕.Diabetes,2003;52:102-10.
2 Rolin B,Larsen MO,Goffredsen CF,et al.The long-acting GLP-1 derivative NN2211 ameliorates glycemia and inerease beta-cellⅡlass in diabetic miee〔J〕.Am J Physiol Endocrinol Metab,2002;283:E745-52.
3 Rhodes CJ.Type 2 diabetes-amatter of b-cell life and death〔J〕.Science,2005;307(5708):380-4.
4 Gier B,Matveyenko AV,Dawson DW,et al.GLP-1 receptor activation by exenatide induces expansion of pancreatic duct glands〔J〕.Endocrinol Rev,2011;32:481-5.
