葛根素对兔动脉粥样硬化炎症因子的影响
2011-08-02沈晓君河南中医学院河南郑州450008
魏 群 陈 芳 沈晓君 魏 宴 (河南中医学院,河南 郑州 450008)
动脉粥样硬化(AS)是一种多因素引起的复杂的慢性炎症性疾病,涉及损伤的内皮细胞、单核巨噬细胞、平滑肌细胞之间的相互作用以及局部产生的细胞因子、生长因子等复杂的网络调控机制。从AS起始发病到出现临床心血管事件的整个过程中,炎症反应发挥着重要作用。本研究通过观察葛根素对动脉粥样硬化兔血脂、血清C-反应蛋白 (CRP)、细胞间黏附分子-1(ICAM-1)表达及主动脉病变的影响,探讨其通过干预炎症反应而延缓AS病变的疗效,为葛根素防治AS的研究提供依据。
1 材料与方法
1.1 实验动物 32只雄性日本大耳白兔,体重1.8~2.0 kg,普通级,5月龄,由河南省科学技术开发交流中心提供,质量合格证号:SCXK(豫2005-00027)。
1.2 主要药品与试剂 葛根素标准品购自中国药品生物制品鉴定所,纯度 99%,20 mg/瓶,批号:200511;蛋氨酸,M-9625型,Sigma公司产品;胆固醇,上海蓝季科技发展有限公司产品;兔 CRP ELISA kit,兔ICAM-1 ELISA kit,天津灏洋生物制品科技有限责任公司产品。
1.3 主要仪器 7020型全自动生化分析仪(日立公司),Model550酶标仪(Bio-rad公司产品)。
1.4 动物分组与AS模型建立 适应性喂养3 d后,将32只雄性日本大耳白兔随机分为正常对照组,模型组,葛根素低及高剂量组,每组8只。正常组饲喂普通饲料,模型组在普通饲料中加入1%胆固醇及0.02%蛋氨酸复制AS模型〔1〕,葛根素低及高剂量组高脂饲料喂养的同时给予葛根素胃管饲法100 mg·kg-1·d-1、200 mg·kg-1·d-1,正常对照组、模型组同等量的生理盐水灌胃。饲喂9 w后,各组动物戊巴比妥钠静脉麻醉后采血,离心后迅速置于-80℃冰箱中保存。开胸快速截取胸主动脉上段,生理盐水洗净,10%中性甲醛液固定,乙醇脱水,石蜡包埋,均匀切片(每片厚5 μm)。
1.5 血清生化测定 采用全自动生化分析仪分别检测兔血清总胆固醇(TC),低密度脂蛋白胆固醇(LDL-C)。
1.6 ELISA检测 按试剂盒说明操作,检测各组兔血清CRP,ICAM-1水平。
1.7 病理组织学检查 HE染色,光镜下观察胸主动脉组织形态学改变。
2 结果
2.1 血清生化测定 模型组兔血清TC,LDL-C显著升高,与正常组相比差异显著(P<0.01或P<0.05);葛根素低及高剂量组TC,LDL-C显著低于高脂模型组(P<0.01或P<0.05)。见表1。
2.2 ELISA检测 结果显示模型组兔血清与正常组相比CRP、sICAM-1显著升高;与模型组相比,葛根素低及高剂量组兔血清CRP,sICAM-1显著降低(P<0.01或P<0.05)。见表1。
表1 葛根素对AS家兔血脂,血清CRP及sICAM-1水平的影响(,n=6)
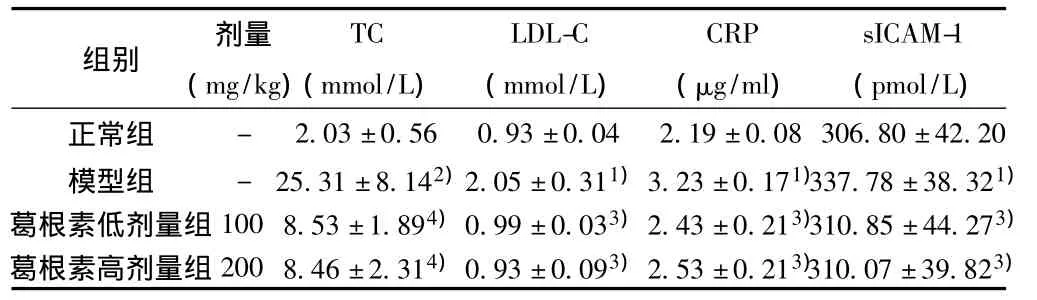
表1 葛根素对AS家兔血脂,血清CRP及sICAM-1水平的影响(,n=6)
与正常组比较:1)P<0.05,2)P<0.01;与模型组比较:3)P<0.05,4)P<0.01
组别 剂量____________(mg/kg)TC(mmol/L)LDL-C(mmol/L)CRP(μg/ml)sICAM-1(pmol/L)正常组 - 2.03±0.56 0.93±0.04 2.19±0.08 306.80±42.20模型组 - 25.31±8.142)2.05±0.311)3.23±0.171)337.78±38.321)葛根素低剂量组100 8.53±1.894)0.99±0.033)2.43±0.213)310.85±44.273)葛根素高剂量组200_ 8.46±2.314)0.93±0.093)2.53±0.213)310.07±39.823)
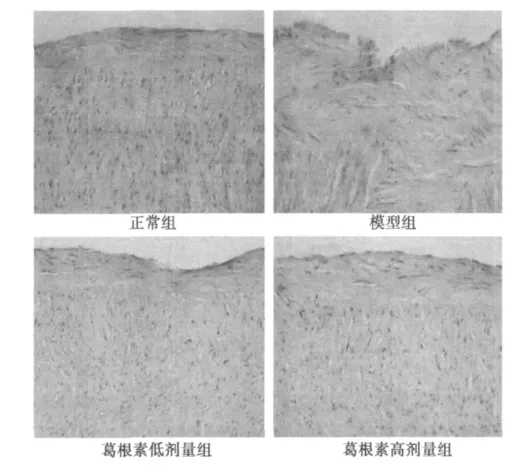
图1 兔主动脉组织切片(HE,×100)
2.3 病理组织学检查 图1可见,正常组动脉内膜完整,内皮细胞连接紧密,中膜平滑肌排列整齐;模型组血管内膜增厚,内皮细胞损伤、脱落、明显缺失,中膜VSMC增生、迁入内膜并可见其分泌的大量的细胞外基质;葛根素干预组血管内膜轻度增厚,内皮细胞无明显损伤性改变,内膜基本完整,中膜VSMC排列较整齐,未见VSMC明显增生及迁入内膜等AS病变。
3 讨论
本实验通过饲喂蛋氨酸及高胆固醇饲料诱导建立兔AS模型,蛋氨酸在体内经过依赖腺苷蛋氨酸的转甲基反应可产生同型半胱氨酸(HCY)。Zhou 等〔2,3〕体内外研究表明,HCY 浓度升高与AS等心脑血管疾病的发生密切相关,高同型半胱氨酸血症是AS发生的独立危险因子,主要是由于在代谢过程中可产生活性氧自由基而损伤内皮细胞或加强低密度脂蛋白氧化,抑制NO合成酶的合成和活性,抑制L-精氨酸的转运,减少NO的合成,从而导致内皮功能障碍。Suhara等〔4〕的研究表明,HCY可通过激活NF-κB,促进死亡受体Fas表达诱导血管内皮细胞凋亡。
CRP主要由肝脏合成,是一种典型的人类急性期蛋白,也是一种炎症介质。近年来大量流行病学调查研究显示,CRP血浆水平的差异是AS等心血管疾病发病风险、严重程度及预后状况的灵敏标识〔5,6〕。研究证实CRP可直接导致血管的炎症状态,并间接促进白介素等炎症因子的生成和释放,导致炎症反应瀑布效应,直接促进动脉粥样硬化的始动和进展〔7〕。CRP可刺激血管内皮细胞表达黏附分子及产生血浆酶原激活抑制剂,抑制血管内皮细胞产生一氧化氮,刺激巨噬细胞吞噬LDLC,激活血管紧张素-1受体,促进血管平滑肌增殖,形成AS病变。研究表明,缓解AS进程的治疗效果与CRP水平的同步变化直接相关〔8,9〕,而以CRP水平为参考进行的早期干预则使血脂正常受试者AS发病风险减半〔10〕。
VCAM-1在内皮损伤或 IL-1、TNF-α和IFN-γ等炎症因子的刺激下由血管内皮细胞表达,定位于细胞膜,属于免疫球蛋白超家族细胞黏附分子。Yamada等〔11〕的研究发现,ICAM-1参与了动脉的炎症过程,是动脉粥样硬化过程使动的关键因素。VCAM-1可特异地与白细胞产生的Integrin家族的黏附因子VLA-4结合,介导单核细胞、淋巴细胞与血管内皮细胞的黏附,而单核细胞、T淋巴细胞与血管内皮细胞发生黏附代表着动脉粥样硬化早期炎症的开始。Luc等〔12〕的研究认为,VCAM-1水平可以反映冠状动脉粥样硬化病变的严重程度和动脉粥样斑块的不稳定状态。Hastings等〔13〕最近的实验表明,IL-8可通过下调内皮细胞和血管平滑肌细胞中VCAM-1的表达而抑制炎症反应。
本实验结果表明,葛根素干预组兔血清TC,LDL-C显著低于模型组,病理学检验葛根素干预组血管内皮细胞损伤及中膜血管平滑肌细胞增生的程度较模型组明显减轻,进一步支持葛根素调节血脂,拮抗HCY诱导的血管平滑肌细胞增生和内皮细胞损伤,延缓AS病变进展的理论。本实验中葛根素干预组血清CRP和sICAM-1显著低于模型组,提示葛根素通过下调炎症介质和黏附因子的表达,抑制单核细胞与血管内皮细胞黏附,抑制血管壁炎症反应而发挥抗AS作用,但葛根素下调AS时炎症因子表达的确切机制还有待于进一步的深入研究。
1 Tavridou A,Kaklamanis L,Papalois A,et al.EP2306〔2-(4-Biphenyl)-4-methyl-octahy dro-1,4-benzoxazin-2-ol,hydrobromide〕,a novel squalene synthase inhibitor,reduces atherosclerosis in the cholesterol-fed rabbit〔J〕.J Pharmacol Exper Therapeu,2008;323(3):794-804.
2 Zhou,MD,Geoff Werstuck,Sárka Lhoták,et al.Association of multiple cellular stress pathways with accelerated atherosclerosis in hyperhomocysteinemic apolipoprotein E-deficient mice〔J〕.Circulation,2004;13(7):207-13.
3 Nonaka H,Tsujino T,Taurine YW,et al.Prevents the decrease in expression and secretion of extracellular superoxide dismutase induced by homocysteine amelioration of homocysteine-induced endoplasmic reticulum stress by taurine〔J〕.Circulation,2001;104(11):1165-70.
4 Suhara T,Fukuo K,Yasuda O,et al.Homocysteine enhances endothelial apoptosis via upregulation of Fas-mediated pathways〔J〕.Hypertension,2004;43(6):1208-13.
5 Singh SK,Suresh MV,Voleti B,et al.The connection between C-reactive protein and atherosclerosis〔J〕.Ann Med,2008;40(2):110-20.
6 Kaptoge S,Di Angelantonio E,Lowe G,et al.C-reactive protein concentration and risk of coronary heart disease,stroke,and mortality:an individual participant meta-analysis〔J〕.Lancet,2010;375(9709):132-40.
7 Haghjooyjavanmarda S,Nematbakhsha M,Monajemia A,et al.Von Willebrand factor,C-reactive protein,nitric oxide,and vascular endothelial growth factor in a dietary reversal model of hypercholesterolemia in rabbit〔J〕.Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2008;152(1):91-5.
8 Ridker PM,Cannon CP,Morrow D,et al.C-reactive protein levels and
outcomes after statin therapy〔J〕.N Engl J Med,2005;352(1):20-8.9 Nissen SE,Tuzcu EM,Schoenhagen P,et al.Statin therapy,LDL cholesterol,C-reactive protein,and coronary artery disease〔J〕.N Engl J Med,2005;352(1):29-38.
10 Ridker PM,Danielson E,Fonseca FA,et al.Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein〔J〕.N Engl J Med,2008;359(21):2195-207.
11 Yamada S,Wang KY,Tanimoto AK,et al.Matrix metalloproteinase 12 accelerates the initiation of atherosclerosis and stimulates the progression of fatty streaks to fibrous plaques in transgenic rabbits〔J〕.Am J Path,2008;172(5):1419-29.
12 Luc G,Arveiler D,Evans A,et al.Circulating soluble adhesion molecules ICAM-1 and VCAM-1 and incident coronary heart disease:the PR MIE Study〔J〕.Atherosclerosis,2003;170(1):169-76.
13 Hastings NE,Feaver RE,Lee MY,et al.Human LI-8 regulates smooth muscle cell VCAM-1 expression in response to endothelial cells exposed to atherop rone flow〔J〕.Arterioscler Thromb Vasc Biol,2009;29(5):725-31.
