红葡萄酒花色苷的研究
2011-07-31西南大学食品科学学院400715陈颖秋黄永俊马小星邓泽丽
□西南大学食品科学学院 400715 陈颖秋 黄永俊 马小星 邓泽丽 洪 镭
1 花色苷的概述
按照我国最新的葡萄酒标准GB15037-2006规定,葡萄酒是以鲜葡萄汁为原料,经全部或部分发酵酿制而成的,酒精度不低于7.0%的酒精饮品。红葡萄酒颜色是非常重要的质量指标之一,红葡萄酒色度的深浅不仅决定着葡萄酒的品质,而且对葡萄酒感官质量的影响很大。红葡萄酒中的呈色物质主要是花色苷,它是决定红葡萄酒品质和感官质量的重要因素之一。花色素苷(Anthocyani)是苯并吡喃(peno-tyrilium)的衍生物,广泛存在于绝大部分陆生植物的液泡中(除仙人掌、甜菜外),是水溶性黄酮类色素中最重要的一类,赋予水果、蔬菜、饮料制品等红色、粉红、蓝色、紫色等五彩缤纷的颜色,特定条件下出现黑色。也就是说,花色素苷可带来除绿色之外的所有颜色。花色苷赋予红葡萄酒红色,它在红葡萄酒新酒中的含量为200~500 mg/L。
1.1 花色苷的结构
花色苷由花色素和糖基构成,属黄酮类化合物,天然花色苷糖基基本结构为3,5,7-三羟基-2-苯基苯并吡喃。花色素因3、5位上取代基差异而有不同种类。目前已知天然花色素有30余种,植物中常见的有6种:天竺葵色素(pelargonidin)、矢车菊色素(cynaidin)、飞燕草色素(delphinidin)、芍药色素(peonidin)、牵牛花色素(petunidin)和锦葵色素(malvidin)。各种花色苷结构上的差异是配糖体上羟基和甲氧基数目和位置,配糖体上结合的糖基数目、种类和位置、羟基乙酰化及与糖基相连脂肪酸种类与数目。这些差异决定了花色苷生物学性状和功能的多样性。
花色苷是花青素的糖苷,由一个花青素(花色苷元)与糖以糖苷键相连。花青素具有类黄酮典型的C6—C3—C6的碳骨架结构。与花色素成苷的糖主要是葡萄糖、半乳糖、李糖、阿拉伯糖和由这些单糖构成的均匀或不均匀的双糖和三糖。自然界中最常见的花色素结构见图1。
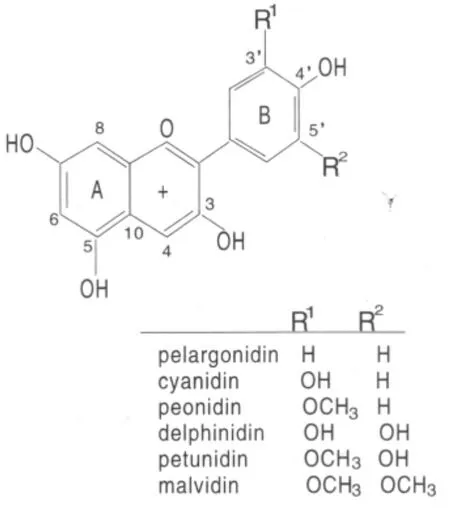
图1
1.2 花色苷的性质
花色苷为水溶性天然食用色素,花色苷和花色素的稳定性均不高,花色苷的种类不同,其溶解度也有所不同,一般可溶于水和乙醇溶液,其颜色随羟基(-OH)、甲氧基(-OCH3)、糖的结合位置及花色苷种类的数目不同而有所差别。影响花色苷稳定性的主要因素有花色苷的结构、pH值、氧浓度、氧化剂、亲核试剂、酶、金属离子、温度和光照等。
1.2.1 pH值的影响:花色苷随pH值的变化可出现4种结构形式(如图2所示),即蓝色醌式结构(A)、红色2-苯基苯并吡喃阳离子(AH+)、无色醇型假碱(B)和无色查尔酮(C)。
每种平衡型的相对数量不仅和pH有关,还和特定的花色苷结构有关。pH值不同的情况下,花色苷的形式发生变化,从而影响其呈色情况。在对其进行的实验研究表明:pH2时,吸光值最大(0.713),颜色为紫红色;pH3时,溶液颜色变化不明显,但色素吸光度值明显降低;pH4时,溶液颜色明显变浅;pH5~6时,溶液颜色更浅,吸光度值降为原来的50%左右;当pH≥9时,花色素的特征颜色基本消失,呈蓝绿或蓝紫色。为了使色素溶液保持正常的颜色,应该使溶液的pH值维持在2~3。
1.2.2 光照的影响:光照对花色苷具有两种作用,一是有利于花色苷的生物合成,二是能引起花色苷的降解。在避光和室内自然光下花色素变化很小,性质表现稳定,而在室外阳光下,花色素含量降到原来一半的时间(即半衰期)不到5h,色素溶液颜色明显变浅。
1.2.3 温度的影响:花色素苷受温度的影响程度取决于受热时间的长短和温度的高低。温度越高,色素保持稳定的时间越短,花色苷的颜色变化越快。110℃被认为是花色苷分解的最高温度。在60℃以下,花色苷的分解速度较低。花色素苷对巴氏消毒是稳定的,对高温(90℃)短时间(30min)热处理也是稳定的,颜色均无变化,但长时间处于较高温度下色素会发生褐变。

图2
1.2.4 金属离子的影响:花色苷与Al3+、Fe2+、Fe3+、Sn2+、Ca2+ 等可以发生络合反应,从而对花色苷的颜色起到稳定作用。Zn2+、Ca2+浓度在小于0.02g/mL时,对花色素影响不显著,颜色变化不明显。在B一环上含有邻位羟基的花色苷能与金属离子络合。Fe3+对色素有强烈的破坏作用,使色素很快变为橙黄色并有沉淀生成。Fe3+离子的各浓度间对花色素稳定性不良影响差异极显著,浓度越高影响越大,花色素最大降幅约30%,溶液颜色变成浅红褐色。光谱分析发现Fe3+使色素的结构发生了变化,最大吸收峰消失。因此,红酒应避免接触铁器,包装需用铝箔袋、玻璃瓶等。虽然金属离子对花色苷具有稳定和保护作用,但其效应也不是有益无害的,因为在增色的同时形成的金属——单宁络合物可导致褪色。
1.2.5 氧气、水分活度的影响:在分子氧存在的条件下,花色苷会降解生成无色的或褐色的物质,这是由于花色素高度的不饱和结构和其对氧气颇为敏感所致。水分活度对花色苷稳定性的影响机理还不明确,但是已经证实,在水分活度0.63~0.79 范围内 ,花色苷的稳定性相对最高。
1.2.6 维生素C的影响:在含有维生素C和花色苷的果汁中,这两种物质的含量会同步减少。维生素C在氧化中可以产生 H2O2,对 2- 苯基苯并吡喃阳离子的2位碳进行亲核进攻,从而产生无色的酯和香豆素等衍生物,进一步的降解或聚合,最终在果汁中产生褐色沉淀物。有实验表明:在室内自然光下,维生素C含量小于1.0g/mL时,对花色素的含量影响不大。
1.2.7 辅色剂的影响:辅色剂的主要作用是使几乎所有的花色素苷在适宜的条件下产生红移并增加最大吸收波长的吸光度。辅色作用受pH值、辅色剂和色素的种类及浓度的影响。辅色剂主要是黄酮类化合物、氨基酸、核苷酸,花色素苷自身也可以成为辅色素。
1.2.8 酶的影响:葡萄组织中的酶可以破坏葡萄与葡萄酒中花色素苷,在花色苷降解过程中,涉及到的酶有糖苷酶和多酚氧化酶这两大类。糖苷酶可水解花色苷得到游离的糖和花色素,花色素很不稳定,可自发转换成无色的物质。多酚氧化酶作用于存在邻二酚羟基的花色苷,产生的中间产物——邻醌能通过化学氧化作用使花色苷转化为氧化的花色苷及降解产物。
1.2.9 SO2的影响。二氧化硫是食品工业中常用的防腐剂和漂白剂。二氧化硫对花色苷的漂白可能可逆或不可逆。当二氧化硫用量在500~2 000ug/g时,这种漂白是可逆的,在后续的加工中,通过大量水洗脱后,颜色可部分恢复。对不可逆漂白的反应研究较多,认为二氧化硫在果汁的酸作用下形成亚硫酸氢根,它对花色苷4一位碳亲核攻击生成了无色的花色苷亚硫酸盐复合物。
1.3 花色苷的生理功能
1.3.1 抗氧化活性:花色苷具有极强抗氧化作用,且抗氧化强弱与其结构有关:苷元母核B环上3’4’邻二酚羟基有很强的供氢能力,可捕获自由基,抗氧化性最好;此外A环上5、7、8位增加羟基可不同程度增加抗氧化能力。研究结果提示,原花青素是良好的天然抗氧化剂,通过清除体内过多的自由基,抑制脂质过氧化,维持体内自由基和抗氧化酶之间的平衡,与体内各种抗氧化酶共同维持机体的稳态,从而预防由于自由基或脂质过氧化造成的各种疾病,发挥抗疲劳、抗辐射损伤、抗衰老等作用。
1.3.2 抗突变、抗癌:孙志广等从遗传学和生化毒理学角度研究了葡萄提取物的抗诱变作用及机理。通过微核试验和小鼠肝组织中谷胱甘肽-S-转移酶(GST)活性、还原型谷胱甘肽(GSH)含量的测定,表明花青素对环磷酰胺(CPA)诱发的小鼠骨髓多染红细胞(PCEs)微核细胞有较强的抑制作用,并能提高肝脏GST活性,升高GSH含量,说明花青素对化学诱变剂引起的染色体断裂有一定保护作用。一些研究发现花色苷具有抗癌作用,有些甚至在微摩尔量剂量就可在体外抑制人肿瘤细胞生长的能力。可抑制体外人阴道癌细胞株A431的生长。花色苷抑制肿瘤的机制与诱导肿瘤坏死因子的产生有关。
1.3.3 保护心血管及神经系统:张小郁等用胰蛋白酶(DOG)、阿霉素(ADR)、黄嘌呤氧化酶(X-XO)造成损伤模型,比色法测定培养液中LDH的活性。结果表明,葡萄中原花青素对心肌细胞损伤有一定保护作用。另外,花色苷可抵抗组胺等诱导的动脉收缩和抑制血管紧张素转换酶活性,降低和维持正常血压。
1.3.4 改善视力:通过给兔子静脉注射花青苷、花翠素、甲花翠素及锦葵花素的配糖体,在暗黑下的适应初期可促进兔子视紫质的再合成,于是推测花色苷对视紫质的再合成体系具有活化作用,从而具有提高视力的功能。而在适应末期,视网膜中的视紫质的量比对照兔子要高得多。
1.3.5 其他功效:花色苷具有多种生理功效,如花色苷能通过防止应激反应和吸烟引起的血小板凝集来减少心脏病和中风的发生;具有抗炎功效,因而可以预防包括关节炎和肿胀在内的炎症;可以缓解花粉病和其他过敏症;防止肾脏释放出的血管紧张素转化酶所造成的血压升高(另一个降血压功效);作为保护脑细胞的一道屏障,防止淀粉样β蛋白的形成、谷氨酸盐的毒性和自由基的攻击,从而预防阿尔茨海默氏病;通过对弹性蛋白酶和胶原蛋白酶的抑制使皮肤变得光滑而富有弹性,从内部和外部同时防止由于过度日晒所导致的皮肤损伤等等。
1.4 葡萄酒花色苷的研究现状
目前对葡萄与葡萄酒中花色素苷的研究,主要集中在葡萄与葡萄酒中花色素苷的医疗保健作用和机理;组织培养技术生产天然花色素苷的研究;葡萄中花色素苷的种类、含量、变化规律和影响其含量的因素;花色素苷的生物合成途径、合成花色素苷的基因和酶的研究;葡萄酒中花色素苷的种类、含量、变化规律和机理;花色素苷的理化性质、花色素苷的提取纯化和分析;葡萄与葡萄酒中花色素苷的应用研究等方面。
2 葡萄酒中花色苷的测定
2.1 高效液相色谱(HPLC)
HPLC可以高效分离、检测、定性和定量分析葡萄与葡萄酒中的花色素苷,对样品处理少,不需衍生化。J.Bakker等比较了HPLC和光谱法测定花色素苷的差异,认为:HPLC可以真实地测定红葡萄酒中游离的花色素苷含量,而光谱法得到的结果则偏高。与HPLC-MS相比,HPLC更加普及,成本更加低廉。目前,HPLC仍然是测定葡萄与葡萄酒花色素苷最常用的方法。
2.2 光谱定量分析方法
pH示差法中,为使pH示差法有较好的灵敏度及准确性,pH的选定对花色素苷的定量分析具有重要的意义。在此两个pH处测定的花色素苷的吸光值差异应是最显著的;单一pH的轻微变动,对花色素苷吸光值的影响是极小的;花色素苷在所处的两个pH下,应是相当稳定的。
花色苷的含量:(mg/100g)=(△ODpH1.0-pH4.5×DV×VF)/(avE1%1cm×W×10)
△ODpH1.0-pH4.5:花色素苷溶液在pH=10和pH=4.5之间的吸光度之差
DV:稀释体积VF:稀释倍数W:样品重量avE1%1cm:平均消光系数
2.3 亚硫酸脱色法
利用花色素可与酸性亚硫酸根离子结合成无色络合物的性质,在添加过量的酸性亚硫酸盐之后,酒的颜色发生变化。这种变化是和花色素苷含量成正比例发展的。从色度的高低可以求出花色素苷含量的多少。
2.4 毛细血管电泳(CE)
毛细血管电泳也可以用来分析花色素苷(包括游离和聚合),它具有灵敏度高、分辨率高、样品消耗少和溶剂需要量少等特点。RubenSaenz-Lopez等(2004)用毛细管区带电泳(CZE)分析了酒龄在1~14年的红葡萄酒,根据不同的迁移顺序判断花色苷种类。CZE可以测定葡萄酒中的聚合色素,不像HPLC,CZE可以很容易地分离聚合色素,具有比HPLC更短的保留时间,更少的溶剂消耗量,更高的分离效率,更低的成本。但是CZE的灵敏度不优于HPLC,而且也达不到HPLC分离复杂化合物的范围。
2.5 质谱法
质谱是物理分析方法,在一定条件下,可以给出复杂有机物的确定的重复的质谱图。质谱可以给出花色素苷的分子离子峰、其相应的糖苷配基碎片峰和糖碎片峰。JohannaBakker和ColifF.Timberlake在分析葡萄酒花色素苷时,采用 FAB(FastAtomBombardment),用氙气轰击样品使之离子化,给出分子离子峰等相关数据,这种方法适用于分析极性大分子量的化合物。此外,还有电子轰击质谱(LC-EI-MS)和激光解吸/电离质谱(MALDI-MS),这些都适用于高极性、热稳定性差、难挥发葡萄酒中的花色苷。
3 展望
在鉴别葡萄酒真假的众多研究方法中,需要精密的仪器太多,需要的方法太复杂,所以建立一套以葡萄原料所含天然特性成分花色苷的性质为依据的、简单易行的全汁和非全汁葡萄酒的鉴定方法,更多的了解花色苷的性质、功能等,具有重要的理论意义。若利用葡萄酒中的呈色物质花色苷在不同的pH值环境中显色作用不同,即随pH值改变而发生可逆性结构变化和颜色变化的原理制定出的简单易行的鉴定方法,待技术成熟之后,此研究的实际意义和经济意义非常巨大。
[1]陈继峰.红葡萄酒颜色研究[J].酿酒科技,2008(5):95~100.
[2]邓洁红,谭兴和,潘小红,王峰.葡萄花色素苷研究进展[J].包装与食品机械,2006,6,(24):25~29.
[3]WROLSTAD R E,ROBERT W D,JUNGMIN L.Trackingcolorandpigment changes in anthocyaninproducts[J].Trends inFoodScienceandTechnology,2005,16:423~428.
[4]王瑞兰,欧阳蒲月,籍秀梅,等.食用植物中花色苷研究[N].湘潭师范学院学报(自然科学版),2008,4(31):34~37.
[5]安田齐.花色苷的生理生物化学[M].薄玉兰,译.北京:中国林业出版社,1989.
[6]刘丽媛,苑伟,刘延琳.红葡萄酒中花色苷辅助成色作用的研究进展[J].中国农业科学,2010,43(12):2518~2526.
[7]彭打橱,于化弘,赵哲霞.具有抗氧化效果的植物性食品[J].江西食品工业,2005,1:44~48.
[8]孙志广,赵万洲,陆茵,等.葡萄籽原花青素对鼠伤寒沙门氏菌的抗诱变作用[J]. 癌变·畸变·突变,2002,14(3):191~194.
[9]张小郁,李文广,高明堂,等.葡萄籽中原花青素对心肌细胞的保护作用[J].中药药理与临床,2001,17(6):14~16.
[10]徐璐,郑建仙.欧洲越桔花色苷的研究概况 [J].中国食品添加剂,2005,4:43~47.
[11]韩富亮.葡萄与葡萄酒花色素苷HPLC指纹图谱的初步研究[D].硕士学位;西北农林科技大学,2005.
[12]Rubén Sáenz-López,Purificación Fernández-ZurbanoandMaríaTeresa Tena.Analysis of aged red wine pigments bycapillary zone electrophoresis[J].Journal of Chromatography A,Volume 1052,Issues1~2,15October2004,191~197.
[13]姜平平,吕晓玲,朱惠丽.花色苷类物质分离鉴定方法[J].中国食品添加剂,2003(4):108~111.
