灯盏乙素苷元4′-N-取代氨甲基苯甲酸酯的合成与活性研究*
2011-07-29邢凤晶傅晓钟兰燕宇王爱民王永林
邢凤晶,张 伟,傅晓钟,兰燕宇,王爱民,王永林,李 靖,周 雯,刘 影
(贵阳医学院药学院,贵州 贵阳 550004)
研究证实,氧化损伤是神经退行性疾病如阿尔茨海默病(Alzheimer's disease,AD)与血管性痴呆(vascular dementia,VD)等产生的关键因素[1-2]。灯盏乙素可显著改善海马区神经元的形态,减轻脑组织的过氧化损伤[3],从而对神经退行性疾病的治疗具有重要价值,但其水溶性差(0.056 g/L)、脂溶性差、pH=4.2的磷酸盐缓冲液中logP为-2.56、口服生物利用度低(0.4%)等缺陷,使其推广应用受到较大限制[4-5]。口服灯盏乙素后,其体内真正的吸收与药效形式是灯盏乙素苷元[6];在氨基酸结构的氨基和羧基之间引入苯环,能有效克服氨基酸衍生物因邻近氨基与羧基的参与而在弱酸环境下易水解的缺点,提高前药的化学稳定性[7]。笔者以灯盏乙素苷元为先导化合物进行结构修饰,以期达到改善其理化性质与提高抗氧化活性的目的,并对受试化合物进行了初步体外活性检测,报道如下。
1 仪器与试药
Varian INOVA-400M型核磁共振仪(美国Varian);ACQUITY TQD型超高效液相色谱-质谱联用仪(美国Waters);LC-10AVP型高效液相色谱仪(日本岛津),Hedera ODS-2色谱柱(250 mm×4.6 mm,5μm)。4- 氯甲基苯甲酸(批号为 16318)、二氯二苯甲烷(批号为20101028)均为南京康满林化工有限公司产品;二甲氨基吡啶(批号为 T20090928)、DEME(批号为 F20090218)、二乙胺(批号为T20090122)、苄胺(批号为F20070618)、吗啉(批号为11033)均购自国药集团上海化学试剂有限公司;分离用硅胶(未说明者均为200~300目,青岛海洋化工分厂);PC12细胞株(中国医学科学院医药生物技术研究所);维生素E(Sigma公司);DMEM高糖培养基(Gibco公司);胎牛血清(杭州四季青生物工程材料有限公司);四甲基偶氮唑盐(MTT,Sigma公司);乳酸脱氢酶(LDH)测定试剂盒(南京建成科技有限公司)。
2 方法与结果
2.1 化合物的合成
2.1.1 合成路线
合成路线见图1。
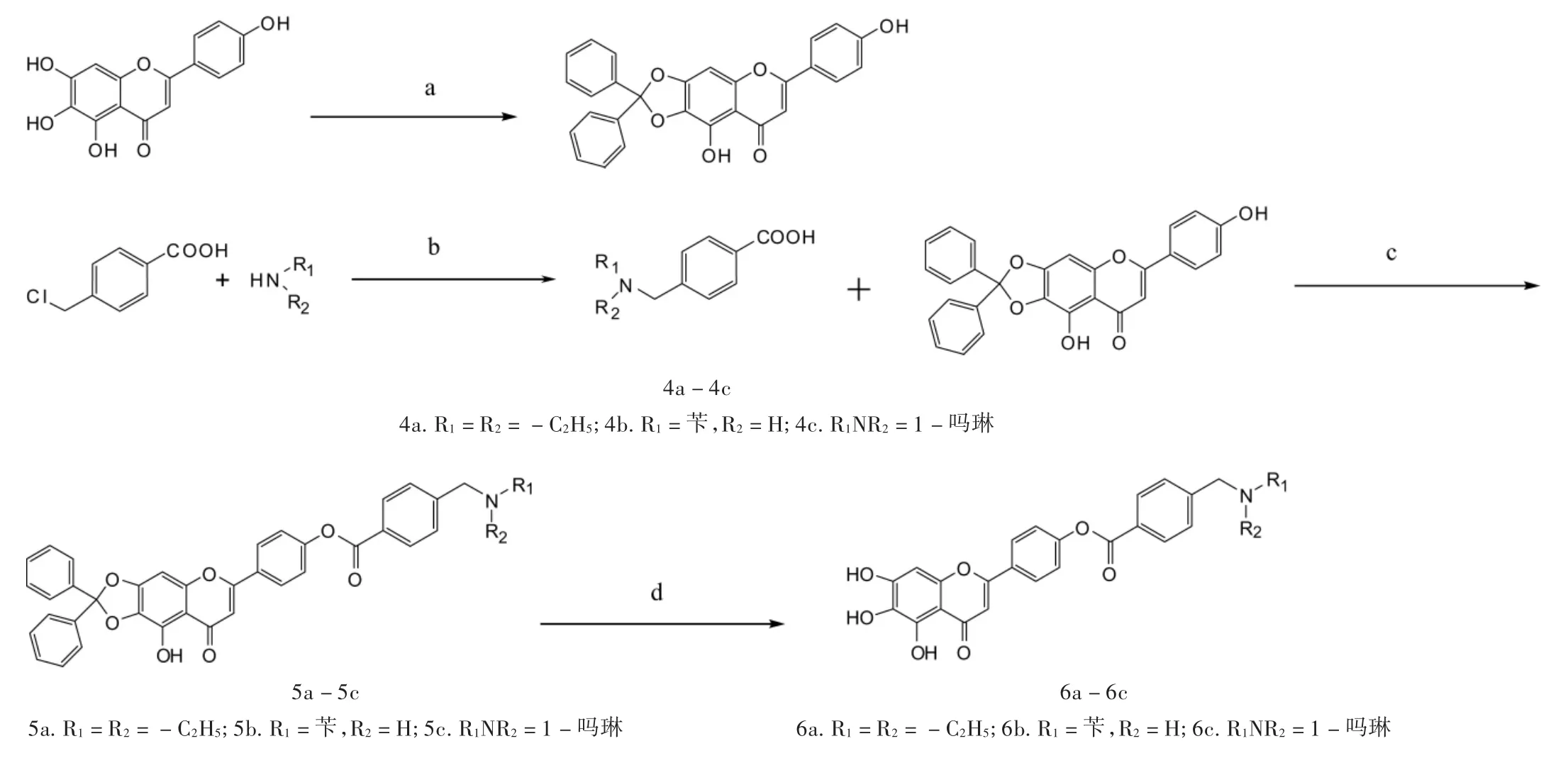
图1 目标化合物的合成路线
2.1.2 合成步骤
6,7-羟基缩酮保护灯盏乙素苷元的制备:将灯盏乙素苷元0.2 g(0.7 mmol)溶于 10 mL 二甘醇二甲醚(DME)中,加入二甲氨基吡啶(DMAP)0.1 g(0.81 mmol),加入二氯二苯甲烷 0.49 g(21 mmol),180℃条件下,回流反应2 h。溶剂减压蒸尽,残余物经硅胶柱层析分离(洗脱剂为氯仿∶甲醇=80∶1),得浅棕黄色粉末状固体 0.22 g,熔点(mp)250 ~252 ℃,收率 68.4%。
N,N-取代氨甲基苯甲酸(4a~4c)的合成:室温、氮气保护下将对氯甲基苯甲酸(4 g,23.4 mmol)置500 mL三颈瓶中,加入40 mL无水乙醇,向反应体系缓慢滴加溶有N-取代胺(93.6 mmol)的无水乙醇溶液19.6 mL,滴毕,体系回流反应24 h,薄层色谱监测反应完全,冷却,将反应体系浓缩,加入40 mL蒸馏水溶解,加入乙醚萃取2次,每次20 mL,合并水层,冰浴下滴加浓盐酸,调pH至4~5,析出白色沉淀,抽滤,水洗滤饼,剩余固体用热异丙醇超声提取2次,每次30 mL,合并醇层,减压蒸除溶剂后残余物以氯仿∶甲醇∶乙酸=15∶1∶0.5(V/V)为洗脱剂经硅胶柱层析分离纯化,得N-取代氨甲基苯甲酸。
灯盏乙素苷元4'-N,N-取代氨甲基苯甲酸酯(6a~6c)的合成:将N,N-取代氨甲基苯甲酸(95μmol)置25 mL两口反应瓶中,加入0.5 mL二甲基亚砜(DMSO)与5 mL四氢呋喃(THF)搅拌至体系完全澄清,后加入二甲氨基吡啶(DMAP,4 mg,33μmol)与缩酮保护的灯盏乙素苷元30 mg(67μmol),搅拌至体系澄清后滴加含有N,N'-二环己基碳酰亚胺(DCC,17 mg,81μmol)的 3 mL 四氢呋喃溶液,滴毕,室温搅拌条件下反应14 h。薄层色谱监测至原料转化完全后,体系减压浓缩除去四氢呋喃,后用氯仿-水体系萃取3次,洗出体系中二甲基亚砜溶剂,收集氯仿层,无水硫酸镁干燥1 h后过滤,将滤液浓缩,残余物以氯仿∶甲醇 =30∶1为洗脱剂,硅胶柱层析分离得6,7-二苯缩酮保护灯盏乙素苷元-4'-氨甲基苯甲酸酯(5a~5c)。在25 mL干燥的茄形瓶中,加入3 mL乙酸乙酯,冰盐浴(-5℃)搅拌下,依次加入甲醇(0.03 mL,0.7 mmol)、乙酰氯(0.028 mL,0.4 mmol),保温反应3 h,向反应体系中滴加含有6,7-二苯缩酮保护灯盏乙素苷元-4'-取代氨甲基苯甲酸酯(0.04 mmol)的2 mL乙酸乙酯溶液,保温反应2 h后升至室温反应12 h,有黄色沉淀物附着于壁,加适量乙酸乙酯超声、洗涤并真空干燥,得到目标化合物6a~6c。
2.2 化合物的鉴定
化合物6a:灯盏乙素苷元4'-N-取代对二乙氨甲基苯甲酸酯。浅黄色固体,产率 52.6% ,mp 为 270-272 ℃ 。1H-NMR(400 MHz,DMSO-d6)δ:12.67(brs, 1H, 5-OH), 10.67(brs, 1H, 7-OH),8.68(brs,1H,6-OH),8.29-8.17(m,4H,Ar'-H3,5,Ar″-H3,5),7.89(d,J=8.0 Hz,2H,Ar'-H2,6),7.53(d,J=8.4 Hz,2H,Ar″-H2,6),6.97(s, 1H, Ar-H8), 6.65(s,1H, Ar-H3), 3.76(s, 2H, Ar″-CH2N),3.06(m,4H,2 ×NCH2CH3),1.25-1.23(m,6H,2 ×CH3)。ESI-MS(m/z)[M-H]-:474.2。
化合物6b:灯盏乙素苷元4'-N-取代对苄氨甲基苯甲酸酯。黄色粉末,产率 46.7% ,mp 为 300℃ (dec.)。1H-NMR(400 MHz,DMSO-d6)δ:12.63(brs, 1H, 5-OH), 10.70(brs, 1H, 7-OH),8.83(brs,1H,6-OH),8.28-8.23(m,4H,Ar'-H3,5,Ar″-H3,5),7.79(d,J=8.8 Hz,2H,Ar'-H2,6),7.57-7.55(m,5H,Ph-5H),7.51(d,J=8.8 Hz,2H,Ar″-H2,6),6.97(s,1H,Ar-H8),6.66(s,1H,Ar-H3),4.29(s,2H,Ar″-CH2N),4.18(s,2H,CH2Ph)。ESIMS(m/z)[M-H]-:508.5。
化合物6c:灯盏乙素苷元4'-N-取代对吗啉甲基苯甲酸酯。黄色粉末,产率 56.4% ,mp 为 300 ℃ (dec.)。1H-NMR(400 MHz,DMSO-d6)δ:12.63(brs, 1H, 5-OH), 10.65(brs, 1H, 7-OH),8.31(brs,1H,6-OH),8.31-8.17(m,4H,Ar'-H3,5,Ar″-H3,5),7.83(d,J=7.2 Hz,2H,Ar'-H2,6),7.52(d,J=8.8 Hz,2H,Ar″-H2,6),6.98(s, 1H, Ar-H8), 6.65(s,1H, Ar-H3), 3.92(s, 2H, Ar″-CH2N),3.75(m,4H,2 ×CH2O),2.52(m,4H,2×CH2N)。ESI-MS(m/z)[M-H]-:488.1。
2.3 化合物的药理活性研究
2.3.1 MTT 法检测细胞毒性
将PC12细胞消化为单个细胞悬液,调整细胞密度为5×104个/mL,接种于 96孔板(100 μL/孔),于 37℃和 5%CO2培养箱培养过夜。待细胞贴壁后吸去上清,加入含浓度梯度稀释药物(1,10,50,100μmol/L)的培养液,置培养箱中继续培养。于加药后24 h,吸去上清液,加入含MTT(0.25 g/L)无血清培养基,培养4 h,吸去培养液,加入100 μL二甲基亚砜振荡使Formazan结晶溶解,490 nm波长处测定各孔吸光值,计算细胞半数毒性浓度(TC50)。结果见表1。
2.3.2 LDH 漏出率试验
选取对数生长期PC12细胞,以每孔100μL,5×104~10×104个/mL种植于96孔培养板中,将培养板置37℃和5%CO2培养箱中孵育24 h。试验分为正常对照组、阳性对照组、加药组。过滤培养基后,取细胞板,小心吸去培养液,换液加药。正常对照组每孔加入100 μL的DMEM培养液;模型组每孔加入含有1000μmol/L H2O2的培养液 100 μL,阳性对照组每孔加入含有 1000μmol/L H2O2及20μmol/L维生素 E的培养液 100 μL;加药组每孔加入含有1000μmol/L H2O2及 1,10,20μmol/L 受试化合物的培养液100 μL,作用PC12细胞6 h后用酶标仪检测490 nm波长处每孔吸光度值,计算LDH释放率。LDH释放率(%)=上清液LDH/(上清液LDH+裂解液LDH)×100%。每个质量浓度平行3孔,试验重复3次。数据采用SPSS 13.0统计软件进行分析。结果见表1。结果显示,与阳性对照组比较,化合物6a,6b,6c都具有明显的抗氧化作用;与灯盏乙素对照组比较,化合物6c的抗氧化活性更高。
3 讨论
研究中,以灯盏乙素苷元为原料,通过其与二氯二苯甲烷经缩合反应,制备6,7-二苯缩酮缩酮保护灯盏乙素苷元;对氯甲基苯甲酸与取代胺在无水乙醇条件下回流反应24 h,经后处理、纯化得N,N-取代氨甲基苯甲酸;以6,7-二苯缩酮缩酮保护灯盏乙素苷元与N,N-取代氨甲基苯甲酸为反应原料,在通用缩合剂N,N'-二环己基碳酰亚胺(DCC)/二甲基吡啶(DMAP)作用下缩合后,经乙酰氯/甲醇体系脱保护基,获得目标化合物,经1H-NMR、ESIMS检测,表明合成的化合物与目标产物结构一致;通过对H2O2诱导损伤PC12细胞的保护作用如四甲基偶氮唑盐比色法、乳酸脱氢酶释放率的测定,以维生素E、灯盏乙素以及灯盏乙素苷元作为对照评价设计化合物抗氧化活性。
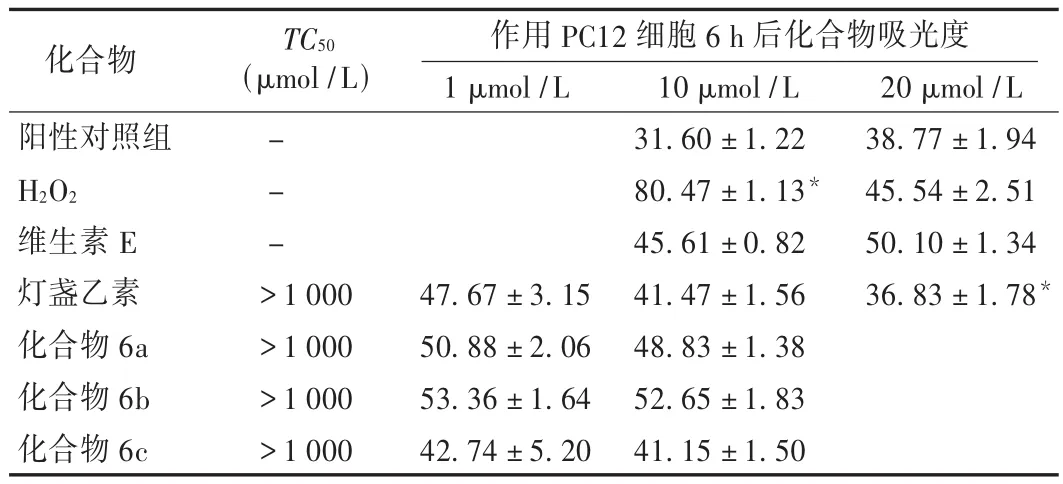
表1 化合物药理活性研究结果
N-取代氨甲基苯甲酸制备过程中,采用了文献[7]报道的合成方法,即4-氯甲基苯甲酸与取代胺在无水乙醇条件下缩合后,体系蒸干后加入4 mol/L NaOH溶液溶解、乙醚萃取除去杂质,水层调酸至产物析出后重结晶,但从试验结果来看目标化合物N-取代氨甲基苯甲酸收率极低(<5%),而主要得到4-羟甲基苯甲酸。经过改进后我们将反应体系蒸干溶剂、加水溶解、水层用乙醚洗涤,后用浓盐酸调pH至4~5,至沉淀析出后抽滤,水洗滤饼,剩余固体用热异丙醇超声提取,提取液蒸除溶剂后,残余物采用氯仿 ∶甲醇 ∶乙酸(15∶1∶0.5,v/v)为洗脱剂,经硅胶柱层析分离纯化,获得目标产物N-取代氨甲基苯甲酸,收率为30~82%。对新化合物的体外活性,采用了经典的过氧化氢诱导PC12细胞损伤模型,遴选出具有明显活性的新化合物。笔者认为,该化合物的药效学、药代动力学值得进一步深入研究。
[1]Olanow CW.A radical hypothesis for neurodegeneration[J].Trends Neurosci,1993,16(11):439.
[2]Bennett S,Grant MM,Aldreda S.Oxidative stress in vascular dementia and Alzheimer's disease:a common pathology[J].J Alzheimers Dis,2009,17(2):245.
[3]Hong H,Liu GQ.Protection against hydrogen peroxide-induced cytotoxicity in PC12 cells by scutellarin[J].Life Sci,2004,74(24):2959.
[4]葛庆华,周 臻,支晓瑾,等.灯盏花素药物动力学研究进展[J].中国医药工业杂志,2003,34(12):618.
[5]Chen X,Cui L,Duan X,et al.Pharmacokinetics and metabolism of the flavonoid scutellarin in humans after a single oral administration[J].Drug Metab Dispos,2006,34(8):1345.
[6]车庆明,潘丽怡,陈 颖,等.灯盏花乙素苷元的药动学研究[J].中国药学杂志,2007,42(18):1418.
[7]Lombardino JG.[4-Substituted benzoyloxy]-N-substituted2H-1,2benzothiazine-3-carboxamide1,1-dioxdes having antiarthritic activity[J].U.S.Patent,4,623,486(1986).
