耐亚胺培南铜绿假单胞菌的临床分离及耐药机制分析
2011-07-27麦丽文余治健邓启文
廉 婕 ,麦丽文 ,余治健 ,邓启文 *
1.广东医学院附属南山医院中心实验室,广东深圳 518052;2.广东医学院附属南山医院感染科,广东深圳 518052
铜绿假单胞菌(pseudomonas aeruginosa,PAE)是引起医院感染的最常见条件致病菌之一,对多种抗生素天然或获得性耐药,一直是临床关注的焦点。亚胺培南等碳青霉烯类抗生素由于抗菌谱广、抗菌活性强,已成为目前治疗多重耐药铜绿假单胞菌最有效的抗生素。但随着该类抗生素临床应用的逐渐增多,出现了大量的耐亚胺培南菌株(imipenem-resistant pseudomonas aeruginosa,IRPA),给临床治疗带来了极大困难。因此,加强对IRPA的研究,为临床有效控制其感染提供科学依据显得尤为重要。为了解深圳地区IRPA的耐药情况和耐药机制,作者收集了广东医学院附属南山医院2009年1月~2010年12月住院患者临床标本中分离的IRPA进行分析,现报道如下:
1 材料与方法
1.1 材料
1.1.1 菌株来源与质控菌株 404株铜绿假单胞菌分离于我院2009年1月~2010年12月住院部各科患者的各类临床标本(包括痰液、尿液、伤口分泌物、脓液、血液等),同一患者的同一部位连续分离的多株铜绿假单胞菌以1株计算。金属酶IMP基因阳性菌株PA987由广州医学院附属第一医院卓超教授提供。质控菌株为铜绿假单胞菌ATCC 27853,大肠埃希菌ATCC 25922,购自卫生部临床检验中心。
1.1.2 PCR引物设计 参考文献[1]设计MBL基因型IMP、VIM、GIM、SPM以及通道蛋白基因oprD2的扩增引物,由上海生物工程有限公司合成,引物序列和目的产物长度详见表1。

表1 耐药基因PCR引物序列
1.2 方法
1.2.1 细菌培养及分离 临床送检的各类标本严格按照《全国临床检验操作规程》进行细菌的分离培养。分纯后的铜绿假单胞菌用小牛血清保存至-80℃冰箱待用。
1.2.2 菌株鉴定及药敏试验方法 所有菌株均以BD Phoenix100全自动微生物分析仪鉴定到种,必要时采用梅里埃ATBExpression半自动细菌分析仪补充鉴定。药敏试验采用BD Phoenix 100革兰阴性细菌配套药敏试验复合板,包括阿米卡星、阿莫西林/克拉维斯、氨苄西林、氨苄西林/舒巴坦、氨曲南、头孢唑啉、头孢吡肟、头孢噻肟、头孢他啶、氯霉素、环丙沙星、庆大霉素、亚胺培南、美洛培南、左氧氟沙星、哌拉西林、哌拉西林/他唑巴坦、四环素、复方磺胺、多粘菌素E,共20种抗菌药物。
1.2.3 基因扩增 采用煮沸法提取模板DNA,oprD2基因扩增条件为:95℃预变性 3 min,然后 95℃ 30 s→55℃ 30 s→72℃60 s,循环35个周期,最后72℃延长5 min;其余基因扩增条件为:95℃预变性 3 min, 然后 95℃ 60 s→55℃ 60 s→72℃60 s,循环35个周期,最后 72℃延长5 min。取PCR产物4 μg经1%琼脂糖凝胶电泳,EB染色后在凝胶成像系统中观察结果。
1.2.4 PCR产物测序 使用DNA凝胶回收纯化试剂盒(购自TaKaRa)将PCR产物割胶纯化,送至深圳华大基因测序,序列登录GenBank进行比对分析。
2 结果
2.1 IRPA的分离率
从404株铜绿假单胞菌中检出IRPA 100株,分离率为24.75%。其中大多数分离自痰液标本90株,占90.0%,其次为血液和脓液标本,均为3株,各占3.0%,分离自伤口分泌物和胆汁标本均为2株,各占2.0%。
2.2 IRPA感染者科室分布
IRPA感染者主要来自重症医学科,占31.0%,其次为呼吸内科和神经内科,分别为20.0%和16.0%,具体科室分布情况见表2。
2.3 IRPA对抗菌药物的耐药性
100株亚胺培南耐药的铜绿假单胞菌,对阿米卡星的耐药率最低,为27.0%,耐药率在30.0%~50.0%的有4种抗菌药物:头孢他啶、庆大霉素、哌拉西林、哌拉西林/他唑巴坦;耐药率在50.0%~70.0%的有4种抗菌药物:氨曲南、环丙沙星、左氧氟沙星、头孢吡肟;对其余10种抗菌药物的耐药率均>70.0%,其中,氨苄西林、氨苄西林/舒巴坦、头孢唑啉和氯霉素的耐药率为100%。具体耐药情况见表3。

表2 耐亚胺培南铜绿假单胞菌的科室分布情况
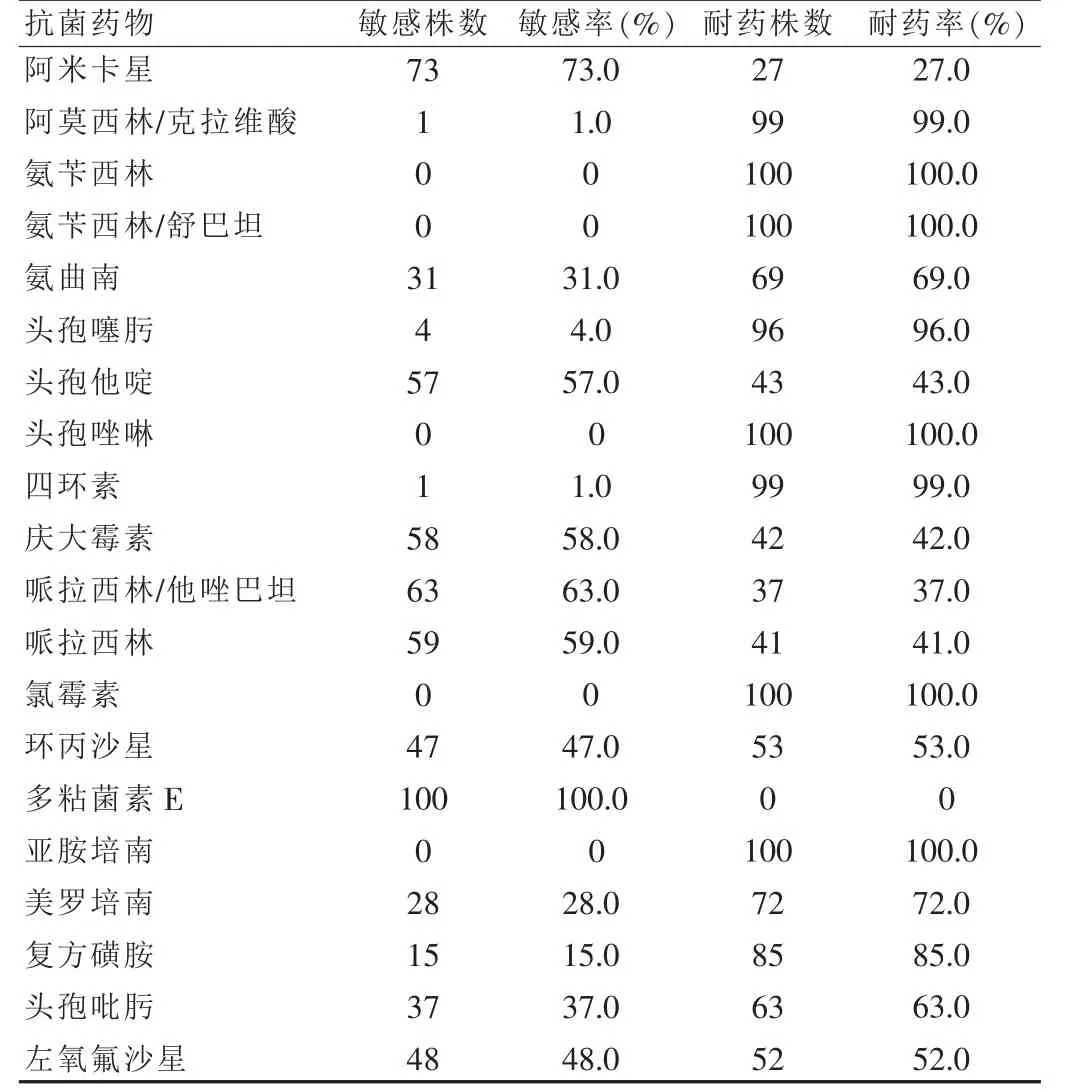
表3 耐亚胺培南铜绿假单胞菌的耐药情况
2.4 MBL基因及oprD2基因检测结果
100株IRPA中,检测到IMP基因阳性1株(PA47),阳性率为1.0%,oprD2基因缺失65株(PA47为扩增阳性菌株),阳性率为65.0%,其余耐药基因(VIM、GIM、SPM)均未检出。
2.5 IMP基因测序结果
通过对PA47菌株的IMP基因PCR产物进行正向测序,经Clustal W程序分析,其核酸序列与GenBank已登陆的blaIMP-9序列(登录号:AY033653)的同源性为100%,可判定为IMP-9型基因。PA47_blaIMP在GenBank的登录号为JN107561。
3 讨论
近年来,由于化疗、放疗、免疫抑制剂及各类侵入性诊疗项目在临床的广泛开展,非发酵类病原菌引起的医院感染逐渐增多,其中铜绿假单胞菌分离量占首位(45.4%)[2]。碳青霉烯类抗生素(亚胺培南、美罗培南等)具有抗菌谱广、抗菌活性强、对β-内酰胺酶稳定性高等优点,已成为治疗IRPA感染最有效的抗生素[3]。然而,随着该类抗生素在临床治疗中的广泛应用,铜绿假单胞菌对它的耐药率也呈不断上升的趋势,中国CHINET细菌耐药性监测报道,1994~2001年中,铜绿假单胞菌对亚胺培南的耐药率由1994年的8.5%上升到2009 年的 30.5%[4-5]。
我院分离的铜绿假单胞菌对亚胺培南耐药率为24.75%(100/404),90.0%的菌株从痰液中分离得到,表明耐亚胺培南的铜绿假单胞菌多引起呼吸道感染,是医院获得性肺炎的首位病因,这和国内外诸多相关报道一致[6-8]。
在科室分布方面,我院耐亚胺培南铜绿假单胞菌多来自ICU(31.0%),这可能与患者多为急重症或昏迷阶段,免疫力低、病程和住院时间长、有手术史以及较频繁地大量使用广谱抗菌药物,造成菌群失调,易继发感染铜绿假单胞菌,且长时间在药物选择性压力下,耐药性菌株成为优势菌群,因此,这些科室分离的耐亚胺培南铜绿假单胞菌亦多为多重耐药菌株。
药敏实验结果显示(表3),100株IRPA中,对阿米卡星的敏感性最好(73.0%),其次是哌拉西林/他唑巴坦(63.0%)、哌拉西林(59.0%)、庆大霉素(58.0%)、头孢他啶(57.0%),其余药物的敏感率均<50.0%。100株IRPA对氨苄西林、氨苄西林/舒巴坦、头孢唑啉、氯霉素全部耐药。同处广东地区,我院IRPA对氨基糖苷类和喹诺酮类抗生素的耐药率均<53.0%,而姚芬等[7]报道的耐药率达到95%以上,这可能跟不同医院临床用药习惯不同有关。由此可见,重视和加强细菌耐药监测,优先选用低耐药可能性的抗生素,合理应用广谱抗生素,将有助于避免IRPA引起医院感染流行。
铜绿假单胞菌对碳青霉烯类抗生素的耐药机制包括β-内酰胺酶的产生、外膜通透性的降低和主动外排系统的表达。金属酶(metallo-β-lactamases,MBL)是一类能够水解包括碳青酶烯类在内的所有β-内酰胺类药物的β-内酰胺酶,主要通过基因盒,整合子和转座子的形式传播。MBL包括四种类型:IMP型金属酶,已报道的超过19种;VIM型金属酶,已超过11种;SPM-1型金属酶和GIM-1型金属酶。MBL编码基因多位于整合子上,其中以IMP型和VIM型 最为常见[1]。从实验结果看,2009年1月~2010年12月收集的耐亚胺培南的铜绿假单胞菌中仅发现1株产IMP型金属酶菌株,提示产IMP型金属酶是抗菌后效应(PAE)对IMP耐药的机制之一。另外,我院检出的IMP型金属酶经分析为IMP-9型,具有该类型金属酶的铜绿假单胞菌曾在2000年于广州地区三家医院爆发流行[9],需引起我院医院感染管理科的高度重视。
在β-内酰胺类抗生素抑菌过程中,首先必须穿透铜绿假单胞菌的外膜进入周浆间隙才能起作用,oprD2蛋白是目前所知的PAE外膜中唯一有助于抗生素通过的孔道蛋白,具有配体特异性,能形成亚胺培南的特异结合位点。一旦oprD2蛋白缺失,PAE对亚胺培南的MIC由1~2 mg/L上升至8~32 mg/L,而对其他β-内酰胺类抗菌药物影响并不大,所以碳青酶烯类抗菌药物与其他β-内酰胺类抗菌药物无交叉耐药性。一般认为,oprD2孔道蛋白的缺失是PAE对亚胺培南耐药的主要机制[10],本实验中65%的IRPA未扩增出oprD2基因,表明大多数菌株存在oprD2基因突变,导致oprD2表达减少或不表达,这可能是我院临床分离铜绿假单胞菌对亚胺培南耐药的主要机制。
总之,IRPA对临床常用抗生素耐药情况非常严峻,PAE对亚胺培南耐药机制复杂,产酶、孔道蛋白oprD2基因缺失以及外排泵出机制三者可单独或同时存在。应加强临床细菌耐药性的发生和发展的监控,尽量获得细菌学证据,并根据细菌的体外药物敏感结果联合选用抗生素。另外,未来这类产酶铜绿假单胞菌可能会引起医院感染的暴发和流行,必须加强耐药监测。
[1]颜英俊,糜祖煌,刘华,等.耐亚胺培南铜绿假单胞菌耐药特征及其耐药机制的研究[J].中华医院感染学杂志,2007,17(6):627-630.
[2]胡云建.Mohnarin 2006-2007年度报告:非发酵革兰阴性杆菌耐药性监测[J].中国抗生素杂志,2008,33(10):597-601.
[3]Poirel L,Naas T,Nicolas D,et al.Characterization of VIM2,a Carbapenem-hydrolyzing metallo-β-lactamase and its plasmid and integron-borne gene from a Pseudomonas aeruginosa clinical isolate in France[J].Antimicrob Agents Chemother,2000,44(4):891-897.
[4]王辉,陈民钧.1994-2001年中国重症监护病房非发酵糖细菌的耐药变迁[J].中华医学杂志,2003,83(5):385-390.
[5]汪复,朱德妹,胡付品,等.2009年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2010,10(5):325-334.
[6]Jarvis WR,Martone WJ.Predominant pathogens in hospital infections[J].J Antimicrob Chemother,1992,29(suppl A):19-24.
[7]姚芬,王佩芬,彭青,等.汕头地区耐亚胺培南铜绿假单胞菌耐药分析[J].四川生理科学杂志,2009,31(1):61.
[8]徐洪伟,多丽波,张联博,等.院内感染亚胺培南耐药的铜绿假单胞菌的分布及耐药性分析[J].中国卫生检验杂志,2010,20(5):1137-1138.
[9]Zhuo C,Wu XF,Su DH.Outbreak of Pseudomonas aeruginosa producing IMP-9-type metallo-β-lactamase in Guangzhou,china[J].International Journal of Antimicrobial Agents,2008,32:363-371.
[10]时东彦,魏宏莲.5年间耐亚胺培南铜绿假单胞菌耐药性监测及耐药机制探讨[J].中华医院感染学杂志,2010,20(12):1654-1656.
