长期饮酒对大鼠内外源性肺损伤时还原性谷胱甘肽、超氧化物歧化酶和丙二醛的影响
2011-07-27刘义德
刘义德 ,刘 志
1.沈阳急救中心急诊科,辽宁沈阳 110006;2.中国医科大学附属第一医院急诊科,辽宁沈阳 110001
急性肺损伤 (acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是指由心源性以外的各种肺内、外致病因素导致的急性进行性呼吸衰竭,临床表现为呼吸窘迫和顽固性低氧血症。引起ALI/ARDS的原因很多,可以分为内源性因素(严重肺炎等)和外源性因素(胰腺炎、休克等)[1]。国内外研究发现,肺内因素和肺外因素引起的ALI在发病机制、临床表现和治疗效果上有所不同。近年来,在临床治疗观察中人们发现,长期饮酒能明显增加危重患者ALI/ARDS发病率及病情严重程度[2],但其发生机制仍未明确。新近研究表明,可能与肺组织氧化及抗氧化机制有关[3]。为明确长期饮酒对肺内、外源性因素引起肺损伤的发病机制是否存在差异,本研究在建立长期饮酒大鼠模型后,分别给予气管内注入和腹腔内注射大肠杆菌脂多糖(LPS)建立内、外源因素引起的肺损伤模型,观察肺、肝组织还原性谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonaldehyde,MDA)的变化,探讨在长期饮酒情况下两种原因引起的肺损伤是否存在差异,为临床治疗提供理论和实践依据。
1 材料与方法
1.1 实验动物
选择雄性SD大鼠36只,体重210~250 g,均由中国医科大学实验动物部提供;饲养环境温度为(23±2)℃,日照时间为12 h/d;分6笼饲养,每笼6只。各大鼠间基本情况比较,差异无统计学意义(P>0.05),具有可比性。
1.2 试剂和仪器
试剂:LPS购自Sigma公司,GSH检测试剂盒、SOD检测试剂盒、MDA检测试剂盒均购自南京建成生物工程研究所。仪器:血气分析仪(AVL公司,瑞士),低温高速离心机(日立公司,日本),紫外分光光度计(上海第三分析仪器厂,中国),电子天平仪,恒温水浴箱,电动匀浆器。
1.3 实验方法
1.3.1 大鼠长期饮酒模型建立 将大鼠随机分为饮水组和饮酒组,每组18只。按照文献[4]中方法,建立大鼠长期饮酒模型,先将大鼠适应喂养3 d,然后将6%酒精替代饮水给予饮酒组大鼠饮用3 d,再换成10%酒精饮用4 d,以后给予20%酒精连续饮用5周。饮水组大鼠自由饮水,两组饲料均为清洁级全营养颗粒饲料。
1.3.2 内、外源性肺损伤模型建立 饮酒模型建立6周后,将饮水组和饮酒组大鼠各随机分成3组,分别为单纯饮水组6只,饮水内源性肺损伤组6只,饮水外源性肺损伤组6只;单纯饮酒组6只,饮酒内源性肺损伤组6只,饮酒外源性肺损伤组6只。内源性肺损伤组大鼠经称重后予以1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉后,经颈正中切口分离气管,用7号针头刺入气管缓慢滴入LPS(15 mg/kg)建立内源性肺损伤模型。外源性肺损伤大鼠予以LPS(15 mg/kg)腹腔注射建立外源性肺损伤模型。
1.3.3 标本采集 肺损伤模型建立4 h后,给予1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,打开腹腔,经腹主动脉取血测PaO2值,经下腔静脉抽血 4 ml,4℃3000 r/min离心10 min取上清,冻存-80℃冰箱。随后放血处死大鼠,打开腹腔将双肺完整取出,用冰盐水仔细漂洗,清除血迹,干纱布拭干,置于冰块上。取右肺上叶组织测定湿重后,放入80℃烤箱烘烤48 h后称量干重,计算肺组织湿干比(W/D)值,将剩余右肺组织放入-80℃冰箱冻存待检。用自制灌洗针将3 ml冰盐水注入左肺组织进行肺泡灌洗,反复3次,收集灌洗液,1000 r/min离心5 min,取上清,存于-80℃冰箱待检。
1.3.4 肺、肝组织还原性谷胱甘肽、超氧化物歧化酶及丙二醛含量测定 取冻存的肺、肝组织称重后剪碎,按 1∶9(mg∶ml)比例加入4℃生理盐水,用电动匀浆器匀浆后,3000 r/min离心15 min,取上清液,保存于-20℃冰箱中。 GSH、SOD、MDA 检测方法按照试剂说明书进行。
1.4 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,各组均数比较采用单因素方差分析(ANOVA),采用最小显著差法(1east significant difference,LSD)作两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠氧分压及肺湿干比变化
单纯饮酒组与单纯饮水组PaO2比较差异无统计学意义(P>0.05),肺损伤各组PaO2水平均明显低于单纯饮水组(P<0.05);饮酒内、外源性肺损伤组PaO2水平降低程度比饮水内、外源性肺损伤组更显著(P<0.05),且内源性肺损伤组PaO2水平下降较外源性肺损伤组明显(P<0.05)。单纯饮水组与单纯饮酒组间肺W/D值差异无统计学意义(P>0.05),肺损伤各组相对于单纯饮水组W/D值均明显增高(P<0.05);饮酒肺损伤组W/D值较饮水肺损伤对应组W/D值升高更加明显 (P<0.05),饮酒组中内、外源性肺损伤的W/D值差异无统计学意义(P>0.05)。 见表 1。
2.2 各组大鼠肝组织中还原性谷胱甘肽及丙二醛含量变化
单纯饮酒组与单纯饮水组比较,肝组织中GSH含量下降(P<0.05),MDA 含量上升(P<0.05);肺损伤各组较单纯饮水组,GSH含量均下降,MDA含量均上升(P<0.05);饮酒肺损伤组与饮水肺损伤对应组比较,GSH及MDA变化程度更加显著 (P<0.05),且外源性肺损伤组较内源性肺损伤组变化更加明显(P<0.05)。见表2。
表1 各组间大鼠氧分压及肺湿干比变化情况()

表1 各组间大鼠氧分压及肺湿干比变化情况()
注:与单纯饮水组比较,*P<0.05;与饮水内源性肺损伤组比较,△P<0.05;与饮酒外源性肺损伤组比较,☆P<0.05;1 mm Hg=0.133 kPa
组别 只数单纯饮水组饮水内源性肺损伤组饮水外源性肺损伤组单纯饮酒组饮酒内源性肺损伤组饮酒外源性肺损伤组666666 PaO2(mm Hg)102.00±11.9768.00±5.72*75.00±4.41*△☆99.00±9.1859.00±6.22*△☆68.00±5.29*W/D值4.31±0.195.52±0.25*5.27±0.23*☆4.39±0.166.47±0.14*△6.26±0.10*
表2 各组大鼠肝组织中还原性谷胱甘肽及丙二醛含量变化()
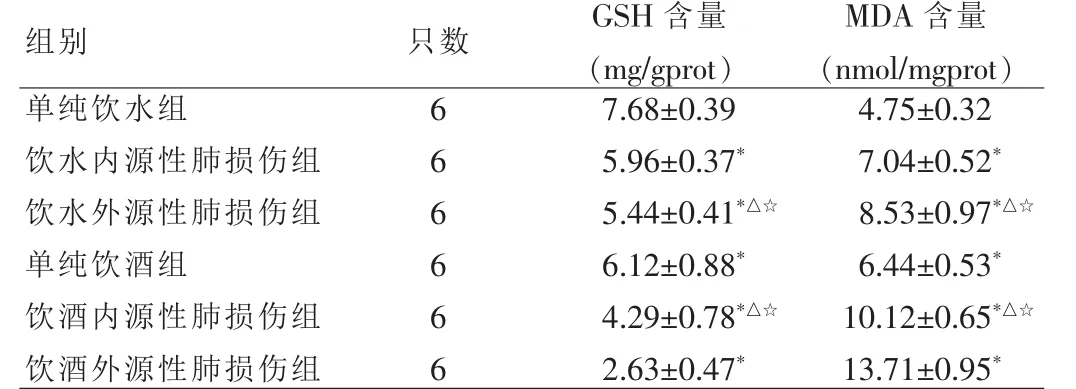
表2 各组大鼠肝组织中还原性谷胱甘肽及丙二醛含量变化()
注:与单纯饮水组比较,*P<0.05;与饮水内源性肺损伤组比较,△P<0.05;与饮酒外源性肺损伤组比较,☆P<0.05
组别 只数单纯饮水组饮水内源性肺损伤组饮水外源性肺损伤组单纯饮酒组饮酒内源性肺损伤组饮酒外源性肺损伤组666666 GSH含量(mg/gprot)7.68±0.395.96±0.37*5.44±0.41*△☆6.12±0.88*4.29±0.78*△☆2.63±0.47*MDA含量(nmol/mgprot)4.75±0.327.04±0.52*8.53±0.97*△☆6.44±0.53*10.12±0.65*△☆13.71±0.95*
2.3 各组大鼠肺组织中还原性谷胱甘肽、超氧化物歧化酶及丙二醛含量变化
单纯饮酒组大鼠肺组织GSH、SOD含量较单纯饮水组下降(P<0.05),MDA 含量升高(P<0.05),内、外源性肺损伤组GSH、SOD含量较单纯饮水组下降,MDA含量升高(P<0.05);饮酒肺损伤各组较饮水肺损伤对应组改变更显著(P<0.05),外源性肺损伤组较内源性肺损伤组GSH、MDA含量变化更明显(P<0.05),但SOD变化差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠肺组织中还原性谷胱甘肽、超氧化物歧化酶及丙二醛含量变化()

表3 各组大鼠肺组织中还原性谷胱甘肽、超氧化物歧化酶及丙二醛含量变化()
注:与单纯与饮水组比较,*P<0.05;与饮水内源性肺损伤组比较,△P<0.05;与饮酒外源性肺损伤组比较,☆P<0.05
组别 只数单纯饮水组饮水内源性肺损伤组饮水外源性肺损伤组单纯饮酒组饮酒内源性肺损伤组饮酒外源性肺损伤组666666 SOD含量(U/mgprot)91.23±2.4980.13±7.46*74.37±2.87*☆84.49±5.02*68.76±9.43*△68.41±5.04*GSH含量(mg/gprot)1.90±0.191.61±0.18*1.38±0.18*☆△1.62±0.21*1.32±0.19*☆△1.05±0.19*MDA含量(nmol/mgprot)1.49±0.132.19±0.18*3.76±0.18*☆△1.82±0.17*3.50±0.36*☆△5.76±0.63*
3 讨论
1996年,Moss等[2]在临床中对351例危重患者进行观察时发现,长期饮酒明显增加ARDS的易感性及疾病严重程度。此后人们开始关注饮酒与ARDS之间的关系。目前研究显示,可能有多种机制参与ARDS的发生,其中,氧化应激反应占重要地位。ARDS根据病因不同,分为内源性ARDS(ARDSP)和外源性 ARDS(ARDSexp),而长期饮酒对内、外源性肺损伤时的氧化应激反应是否存在差异的研究尚未见报道。本研究建立了长期饮酒后内、外源性肺损伤的动物模型,以观察其抗氧化物质的改变是否存在差异。
目前研究认为,机体主要抗氧化物质有两大类:低分子自由基清除剂(GSH)和酶性清除剂(SOD)。正常生理状态下,氧自由基的产生与清除维持动态平衡。当机体受到刺激时,如感染、炎症、组织缺氧、缺血等病理情况时,氧自由基产生过多而清除剂活力下降则会导致细胞的广泛损伤。MDA是氧自由基攻击生物膜中不饱和脂肪酸所形成的脂质过氧化产物,其含量的多少能反映组织或细胞脂质被氧化的程度。
本研究结果显示,单纯饮酒组大鼠肝脏GSH含量下降,MDA含量上升,证明了长期饮酒会导致肝脏氧化还原系统失衡,肝细胞受到损伤。同时,肝脏是机体各类物质代谢的主要场所,机体的GSH主要由肝脏产生,GSH通过参与中和氧自由基、减少自由基对生物膜及DNA的攻击、抗脂质过氧化损伤及解毒等作用而对机体发挥保护作用。GSH对肺脏也有非常重要的保护作用,可拮抗氧自由基引起的肺泡上皮细胞损伤[5],并促使肺内脂质过氧化物分解为无毒的代谢产物,使肺脏氧化及抗氧化系统保持动态平衡[6]。肺脏中的GSH主要来源于肝脏,因此,当肝脏功能受损,GSH含量下降时,也会相应导致肺脏GSH含量下降,从而影响到肺组织氧化还原系统,引起系统失衡。本研究结果显示,饮酒组大鼠肺组织GSH、SOD含量均下降,MDA含量升高,并且肺脏的GSH、MDA变化同肝脏GSH、MDA含量变化一致。原因可能由于肺组织的GSH、SOD含量下降,使其清除氧自由基的能力明显下降,引起脂质过氧化,产生MDA,氧化还原系统失衡,导致肺泡巨噬细胞功能损伤,增加肺损伤的易感性[7]。
从本研究结果中可以看到,当给予LPS形成大鼠肺损伤后,饮水大鼠肺损伤各组MDA含量均较未损伤组明显升高,而GSH及SOD含量均明显下降。表明在肺损伤时,大鼠的肺组织抗氧化物质减少,过氧化物产生增多。同时饮酒肺损伤各组无论在PaO2、肺W/D值,还是氧化还原指标的改变与饮水损伤各组相比均更加显著。本研究也发现,外源性肺损伤时肝、肺组织的氧化还原指标改变程度更显著于内源性肺损伤。分析其机制可能因为肝脏具有清除LPS功能[8],长期饮酒产生的乙醛等代谢产物通过氧化作用使肝细胞已经受损,肝脏清除LPS功能下降,当给予LPS时,肝脏细胞因子生成增加,进一步加重肝细胞损伤,形成“二次打击”[9],使肝脏抗氧化能力下降更加明显,同时长期饮酒已使肺脏抗氧化物质含量下降,两种因素共同作用,形成恶性循环,使肺损伤加重。当长期饮酒后出现外源性肺损伤时,LPS由肺外途径进入机体内,激活炎性介质,发生全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),在此过程中肝脏作为主要的解毒和抗炎器官,受到 “二次打击”重,抗氧化物质GSH生成下降明显,MDA含量上升,相应的肺脏氧化还原指标改变也更明显。肺脏氧化还原指标的改变是全身氧化及抗氧化系统失衡的一部分。而内源性肺损伤则主要累及肺泡上皮,并促使肺泡巨噬细胞和炎症反应链的激活,导致肺内炎症[10],为局部氧化应激反应,在此过程中肝脏相比外源性肺损伤时受到的“二次打击”程度轻,引起的全身氧化应激反应小,因此,肺脏氧化还原指标改变程度轻于外源性肺损伤。
综上所述,长期饮酒可引起肺组织抗氧化物质含量下降,抗氧化能力减弱,脂质过氧化增加,增加了ALI的易感性和病情严重程度,并且对外源性肺损伤影响显著高于内源性肺损伤。这一结果为今后治疗不同诱因引起的ARDS提供了新的思路。
[1]Gattinoni L,Pelosi P,Suter PM,et al.Acute respiratory distress syndrome caused by pulmonary and extra pulmonary disease.Different syndromes[J].Am J Respir Crit Care Med,1998,158(1):3-11.
[2]Moss M,Bucher B,Moore FA,et al.The role of chronic alcohol abuse in the development of acute respiratory distress syndrome in adults[J].JAMA,1996,275(1):50-54.
[3]Guidot DM,Brown LAS.Mitochondrial glutathione replacement restores surfactant synthesis and secretion in alveolar epithelial cells of ethanolfed rats[J].Alcohol Clin Exp Res,2000,24(7):1070-1076.
[4]Holguin F,Moss I,Brown LA,et al.Chronic ethanol ingestion impairs alveolar typeⅡcell glutathione homeostasis and function and predispose to endotoxin-mediated acute edematous lung injury in rats[J].J Clin Invest,1998,101(4):761-768.
[5]Kelly FJ.Gluthathione:in defence of the lung [J].Food Chem Toxicol,1999,37(10):963-966.
[6]Salvatore C,Emanuela M,Laura D,et al.Protective effects of N-acetycysteine on lung injury and red blood cell modification induced by carrageenan in the rat[J].Paseb J,2001,15(7):1187-1200.
[7]Brown LA,Ping XD,Harris FL,et al.Glutathione availability modulates alveolarmacrophagefunctioninthechronicethanol-fedrat[J].AmJPhysiol Lung Cell Mol Physiol,2007,292(4):824-832.
[8]SU GL.Lipopolysaccharides in liver injury:molecular mechanisms of kupffer cell activation[J].Am J Physiol Gastrointest Liver Physiol,2002,283(2):256-265.
[9]Ma KL,Ruan XZ,Powis SH,et al.Inflammatory stress exacerbates lipid accumulation in hepatic cells and fatty livers of apolipoprotein E knockout mice[J].Hepatology,2008,48(3):770-781.
[10]Muller LC,Klosterhalfen B,Hauptmann S.Computed tomography and histologic results in the early stages of endotoxin injury lungs as a model for adult respiratory distress syndrome[J].Invest Radio,1993,28(1):39-45.
