微生物细胞脂肪酸的组成分析
2011-07-26柳志杰
柳志杰,章 辉,周 利,花 强
(华东理工大学 生物反应器工程国家重点实验室,上海 200237)
微生物油脂又称单细胞油脂,是微生物在一定条件下产生并储存于菌体内的甘油脂,其脂肪酸组成以C16、C18系脂肪酸(如硬脂酸、油酸和亚油酸)为主。将微生物油脂进行酯化反应,可以获得生物燃料[1,2]。脂肪酸含量及组成可以作为微生物分类鉴定的指标[3~5],相对于抗原检测和杂交,具有不需要探针的优势;在代谢组学研究中,微生物细胞脂肪酸组成及含量的动态变化可以反映细胞的代谢状态[6]。因此,微生物脂肪酸组成及含量分析具有重要的意义。
文献报道细胞内油脂总含量的分析方法有苏丹黑B染色法[7]、磷酸香草醛法[8]以及尼罗红染色法[9],但这些方法均无法分析细胞油脂脂肪酸的组成。而气相色谱-质谱联用技术(GC-MS)[10]可以直接通过图库检索得到样品的信息,不需要再通过标样比对进行样品的确认,分析方便,具有普遍的应用意义。因此,作者在此采用GC-MS法,对油脂酵母皮状丝孢酵母的油脂分布以及脂肪酸组成进行分析,拟为微生物细胞脂肪酸的分析应用提供新途径。
1 实验
1.1 菌株与试剂
油脂酵母皮状丝孢酵母(Trichosporoncutaneum),自行保藏。
三氟化硼溶液、癸酸(C10:0),Sigma公司;其它试剂均为分析纯。
1.2 培养基
合成培养基(g·L-1):葡萄糖12.0,(NH4)2SO40.4,KH2PO43.0,MgSO4·7H2O 0.5,L-组氨酸0.03,L-亮氨酸0.125,L-蛋氨酸0.025,尿嘧啶0.04,微量元素溶液1 mL,维生素溶液1 mL。
微量元素溶液(g·L-1):EDTA 15.0,ZnSO4·7H2O 4.5,CoCl2·6H2O 0.3,MnCl2·4H2O 1.0,CuSO4·5H2O 0.3,CaCl2·2H2O 4.5,FeSO4·7H2O 3.0,NaMoO4·2H2O 0.4,H3BO31.0,KI 0.1。
维生素溶液(g·L-1):D-生物素0.05,泛酸钙1.0,烟酸1.0,维生素B11.0,维生素B61.0,对氨基苯甲酸0.2,肌醇25。
1.3 培养条件
将对数生长中期的种子液接种到装有0.8 L培养基的1.5 L发酵罐中,于30 ℃、480 r·min-1培养,通气量1.5 vvm。发酵过程中的溶氧、pH值、尾气等数据全部使用Biostar软件进行在线采集。
1.4 微生物细胞油脂的提取[11]及脂肪酸组成分析
采用酸热-有机溶剂萃取法提取微生物细胞油脂:离心收集菌体;向菌体中加入适量4 mol·L-1HCl溶液,浸泡30 min,煮沸10 min;置于冰上速冷,孵育;加入4 BV的甲醇-氯仿(1∶2,体积比)溶液,混合,封口,置于摇床中于180 r·min-1萃取30 min;12 000 g离心5 min,取下层有机层;重复萃取1次;将所收集的有机溶剂过滤,旋转蒸发去除有机溶剂,称重。
将油脂溶解于3 mL 0.5 mol·L-1氢氧化钾-甲醇溶液,75 ℃水浴20 min;加入3 mL 14%三氟化硼溶液,75 ℃水浴20 min;加1 mL饱和氯化钠溶液,再加入适量癸酸作为内标,离心取上清,在氮气下吹干,用正己烷定容;过滤,用GC-MS法分析脂肪酸组成。
GC-MS分析条件:采用Agilent 6890-5975型气质联用仪。气相色谱柱:HP-5MS (30 m×0.25 mm,0.25 μm);升温程序:180 ℃保留2 min,以5 ℃·min-1升温至250 ℃;载气(氦气,纯度≥99.996%)流速1 mL·min-1;进样量0.2 μL;不分流进样;进样口温度250 ℃,离子源温度230 ℃;-70 eV轰击;质谱仪扫描范围70~560m/z;溶剂延迟1.5 min。
1.5 分析测试
(1)细胞干重的测定:取一定量发酵液于4 ℃、12 000 g离心10 min,用去离子水洗2次后置于85 ℃烘箱中烘至恒重,称重。
(2)葡萄糖浓度的测定:采用HPLC法。Agilent 1200型高效液相色谱仪,配示差折光分析检测器;色谱柱为Spherisorb NH2柱(0.46 cm× 25 cm,7 μm);流动相为乙腈-水(80∶20);流速1 mL·min-1;检测器温度 40 ℃,柱温40 ℃。
(3)氮源浓度的测定:采用苯酚-次氯酸钠法[12]。
2 结果与讨论
2.1 菌体生长及油脂积累情况(图1)
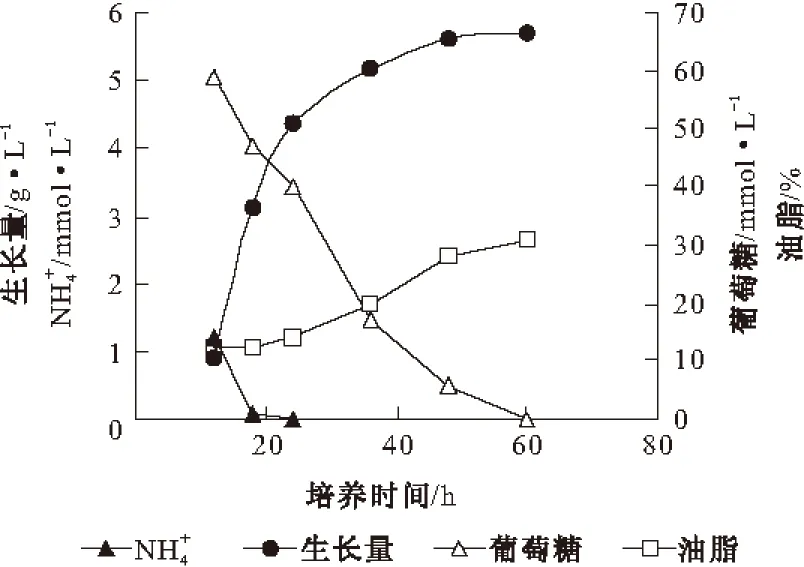
图1 皮状丝孢酵母菌体生长及油脂积累情况
由图1可以看出,皮状丝孢酵母的生长可以分为两个时期:菌体生长期和油脂积累期。0~24 h,菌体快速生长,细胞内油脂含量基本不变,为菌体生长期;24 h后,氮源消耗完,菌体生长变慢,细胞内油脂含量不断升高,60 h时,葡萄糖耗尽,油脂含量达到最大值31%,为油脂积累期。
2.2 菌体细胞油脂脂肪酸的组成分析
皮状丝孢酵母体内积累的油脂经酸热-有机溶剂萃取、甲酯化处理后进行GC-MS分析,得到的总离子流图见图2。
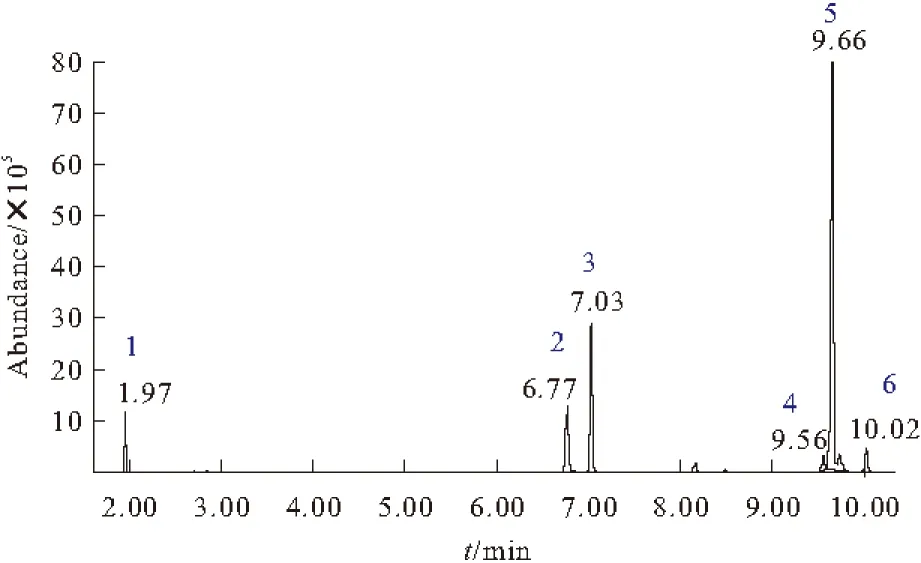
1.Decanoic acid,methyl ester(internal standard) 2.9-Hexadecanoic acid,methyl ester,(Z) 3.Hexadecanoic acid,methyl ester 4.9,12-Octadecadienoic acid (Z,Z)-,methyl ester 5.9-Octadecenoic acid (Z)-,methyl ester 6.Octadecanoic acid,methyl ester
由图2可以看出,脂肪酸甲酯得到了很好的分离。菌体细胞油脂脂肪酸组成主要为油酸(C18:1)、软脂酸(C16:0)、棕榈油酸(C16:1)、硬脂酸(C18:0)和亚油酸(C18:2)。
对皮状丝孢酵母油脂脂肪酸的积累及组成进行分析,结果见图3和图4。
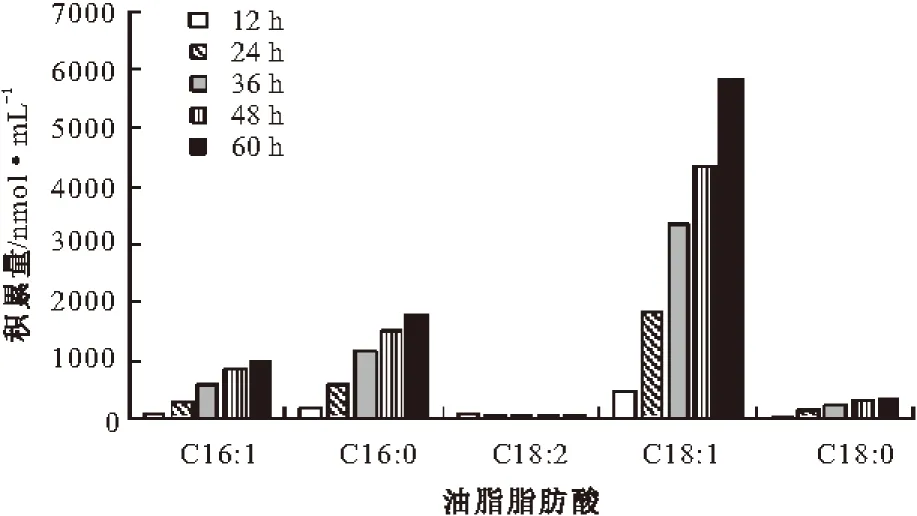
图3 皮状丝孢酵母油脂脂肪酸的积累情况
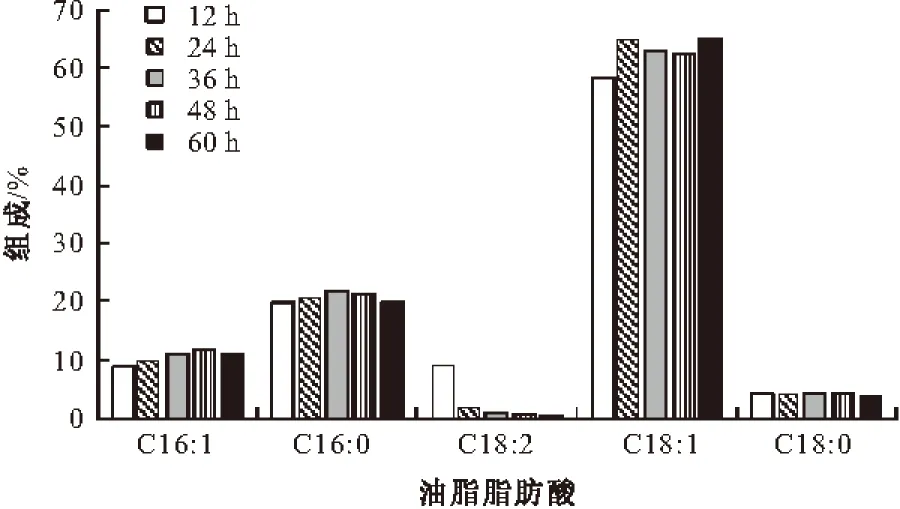
图4 皮状丝孢酵母油脂脂肪酸的组成
由图3和图4可以看出,菌体细胞在发酵过程中主要积累油酸(C18:1),其次为软脂酸(C16:0)和棕榈油酸(C16:1),硬脂酸(C18:0)积累速率较慢,亚油酸(C18:2)基本不积累。脂肪酸组成变化:软脂酸(C16:0)、棕榈油酸(C16:1)、硬脂酸(C18:0)所占比率基本不变,油酸(C18:1)所占比率升高,亚油酸(C18:2)所占比率降低。通过发酵,最终得到的皮状丝孢酵母油脂脂肪酸组成为:油酸(C18:1)64.80%、软脂酸(C16:0)19.90%、棕榈油酸(C16:1)10.94%、硬脂酸(C18:0)3.72%、亚油酸(C18:2)0.56%。
3 结论
对油脂酵母皮状丝孢酵母细胞油脂进行提取,并应用GC-MS对其脂肪酸组成进行了分析。结果表明,菌体的代谢状态分为两个时期:菌体生长期和油脂积累期;菌体细胞主要积累油酸(C18:1)、软脂酸(C16:0)和棕榈油酸(C16:1);通过发酵,最终得到的皮状丝孢酵母油脂脂肪酸组成为:油酸(C18:1)64.80%、软脂酸(C16:0)19.90%、棕榈油酸(C16:1)10.94%、硬脂酸(C18:0)3.72%和亚油酸(C18:2)0.56%。GC-MS可以很好地用于脂肪酸甲酯的分析,具有普遍的应用意义。
[1]Liu T,Vora H,Khosla C.Quantitative analysis and engineering of fatty acid biosynthesis inEscherichiacoli[J].Metabolic Engineering,2010,12(4):378-386.
[2]Liu T G,Khosla C.Genetic engineering ofEscherichiacolifor biofuel production[J].Annual Review of Genetics,2010,44:53-69.
[3]Tornabene T G.Lipid analysis and the relationship to chemotaxonomy[J].Methods in Microbiology,1985,18:209-234.
[4]Sasser M.Identification of bacteria by gas chromatography of cellular fatty acids[J].US Fed Cult Coolection Newsletter,1990,20:1-6.
[5]Miller L,Berger T.Bacteria identification by gas chromatography of whole cell fatty acids[J].Hewlett-Packard Application note, 1985,228:38-41.
[6]Nookaew I, Jewett M C, Meechai A, et al.The genome-scale metabolic modeliIN800 ofSaccharomycescerevisiaeand its validation:A scaffold to query lipid metabolism[J].BMC Systems Biology,2008,2(1):71.
[7]Thakur M S, Prapulla S G,Karanth N G.Estimation of intracellular lipids by the measurement of absorbance of yeast cells stained with Sudan Black B[J].Enzyme and Microbial Technology,1989,11(4):252-254.
[8]Izard J,Limberger R J.Rapid screening method for quantitation of bacterial cell lipids from whole cells[J].Journal of Microbiological Methods,2003,55(2):411-418.
[9]Kimura K,Yamaoka M,Kamisaka Y.Rapid estimation of lipids in oleaginous fungi and yeasts using Nile red fluorescence[J].Journal of Microbiological Methods,2004,56(3):331-338.
[10]Niemann H B, Atreya S K, Bauer S J, et al.The abundances of constituents of Titan′s atmosphere from the GC-MS instrument on the Huygens probe[J].Nature, 2005,438(7069):779-784.
[11]Weatherburn M W.Phenol-hypochlorite reaction for determination of ammonia[J].Analytical Chemistry,1967,39(8):971-974.
[12]Bligh E G,Dyer W J.A rapid method of total lipid extraction and purification[J].Can J Biochem Physiol,1959,37(8):911-917.
