PHB产生菌发酵条件的研究
2011-07-26王玮玥来晨刚曹军卫
涂 毅,王玮玥,张 弘,魏 凯,来晨刚,曹军卫
(武汉东湖学院生命科学与化学学院,湖北 武汉 430212)
由于石化塑料的难降解性,大量废弃塑料流入自然界,造成严重的环境污染,而聚-β-羟丁酸(Poly-β-hydroxybutyrate,PHB)是一种在生态环境中能被完全降解为水和二氧化碳的生物材料,因此是一种可以替代石化塑料的理想的生物可降解塑料。PHB不仅可以用于轻工、化工、食品、农业等现行的塑料应用行业,还可用于医疗卫生、高新技术产品研制等领域。
自1926年首次发现PHB以来,各国学者对其进行了大量的研究,包括产生PHB的微生物,PHB的合成途径、形成动力学和机制,PHB的结构、分子量及生物降解特性等多方面[1,2]。美、德、韩、奥地利等国都已广泛开展PHB的研究[3,4]。国内关于PHB研究的报道并不太多,上海有机所、中科院成都生物所、中科院微生物所、山东大学微生物系偶有PHB研究的信息[5~9]。能合成PHB的微生物分布极广,包括自养和异养、光能和化能菌等,目前已经发现共计65个属中的多个种,其中既有革兰氏阴性菌,也有革兰氏阳性菌[10~15]。
PHB的分子量一般为106Da,熔点为180 ℃,具有高结晶性、光学活性和压电性质,是立体规整的聚合物。如果单体的碳链长度增加,其柔韧性将会大大增强,而熔点及结晶度下降。PHB作为塑料,最好具有60万Da以上的分子量[16]。
神农架林区是一个有着丰富微生物资源的地区,本课题组从神农架林区不同地点采集了多份土壤样本,从中分离得到产生PHB的菌株,并探讨了产PHB菌的最佳发酵条件,从而提高菌株的PHB积累量。
1 实验
1.1 材料
1.1.1 菌株
从神农架林区采集的土样中分离得到。
1.1.2 培养基
无氮培养基[17]:葡萄糖10 g,KH2PO40.2 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g,CaSO4·2H2O 0.2 g,CaCO35 g,蒸馏水1000 mL,pH值7.0,113 ℃灭菌30 min。
平板培养基[17]:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15~20 g,酵母膏 3 g,葡萄糖5 g,蒸馏水1000 mL,pH值7.0,121 ℃灭菌20 min。
种子培养基(g·L-1)[14]:酵母膏10,蛋白胨10,牛肉膏5,硫酸铵5,葡萄糖10,pH值7.0。
基础发酵培养基(g·L-1)[17]:蛋白胨5,酵母膏1,甘油5,葡萄糖5,pH值7.0,121 ℃灭菌20 min。
1.2 方法
1.2.1 菌株的分离
将从神农架林区采集的土样分别标记为1#、2#、3#、4#、5#、6#。每份土壤取少量加入50 mL的无菌生理盐水,混匀,取10 mL上清液接入到无氮液体培养基中,30 ℃摇床振荡培养48 h。
用10倍稀释法将上述PHB产生菌富集液稀释后接种到平板上,于30 ℃培养1~2 d后,挑取单菌落,接种到种子培养基中活化,32 ℃培养24 h后,在235 nm波长处测定其吸收值。然后接种到基础发酵培养基中,32 ℃摇瓶培养144 h,不同时间取样,测定生长曲线和PHB产量。
1.2.2 PHB的测定
取发酵液12 000 r·min-1离心收集细胞,用氯仿水浴加热后,离心,取上清液,真空抽干氯仿,白色颗粒即为PHB粗提物。
PHB粗提物中加入10 mL浓硫酸,100 ℃加热10 min,冷却后在235 nm波长处测定其吸收值[17]。
1.2.3 发酵条件的优化
采用L9(34)正交表,以基础发酵培养基为基础,设定碳源、氮源、pH值3因素3水平的9种不同配方配制培养基,32 ℃培养6 d,提取PHB后在235 nm波长处测定其吸收值,确定产PHB菌的最适发酵条件。正交实验的因素和水平见表1。

表1 正交实验因素与水平
2 结果与讨论
2.1 菌株的分离与PHB的测定
按照1.2.1方法,从2#、3#、4#土样中均分离到了单菌落,挑取单菌落进行培养,重新编号为SNJD-3-Ⅰ、SNJD-3-Ⅱ、SNJD-3-Ⅲ。培养后分别提取PHB,在235 nm波长处都有吸收值,证明分离得到的三株菌都是产PHB的菌株。
挑取待测菌株,接种到种子培养基中活化,32 ℃培养24 h后,按照培养基体积5%接种到基础发酵培养基中,32 ℃摇瓶培养。从第3 d起每天取样提取PHB,测定OD235值;同时取样测定560 nm处培养基的吸光值,绘制细菌生长曲线和PHB产量的进程曲线,结果见图1。
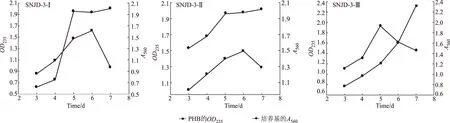
图1 三株菌的PHB产量及其生长曲线
由图1可知,SNJD-3-Ⅰ和SNJD-3-Ⅱ菌株的PHB产量在培养至第6 d时达到最大,此时菌株生长进入稳定期,PHB的积累量达到最大,第7 d明显下降。SNJD-3-Ⅲ菌株的生长在第5 d之后进入衰亡期,可能由于SNJD-3-Ⅲ菌的稳定期很短,不到24 h。而在菌株已经进入衰亡期后,PHB的积累量还在不断增加。
2.2 菌种鉴定
取生长比较好的SNJD-3-Ⅰ菌株显微镜观察,革兰氏染色呈阳性,杆菌,并有芽孢产生,初步鉴定为芽孢杆菌属。
2.3 发酵条件的优化
取生长比较好的SNJD-3-Ⅰ菌株进一步研究。根据基础发酵培养基[17],碳氮比大约为2∶1,因此按比例确定氮源为0.5 g、碳源为1.0 g,定容到50 mL。
正交实验结果见表2。
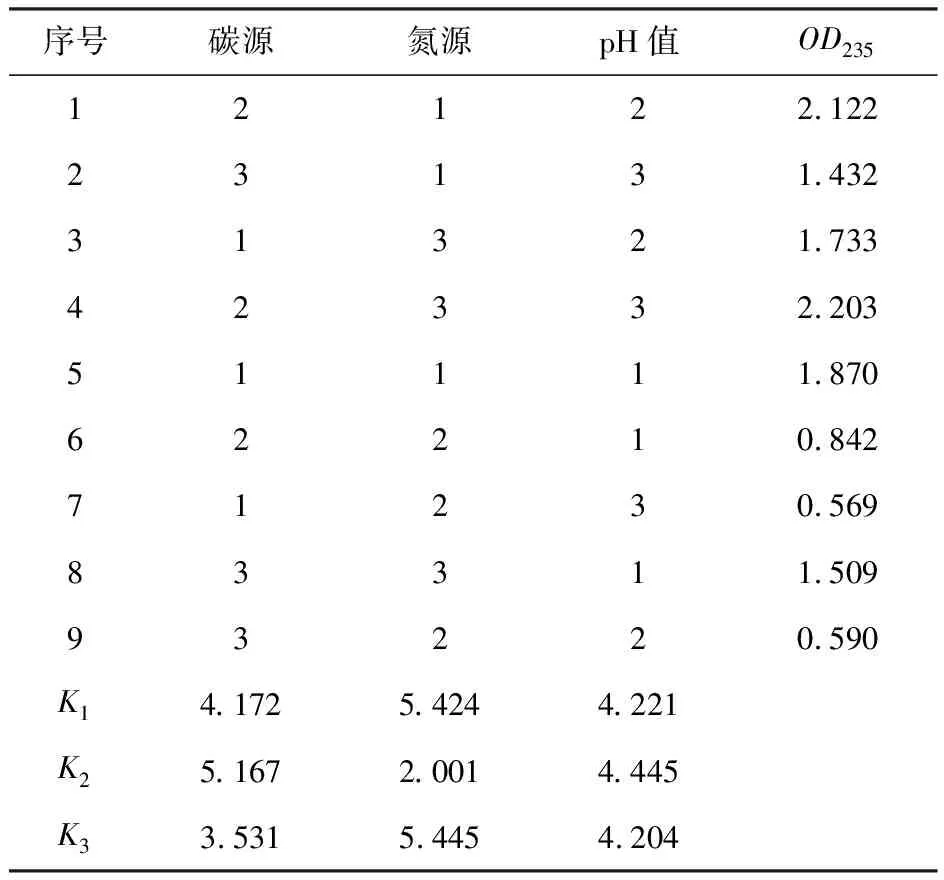
表2 正交实验结果
运用SPSS统计分析软件分析表2数据,绘制方差分析表,见表3。
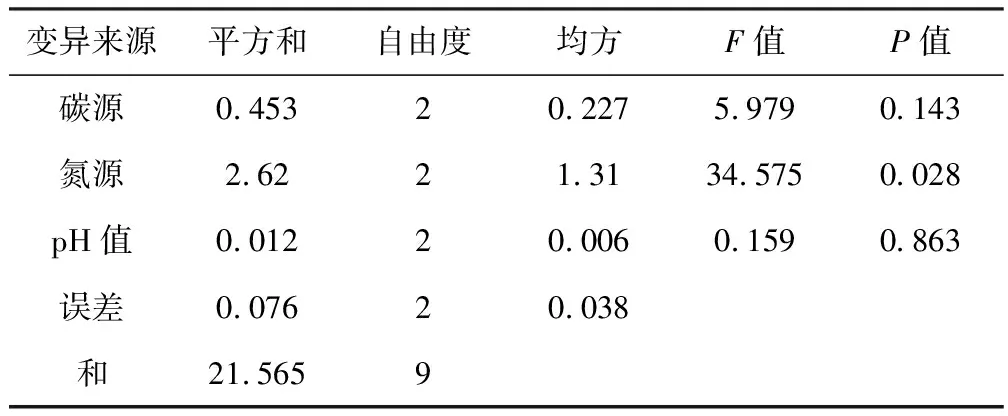
表3 正交实验的方差分析
由表3可知,碳源、氮源、pH值3个因素中,氮源的P值<0.05,表明氮源的3个水平间有显著差异,即氮源种类的选择对实验结果有显著性影响。因此,根据各因素的最优水平,确定SNJD-3-Ⅰ培养的最佳条件是:葡萄糖为碳源,蛋白胨为氮源,pH值为7.0。
在最佳条件下,32 ℃摇床培养6 d后提取PHB,测其OD235值为2.398,大于正交实验中9个不同培养条件下PHB的OD235值,说明在此最佳培养条件下生长的菌株所积累的PHB的量最多,证明正交实验所优化的结果确为SNJD-3-Ⅰ的最优发酵条件。
对照PHB标准曲线来判断PHB含量[18]。根据测得的最佳培养条件下的PHBOD235值(2.398), 计算得SNJD-3-Ⅰ菌株所积累的PHB量为14.72 g·L-1。
3 结论
从神农架林区采集的土样中分离出了可以在细胞内积累PHB的菌株,分析它们产生PHB的能力,并对其中3个菌株的生长曲线和PHB产量进行比较,其中SNJD-3-Ⅰ和SNJD-3-Ⅱ的PHB积累量都在第6 d达到最大,第7 d明显下降,而SNJD-3-Ⅲ的PHB产量在生长曲线出现明显下降后仍呈上升趋势。对SNJD-3-Ⅰ进行革兰氏染色,镜检观察其为革兰氏阳性菌,杆菌,并有芽孢产生,初步鉴定为芽孢杆菌属。通过正交实验确定了SNJD-3-Ⅰ产PHB的最佳发酵条件,即以基础发酵培养基为基础、葡萄糖为碳源、蛋白胨为氮源时,控制碳氮比为2∶1,pH值7.0,32 ℃振荡培养6 d,在该条件下所积累的PHB量为14.72 g·L-1。
[1] 黄海东,王海宾,赵良启.多聚羟基烷酸的发酵生产研究进展[J].山西化工,2002,22(1):13-15.
[2] 堵国城,陈坚,高海军,等.真养产碱杆菌积累聚-β-羟基丁酸发酵条件的研究[J].生物工程学报,2000,16(1):21-24.
[3] 许开天,赵树杰.PHB在生物医学中的应用研究进展[J].应用与环境生物学报,1995,1(1):85-91.
[4] Choi K H,Chisti Y,Moo-Young M.Comparative evaluation of hydrodynamic and gas-liquid mass transfer characteristics in bubble column and airlift slurry reactors[J].The Chemical Engineering Journal and the Biochemical Engineering Journal,1996,62(3):223-229.
[5] 于慧敏,沈忠耀.可生物降解塑料聚-β-羟基丁酸(PHB)的研究与发展[J].精细与专用化学品,2001,9(8):11-14.
[6] 薛林贵,赵旭,景春娥,等.尼罗蓝在筛选PHB高产菌株中的应用研究[J].生物技术通报,2010,(3):181-184.
[7] Low John H,Slepecky Ralph A.Assay of poly-β-hydroxybutyric acid[J].J Bacteriol,1961,82(1):33-37.
[8] 石海平,苏涛.微生物发酵制取聚-β-羟基丁酸研究简介[J].食品与发酵工业,1998,24(2):79-82.
[9] 易祖华,黄和容,陈琦,等.真养产碱杆菌突变株65-7产聚-β-羟基丁酸的研究[J].微生物学通报,1995,22(1):29-31.
[10] Misra A K,Thakur M S,Srinivas P,et al.Screening of poly-β-hydroxybutyrate-producing microorganisms using Fourier transform infrared spectroscopy[J].Biotech Lett,2000,22(15):1217-1219.
[11] 陈琦,黄和容,易祖华.微生物合成生物降解塑料研究现状与展望[J].微生物学通报,1994,21(5):297-303.
[12] 洪葵,陈国强,黄为一,等.羟基丁酸及中链羟基脂肪酸共聚物的微生物合成[J].微生物学通报,1994,21(5):297-303.
[13] 洪葵,陈国强,黄为一,等.羟基丁酸及中链羟基脂肪酸共聚物的微生物合成[J].微生物学通报,1998,25(2):110-113.
[14] 钱新民,王宇新,常钟.球形红杆菌积累β-羟基链烷酸(PHA)的研究[J].微生物学报,1995,35(6):438-441.
[15] 刘宝全,蒋本国.聚-β-羟基丁酸(PHB)的研究进展[J].大连民族学院学报,2000,2(4):56-58.
[16] Steinbuchel A,Valentin Henry E.Diversity of bacterial polyhydroxy-alkanoic acids[J].FEMS Microbiology Letters,1995,128(3):219-228.
[17] 陈宏,方东升,陈秉良.聚-β-羟基丁酸产生菌NS-82的研究[J].微生物学通报,2001,28(4):72-75.
[18] 陈接锋,许旭萍,余晨兴,等.合成聚-β-羟基丁酸(PHB)鞘细菌的分离、鉴定与筛选[J].工业微生物,2003,33(4):23-31.
