聚乙二醇修饰对固体脂质纳米粒胃肠道转运和体内消除的影响
2011-07-20高哲,陈建
高 哲,陈 建
(浙江大学医学院附属第一医院药剂科,杭州 310003)
固体脂质纳米粒(solid lipid nanoparticles,SLN)是继微乳、脂质体、聚合物纳米粒之后,发展起来的一种新型毫微粒类给药系统。它具有物理稳定性高、可以控制药物的释放、避免药物的降解或泄漏的优势,毒性低、生理相容性好,是一种很有发展前景的药物给药系统[1-3]。但SLN在体内对单核细胞吞噬系统(mononuclear phagocyte system,MPs)有趋向性,使其在网状内皮系统(reticuloendothelial system,RES)的分布增加,体内循环时间减少[4]。有研究发现通过聚乙二醇(polyethylene glycol,PEG)修饰SLN可以提高SLN在体内的循环时间,减慢消除[5]。然而对于口服 PEG修饰 SLN后对胃肠道转运的影响还未见报道。本研究通过合成荧光标记不同含量和聚合度PEG-SLN,以SD大鼠为模型,检测口服PEG-SLN后在体内浓度变化,以期系统阐明PEG对SLN在胃肠道转运和体内消除的影响。
1 材料与方法
1.1 仪器
硬脂酸(stearic acid,SA,上海化学试剂采购供应站),聚乙二醇-硬脂酸酯(PEG-SA,Kasei Kogy Co.,Japan),硬脂胺-异硫氰基荧光素嫁接物(Octadecylamine-fluorescein isothiocyanate,ODA-FITC,自备,制备方法见参考文献[6]),SD大鼠(浙江大学医学院实验动物中心),其他溶剂和试剂均为色谱纯或分析纯。荧光分光光度计(F-2500,HITACHI Co.,Japan),微粒粒度及表面电位分析仪(Zetasizer 3000HS,Malvern,UK),冷冻干燥机(Freezone 2.5 plus,Labconoco Co.,USA),核 磁 共 振 仪 (AC-80, BrukerBiospin,Germany)。
1.2 方法
1.2.1 荧光标记PEG-SLN的制备 精密称取硬脂酸60 mg,ODA-FITC 荧光嫁接物4.8 mg,PEG 2000-SA(使与硬脂酸的比例分别为 0.67%、1.3%、2.0%、2.6%,mol/mol),或不同聚合度的PEG-SA适量(使PEG1300-SA、PEG 2000-SA和PEG2700-SA与硬脂酸的比例均为1.3%,mol/mol),加入无水乙醇6 mL,超声使完全溶解。以蒸馏水为分散介质,在70℃水浴、400 r/min机械搅拌条件下,将有机相迅速注入60 ml分散介质中,得PEG修饰荧光标记SLN分散液。以盐酸调节pH至1.2,使纳米粒絮凝,微孔滤膜过滤得到纳米粒沉淀。将纳米粒沉淀再分散至3 ml 0.1% 泊洛沙姆188溶液中,探头超声处理,得到荧光标记不同修饰比例PEG2000-SLN和不同聚合度PEG-SLN再分散液。
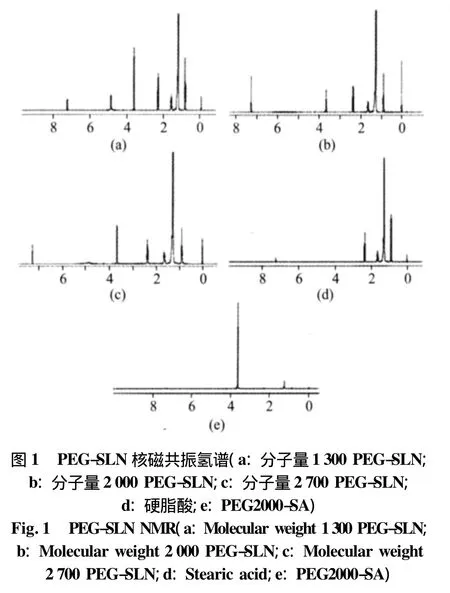
1.2.2 PEG-SLN核磁共振试验和修饰率 取适量PEG-SLN溶于氘代氯仿中,作核磁共振检测得PEGSLN的核磁共振氢谱。对PEG特征1H峰(化学位移3.7)和 CH3特征1H峰(化学位移0.8)进行积分,并根据公式(1)、(2)计算PEG含量摩尔百分比和修饰率:

1.2.3 PEG-SLN粒径和 Zeta电位 取 PEG-SLN再分散液,以蒸馏水稀释400倍,用微粒粒度与Zeta电位测定仪测定平均粒径和Zeta电位。
1.2.4 PEG-SLN血样测定标准曲线 取适量PEG-SLN加至血液(含有肝素溶液抗凝)中形成脂质浓度为200 μg/ml的分散液。移取适量,用全血稀释至脂质浓度为 5、10、25、50、100 μg/ml的标准分散液,水浴37℃孵育5 min,加入同等体积乙腈,漩涡振荡3 min混匀,8 000 r/min,离心半径6 cm,离心10 min后取上清液,荧光分光光度法(Ex:495 nm,Em:514 nm,slit:5 nm)测定,根据荧光值绘制标准曲线。
1.2.5 PEG-SLN口服后胃肠道转运和体内消除取SD大鼠若干,随机分为两组,使每组大鼠为10只。实验前禁食12 h。按照150 mg PEG-SLN/kg的剂量分别给各实验组大鼠灌胃不同比例修饰(PEG2000-SA,0.67%、1.3%、2.0%,mol/mol)和不同聚合度(PEG1300-SA、PEG2000-SA,PEG2700-SA,1.3%,mol/mol)PEG修饰的SLN再分散液,分别于0、0.5、1、2、4、6、8、10、12 h 从尾静脉取血,肝素抗凝,按照1.2.4 法分析测定。
2 结 果
PEG-SLN核磁共振氢谱,见图1。由图可见,经PEG(Mw 1 300、2 000、2 700)修饰后的 SLN 图谱中同时有硬脂酸分子中基团特征峰(化学位移0.8)和PEG-SA分子中(CH2CH2O)基团特征峰(化学位移3.7),证明PEG已修饰到SLN表面。

不同投量和聚合度PEG在SLN中修饰率计算结果见图2。采用溶剂扩散法制备对PEG-SA具有较高的修饰率。由图可见,PEG投量提高,PEG修饰率稳定为72%,当PEG投量增加到2.6%,mol/mol时,修饰率下降至58%,说明采用溶剂扩散法制备SLN对PEG-SA的包载有饱和趋势。PEG聚合度提高,修饰率略有下降,可能因为PEG的聚合度越大,空间位阻和在水中的运动黏度也就越大,不利于SLN对PEG的包裹。
以溶剂扩散法制备的PEG-SLN,粒径和电位考察结果见表1。由表可见,随着制备处方中 PEG 2000-SA用量的增加,SLN粒径从200.3 nm逐渐增至306.3 nm。当PEG聚合度(Mw)逐渐变大,PEGSLN粒径没有发生明显变化。SLN未经PEG修饰的粒径约为200 nm,PEG链长的改变对SLN粒径影响不明显。SLN的粒径主要由所选用的脂质材料和制备方法本身性质所决定。
各组的Zeta电位都也比较接近,约为-24 mv左右。
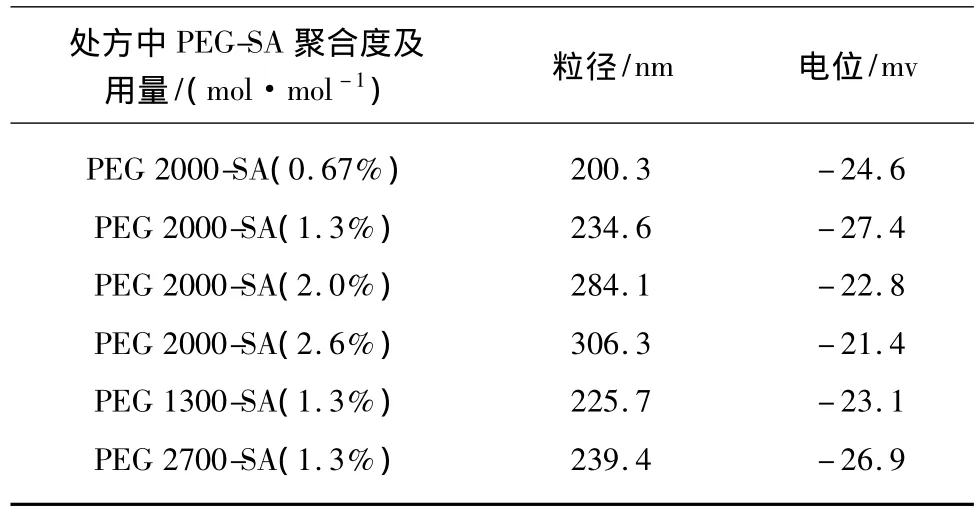
表1 不同修饰比例、不同聚合度PEG-SLN的粒径和Zeta电位Tab.1 Different modification proportion,different degree of polymerization PEG-SLN particle size distribution and Zeta potential
PEG修饰的SLN在血液中的平均回收率为32.1%,RSD<15%,具有良好的重现性。精密度测定RSD<15%,该血样处理方法满足后续试验要求。
PEG-SLN在血样中标准曲线考察结果。由图可见,PEG-SLN在血样中的线性方程分别为Y=3.56 x -0.18(PEG2000-SA,0.67%,mol/mol)、Y=4.62x+8.11(PEG2000-SA,1.3%,mol/mol)、Y=6.96x - 7.51(PEG2000-SA,2.0%,mol/mol)、Y=7.06x+7.61(PEG1300-SA,1.3%,mol/mol)和 Y=10.68x+1.84(PEG2700-SA,1.3%,mol/mol)。线性良好(r>0.99),线性范围均为5 ~100 μg/ml。
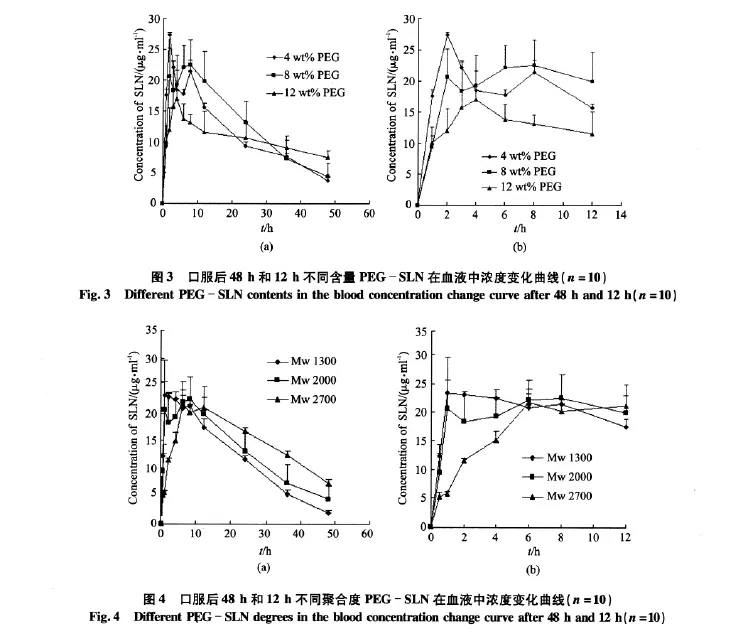
大鼠口服不同含量(0.67%、1.3%、2.0%,mol/mol)PEG修饰SLN后的体内浓度变化曲线见图3。由图可见,PEG含量越低,口服1~2 h后SLN浓度越高,说明PEG含量提高不利于SLN的胃肠道吸收。因为PEG含量增加,覆盖于SLN表面的PEG侧链越多,越不利于SLN的淋巴转运,使吸收速率降低。至8 h,PEG含量越高,其体内的消除速度越慢,说明PEG含量的提高有助于提高SLN的体循环时间。
大鼠口服不同聚合度(Mw 1 300、Mw 2 000、Mw 2 700)PEG修饰SLN后的体内浓度变化曲线见图4。由图可见,PEG聚合度越大,在口服后1~4 h,SLN浓度越小,说明PEG聚合度越大对SLN在胃肠道内吸收有阻碍。至12 h,PEG聚合度越大,SLN消除越慢,表明PEG聚合度变大有利于PEG-SLN的“隐匿”。
3 讨 论
本研究采用了一种新型的合成荧光素嫁接物——硬脂胺-异硫氰基荧光素作为荧光标记物。在N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)中,硬脂胺的氨基能与异硫氰基荧光素(fluorescein isothiocyanate,FITC)发生加成反应,形成 ODA-FITC。由于硬脂胺-FITC的疏水链和硬脂酸性质相近,具有较强亲和力,使两者能够紧密结合,不易分离,是理想的硬脂酸SLN荧光标记物[6]。
通过水性溶剂扩散法制备得到的PEG-SLN,其平均粒径为200.3 ~306.3 nm,表面电位约为 -24 mv,与未经修饰的SLN相比,变化不显著。由于PEG亲水性较强,故在溶剂扩散法制备过程中更易趋向于极性较大的水性溶剂而富集于脂质表面。经核磁共振考察确认PEG成功嫁接到SLN表面。当PEG-SA的投量在12 wt%以下时,PEG修饰率稳定在72%,说明通过溶剂扩散法制备PEG-SLN有效而简便。
先前的研究已发现,PEG-SLN体内的循环时间较未经PEG修饰的SLN大大延长,具有长循环作用,而SLN主要通过淋巴吸收途径进入体循环[5]。外源性脂质通常在小肠内水解成脂肪酸和甘油酯,由肠黏膜一些脂蛋白结合形成乳糜微粒(CM)后,经淋巴吸收。脂质在淋巴液中的溶解度是影响淋巴转运效率和速度的重要因素[7-8]。PEG作为一种亲水性较强的长链聚合物,对SLN修饰后使SLN表面亲水性增强,不利于SLN对脂蛋白的吸附,使SLN在淋巴液中溶解度降低,阻碍SLN的淋巴转运,导致SLN胃肠道吸收速度下降。PEG的含量越高,聚合度越大,胃肠道的吸收速度越低。
经PEG修饰后微粒在体内具有长循环作用,主要与PEG修饰后SLN可以避免调理素等识别,防止被网状内皮系统(RES)的摄取有关[9]。本研究表明,SLN表面PEG的含量越高,聚合度越大,其干扰蛋白吸附到SLN表面的能力越强,更有效地避免SLN被巨噬细胞吞噬。SLN中PEG含量和聚合度改变对药物的释放影响同样明显。已有报道,微粒中PEG含量的增大使药物的前期突释更为严重,释放的速率更快。主要由于PEG可以在微粒中构成一种分子核或分子通道,更有利于药物的扩散。PEG含量越多,这样的分子核或分子通道也就越多,则药物释放越快[10]。
综上所述,PEG含量和聚合度提高会减慢SLN在胃肠道内吸收,延长SLN体循环时间,加快药物的释放。因而对SLN进行PEG修饰须综合考虑吸收、药物释放以及体内循环时间等多方面因素,根据实际所载药物特性,选择一个最佳PEG聚合度和投量比例。
[1]Bargoni A,Cavalli R,Caputo O,et al.Solid lipid nanoparticles in lymph and plasma after duodenal administration to rats[J].Pharm Res,1998,15:745-750.
[2]Hu FQ,Yuan H,Zhang HH,et al.Preparation of solid lipid nanoparticles with clobetasol propionate by a novel solventdiffusion method in aqueous system and physicochemical characterization [J].Int J Pharm,2002,239:121-128.
[3]Jurodo JM,Blancas I.Accuracy of setinael lymph node(SLN)biopsy after neoadjuvant chemotherapy(NC)for breast cancer[J].J Clin Oncol,2010,28(15):e11029.
[4]Florence AT,Hillery AM,Hussain N,et al.Nanoparticles as carriers for oral peptide absorption:studies on particles uptake and fate[J].J Control Rel,1995,36:38-46.
[5]Oyewumi MO,Yokel RA,Jay M,et al.Comparison of cell uptake,biodistribution and tumor retention of folatecoated and PEG-coated gadolinium nanoparticles in tumor-bearing mice[J].J Control Rel,2004,95:622-623.
[6]Yuan H,Chen J,Du YZ,et al.Studies on oral absorption of stearic acid SLN by a novel fluorometric method [J].Colloids and Surfaces B:Biointerfaces,2007,58:157-164.
[7]Florence AT,Sakthivel T,Toth I.Oral uptake and translocation of a polylysine dendrimer with a lipid surface[J].J Control Rel,2006,65:253-259.
[8]Jana P,Aiman H.Lipid nanoparticles in cosmetic and pharmaceutical dermal products[J].Int J Pharm,2009,366(1-2):170-184.
[9]Percchia MT,Fattal E,Desmaele D,et al.Stealth PEG ylated polycyanoacrylate nanoparticles for intravenous administration and splenic targeting[J].J Control Rel,1999,60:128.
[10]邹耀邦,王璐,刘孝波.聚乙二醇(PEG)活化及其在药物释放和反应载体中的应用[J].世界科技研究与发展,2003,(25)2:63-68.
